- •Федеральное агентство по образованию рф
- •Введение
- •Литературный обзор
- •2.1 Исторический обзор
- •Пиразин. Общая характеристика
- •Нахождение в природе
- •2.4 Получение пиразинов
- •Строение пиразина и его производных
- •Химические свойства пиразина.
- •Электрофильное Замещение
- •Нуклеофильное замещение
- •Реакция с радикалами.
- •Металлирование галогендиазинов
- •Реакционноспособность заместителей боковой цепи
- •Окисление
- •Восстановление.
- •Производные пиразина
- •Аминопиразины.
- •Гидрированные пиразины.
- •Метилпиразины.
- •3. Обсуждение результатов
- •3.1 Синтез 1-[3-замещенных пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.1.1. Хлорирование 2-хлорпиразина сульфурилхлоридом
- •3.1.2. Синтез 2-хлор-3-(замещенных)пиразинов
- •3.1.3. Использование каталитической системы kf/Al2o3 для активации атома хлора в реакциях нуклеофильного замещения
- •Ямр 1н спектр 1-[3-(м-толилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты
- •3.2. Амиды 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.2.1. Синтез карбамидных производных
- •3.2.2. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •3.2.3. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида (ароматическая зона)
- •4. Экспериментальная часть
- •4.1.5. Методика получения 2-хлор-3-(замещенного)пиразина
- •4.1.6. Методика получения 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •4.2. Общая методика получения амидов 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •4.3. Физико-химические методы исследований
- •6. Список литературы
- •Приложение
- •Данные спектров 1н ямр производных 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты в дмсо-d6, δ (м. Д.), j (Гц)
- •В дмсо-d6, δ (м. Д.), j (Гц)
- •Физико-химические свойства исследуемых веществ
- •Физико-химические свойства исследуемых веществ
Нуклеофильное замещение
Нуклеофильное замещение может быть разделено на:
а)Замещение с гидридным перемещением (прямое замещение водорода) иб) смещение других заместителей.
Диазины легко присоединяют реактив Гриньяра, а также алкил- и ариллитиевые соединения с образованием неароматических продуктов. Их ароматизация с отщеплением гидрида требует более жестких условий окисления, чем ароматизация соответствующих дигидропиридинов, что, вероятно, связано с более низкой энергией резонанса диазинов. Интересно отметить, что пиридазины с алкиллитием реагируют по С3-атому, а с реактивом Гриньяра — по С4-атому, тогда как в пиримидинах присоединение идет только по четвертому, а не по второму атому углерода. Причины такой ориентации пока не ясны.
Смещения типа а) редки и характеризуется реакцией Чичибабина. Пиразин реагирует с NaNH2/NH3 , чтобы получить 2-аминопиразин.Аминирование пиразина и его производных амидом натрия является реакцией, которая демонстрирует восприимчивость ядра пиразина к атакам нуклеофильных реагентов[6].
Схема 17

Вообще синтез аминопиразинов, аминохиноксалинов и аминофеназинов достигнут альтернативными методами, особенно замещением галогена. Влияние второго кольцевого азота наглядно проявляется в реакциях нуклеофильного замещения галогена под действием обычных реагентов: 2-хлорпиридин в этих реакциях значительно менее активен, чем 2-хлорпиразин и 3-хлорпиридазин[43].
Схема 18

Феназин реагирует с бензолсульфокислотой кислотой в спиртовом растворе хлорида.
Схема 19

По-видимому, промежуточным соединением является 5,10– дигидрофеназин. Данная реакция – хороший метод получения дизамещенного феназина, так как сульфогруппа легко замещается.
Направление смещения заместителей в нуклеофильных реакциях изменяется в зависимости от вступающего в реакцию замещения реагента.
2-галопиразины являются более реакционноспособными, чем 2-галопиридины, и 2-галохинолины являются более реакционноспособными, чем галопиразины.
В случае галофеназинов и хинолинов нуклеофильное замещение невозможно, однако, известно, что 2 – хлорофеназины реагируют с нуклеофильными заместителями; образуется аминофеназин с высоким выходом [44].
Монохлорпиразины подвергаются всем ожидаемым реакциям замещения нуклеофилами, такими как: CN, аммиак, алкиламины, тиолами, другими группами, такими какSMe,SO2Me. Одна из нитрильных групп в 2,3 – дицианопиразине, очень неустойчива и замещается при нагревании ДМФА со спиртом, третичным амином в качестве катализатора.
Нуклеофильное замещение часто не следует простому механизму. Реакции нуклеофильного замещения показаны как простые реакции по механизму – присоединения-отщепления (схема 20)[7]
Схема 20

но доказательства, представленные для данной реакции, показывают, что во многих случаях это упрощенный механизм. Хлорпиразин реагирует с амидом в жидком аммиаке, для получения смеси аминопиразина, 2-цианоимидазола и имидазола (схема 21).
Схема 21

Схема 22

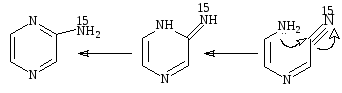
Возможно самое убедительное доказательство о нуклеофильном замещении в неожиданное положение в кольце доказывается из непосредственного наблюдения промежуточных комплексов в спектре ЯМР. Когда 2 – хлоро – 3,6 – дифенилпиразин взаимодействует сKNH2 в жидком аммиаке, наблюдается непосредственно промежуточное звено20[8,9]
Схема 23

20 21
Первоначально сформированный комплекс перестраивается 21, который дает наблюдаемый продукт устранением иона хлора.
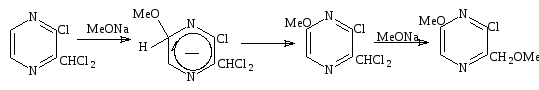
Обработка 2 – хлоро – 3 – дихлорометилпиразина избытком MeONaприводит к введению метоксигруппы в шестое положение в кольце пиразина. Эта реакция сопровождается потерей хлорид – иона от дихлорметильной стороны цепи.
Схема 24