
- •Федеральное агентство по образованию рф
- •Введение
- •Литературный обзор
- •2.1 Исторический обзор
- •Пиразин. Общая характеристика
- •Нахождение в природе
- •2.4 Получение пиразинов
- •Строение пиразина и его производных
- •Химические свойства пиразина.
- •Электрофильное Замещение
- •Нуклеофильное замещение
- •Реакция с радикалами.
- •Металлирование галогендиазинов
- •Реакционноспособность заместителей боковой цепи
- •Окисление
- •Восстановление.
- •Производные пиразина
- •Аминопиразины.
- •Гидрированные пиразины.
- •Метилпиразины.
- •3. Обсуждение результатов
- •3.1 Синтез 1-[3-замещенных пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.1.1. Хлорирование 2-хлорпиразина сульфурилхлоридом
- •3.1.2. Синтез 2-хлор-3-(замещенных)пиразинов
- •3.1.3. Использование каталитической системы kf/Al2o3 для активации атома хлора в реакциях нуклеофильного замещения
- •Ямр 1н спектр 1-[3-(м-толилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты
- •3.2. Амиды 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.2.1. Синтез карбамидных производных
- •3.2.2. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •3.2.3. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида (ароматическая зона)
- •4. Экспериментальная часть
- •4.1.5. Методика получения 2-хлор-3-(замещенного)пиразина
- •4.1.6. Методика получения 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •4.2. Общая методика получения амидов 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •4.3. Физико-химические методы исследований
- •6. Список литературы
- •Приложение
- •Данные спектров 1н ямр производных 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты в дмсо-d6, δ (м. Д.), j (Гц)
- •В дмсо-d6, δ (м. Д.), j (Гц)
- •Физико-химические свойства исследуемых веществ
- •Физико-химические свойства исследуемых веществ
Строение пиразина и его производных
Пиразины являются ароматическими соединениями, а также третичными аминами, и их свойства очень напоминают свойства пиридинов. Пиразиновое ядро можно рассматривать как резонансный гибрид, две из налагающихся структур которого (I и II) аналогичны структурам бензола.

I II III
Пиразин — бесцветное кристаллическое вещество со слабым запахом; т. пл. 57 °С, т. кип. 118 °С, растворяется в воде. Большинство его низших гомологов — жидкости при комнатной температуре. Его получают каталитическим дегидрированием пиперазина. Используют в органическом синтезе. Пиразины легко возгоняются и могут быть перегнаны с паром. Подобно многим другим аминам, пиразины образуют гидраты и по удалении из последних гидратной воды нагреванием или с помощью дегидратирующих средств часто получаются гигроскопичные вещества. Рентгеноструктурный анализ показывает, что длины связей С—С близки к длинам связей в пиридине и бензоле[7]
Длины связи C-N– 1.395A,C-C– 1.341A,C-H– 1.085A. энергия делокализации пиразинового кольца – 75 кДж*моль.
Химические свойства пиразина.
Электрофильное Замещение
Известно, что пиридин весьма мало склонен к электрофильному замещению. Атом азота стягивает на себя электронную плотность, так как он более электроотрицателен, чем углерод. Кроме того, электрофильные агенты в первую очередь атакуют атом азота, образуя на нем электроположительный центр. Предполагается, что введение второго атома азота в кольцо оказывает следующий эффект: пиразин хуже вступает в реакцию электрофильного замещения, чем пиридин. Следует ожидать, что электроотрицательность двух атомов азота будет иметь определенное влияние, как на основные, так и на ароматические свойства пиразинов. Неподеленные электронные пары на кольцевых атомах азота являются причиной дезактивации кольца, в результате чего они могут реагировать с электрофильными заместителями, образовывая сопряженную кислоту 9 с положительным зарядом на атоме азота, вследствие чего невозможно дальнейшее взаимодействие с электрофилом[39]:
9
Схема 15

10 11 12
При введении заместителей в кольцо с +Iили +М эффектом, возможно протекание реакций электрофильного замещения. При взаимодействии 2-амино-3-метоксикарбонилпиразина10с хлором в уксусной кислоте атака хлором идет в пятое положение и по аминогруппе во втором положении (Схема 1). Однако соединение11 переводят в амин, используя бисульфид натрия. Для 2-амино-3-бромпиразина проводят бромирование в гидробромистой кислоте, чтобы получить 2-амино-3,5-дибромпиразин.
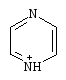
Заслуживает внимания и реакция 2,5-диметилпиразина с йод- или бромуксусной кислотой Продуктом этой реакции является соль 1,2,5-триметилпиразина. Промежуточно образующиеся пиразинийуксусные кислоты не могут быть выделены. Предполагаемое течение реакции отображено в схеме 16:
Схема 16
Высокая селективность наблюдается при хлорировании 2-алкилпиразина с сульфохлоридом/ДМФА. Реакция между данным агентом хлорирования и алкилпиразином является экзотермической, (при поддержании температуры приблизительно 20°С во время введения реактива), выход составляет около 30%. При данных условиях пиразин выборочно хлорируется в третье положение, ДМФА здесь играет решающую роль (в его отсутствие наблюдается небольшая кольцевая хлоризация). При использовании в реакции смесиPOCl3/PCl5 идет образование 3-алкил-5-хлорпиразина[9].
Реакции электрофильного замещения в хиноксалине и феназине необычны, ввиду увеличения резонанса можно было бы предсказать, что электрофильное замещение должно быть более поверхностным, чем в непосредственно в пиразине. В случае хиноксалина электронные вычисления указывают самую высокую локализацию электронной плотности в положениях 5 и 8, замещения идет в эти положения. Нитросоединение получается при определенных условиях, например, при взаимодействии хиноксалина со смесью: концентрированной азотной кислотой и олеума при 90°С в течении 24 часов, выход 5-нитрохиноксалина составляет 15%13. Главный продукт 5,6-динитрохиноксалин14, получается с выходом 24%.

13 14
Когда заместители присутствуют бензольном кольце, замена обычно становится более поверхностной и происходит в соответствии с предположениями, основанными на теории валентности. Если заместители присутствуют в кольце гетероцикла, ситуация изменяется в зависимости от условий реакции; таким образом 2-хиноксалинон в уксусной кислоте приводит к 7 – нитро – 2 - хиноксалинону15, тогда как нитрат со смешанной кислотой приводит к 6 – нитропроизводному16. Различия в продуктах отражает различия в разновидностях нитратов: нейтральные 2 - хиноксалинон в уксусной кислоте и дипротонированные17. [4]

151617
В случае феназина замена в кольце гетероатома не возможна без полного разрушения ароматического характера молекулы. Как пиразин и хинолин, феназин является очень устойчивым к обычным электрофильным агентам, используемым в реакциях замещения. Феназин хлорируется в кислой среде молекулярным хлором, с образованием 1-хлоро; 1,4 – дихлоро; 1,4,6 – трихлоро и 1,4,6,9 – тетрахлоропроизводных, структуры которых были доказаны независимым синтезом.
Появившиеся противоречия относительно нитрофеназина были разъяснены Альбертом и Дювеллом. В ранним работах они предположили, что 1,3 – динитрофеназин может быть получен с 66% - ым выходом при стандартных условиях; однако на практике это была смесь 1 – нитрофеназина и 1,9 – динитрофеназина 18.
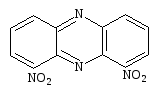
18
Как в пиразине и хинолине заместители в бензольных кольцах увеличивают реакционноспособность, в соответствии с теорией валентности; таким образом нитрат 2 – метокси и 2 – гидроксифеназина приводит к замещению в первое положение.
Сульфофеназин образуется при определенных условиях. Моносульфопроизводное получается в олеуме, содержащим 50-70% SO3 в присутствииHgSO4 приt= 170°С в течении длительного времени. Моносульфокислота окрашенная в желтый цвет; вероятно, существует как бетаин19.
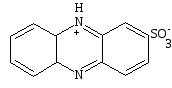
19
Положение сульфогруппы было подтверждено, при взаимодействии нагретой соли натрия сульфокислоты с NaCN, образовался соответствующий нитрил, образующий феназин – 2 – карбоновую кислоту[5].
