
Учебник
.pdfклеточных мембран. Отражением разных пулов фосфора в организме являются фракции фосфора в крови. В плазме Фнеорг. содержится в виде анионов НРО4-2 и Н2РО4-. Около 95% – это свободные анионы, оставшаяся часть связана с белком. Фосфор и кальций образуют плохо растворимые соединения, поэтому их общая концентрация не превышает определенного уровня и повышение одного из них, как правило, сопровождается снижением другого. Обмен фосфатов и тесно связанный с ним обмен кальция регулируют биологически активная форма витамина D – кальцитриол
(гиперфосфатемический эффект), паратгормон (эффект зависит от уровня кальцитриола), кальцитонин (гипофосфатемический эффект).
Гипофосфатемия ниже 0,3 ммоль/л может сопровождаться нарушением энергетического обмена в клетках, проявляющегося рабдомиолизом,
неврологической симптоматикой. Клинические симптомы, ассоциированные с гиперфосфатемией, обусловлены, как правило, одновременно развивающейся гипокальциемией.
Референтные пределы: 0,87-1,45 ммоль/л.
Увеличение концентрации:
гипопаратиреоз, псевдогипопаратиреоз;
острая и хроническая почечная недостаточность;
остеолиз при злокачественных опухолях (особенно при метастазировании), лейкозах.
Уменьшение концентрации:
дефицит витамина D (остеомаляция, рахит, семейный гипофосфатемический рахит, при синдроме мальабсорбции);
первичный гиперпаратиреоз;
выраженная гиперкальциемия различной этиологии;
эктопический синтез паратгормона злокачественными опухолями.
Диагностическое значение определения хлора. Хлор – основной
анион, компенсирующий влияние катионов, в первую очередь натрия, во
621
внеклеточной жидкости. В физиологических условиях изменения концентрации хлора в крови вторичны к изменениям других электролитов и направлены на создание электронейтральности среды. При потере хлорида развивается алкалоз, при избытке – ацидоз. Изолированное изменение концентрации хлорида наблюдается при нарушениях кислотно-щелочного баланса. Определение хлоридов в крови используется чаще всего при оценке кислотно-щелочного баланса. Хлор – основной анион секретов желудка.
Референтные пределы: 98-107 ммоль/л.
Гиперхлоремия:
обезвоживание;
почечный канальцевый ацидоз;
метаболический ацидоз при длительной диарее с потерей бикарбонатов;
интоксикация салицилатами;
Гипохлоремия:
усиленное потоотделение, в том числе при секреторных дисфункциях и гормональном дисбалансе;
длительная, повторная рвота в связи дуоденальной язвой, высокой кишечной непроходимостью, стенозом привратника;
метаболический гипокалиемический ацидоз.
Исследование хлора в поте считается достоверным тестом в диагностике муковисцидоза. Тест дает положительные результаты на 3-5
неделе жизни пораженных детей. Результаты теста могут быть в пределах нормы у больных с истощением запасов солей, например в жаркую погоду.
Дополнительные исследования электролитов предупреждают неправильное толкование. Кожные поражения и сыпь могут приводить к завышению результатов.
Содержание хлора в поте: норма 5-35 ммоль/л, пограничные значения30-70 ммоль/л, муковисцидоз 60-200 ммоль/л
622
Диагностическое значение определения меди. Медь участвует во многих ферментативных процессах в качестве активатора или как составная часть активного центра ферментов. Из медь-содержащих гидролаз широко распространена тирозиназа, участвующая в образовании кожного пигмента меланина. Недостаток этого фермента или его блокада в меланоцитах приводят к альбинизму. Свободные ионы меди, также как ионы других металлов с переменной валентностью, могут инициировать перекисное повреждение белков и липидов. Поэтому медь в сыворотке присутствует исключительно в форме, связанной с церулоплазмином (95%) и альбумином
(5%). Церрулоплазмин проявляет антиоксидантную активность – функционируя как ферроксидаза в плазме крови, он восстанавливает свободные ферри-ионы в ферро-ионы, связывающиеся белком трансферрином. Дефицит Cu наблюдается у детей (особенно у недоношенных), получающих продукты с дефицитом Cu, у больных на парентеральном питании с недостатком микроэлементов. Проявления дефицита Cu включают нейтропению, анемию, остеопороз, костно-суставные нарушения, снижение пигментации кожи. Симптомы отравления медью:
тошнота, рвота, головные боли, понос, боли в животе, в тяжелых случаях могут развиться поражение печени, желтуха и гемолитический шок.
Отравление медью может быть при введении медь-содержащих растворов,
медь-содержащих внутриматочных спиралей. Болезнь Вильсона-Коновалова
– генетически обусловленное нарушение метаболизма Cu, характерным является прогрессирующее поражение нервной системы и печени,
обусловленные токсическими эффектами меди, откладывающейся в этих органах. В то же время в сыворотке содержание меди и церулоплазмина снижено, увеличесна экскреция меди с мочой.
Референтные значения: мужчины 11,0-22,0, женщины 13,3- 4,3 мкмоль/л.
Увеличение концентрации:
623
чаще всего обусловлено поступлением меди в кровь из разрушенных
клеток;
инфекции, острое и хроническое воспаление;
лейкоз, лимфогранулематоз;
введение медь-содержащих растворов.
Уменьшение концентрации:
болезнь Вильсона–Коновалова;
синдром Менкеса (болезнь «курчавых волос»);
диффузные поражения тонкой кишки в связи с нарушением всасывания меди (целиакия, спру).
5.6.3. Кислотно-основное состояние
Кислотность или щелочность раствора зависит от концентрации в нем свободных ионов водорода (Н+). Показателем этой концентрации служит рН.
При увеличении оснований без повышения кислот, значение рН увеличивается, если повышается кислота, то рН снижается. рН артериальной крови в норме поддерживается в ограниченном диапазоне между 7,35 и 7,45
единиц. Значения рН ниже 7,35 свидетельствуют об ацидозе, значения рН выше 7,45 указывают на развитие алкалоза.
Образование кислот и оснований в процессе обмена веществ и
выделение их из организма. В процессе клеточного метаболизма непрерывно образуются кислоты. Избыток ионов Н+постоянно выводится из организма для поддержания устойчивого состояния. Клетки являются постоянным источником углекислого газа и нелетучих кислот. Как нелетучие кислоты,
так и СО2 в плазме способствуют повышению концентрации ионов Н+. В
покое человек выделяет 230 мл СО2 в 1 мин или около 15000 ммоль/день. Это потенциально сопровождается исчезновением из крови 15000 ммоль Н+
(летучие кислоты). В организме примерно 1 ммоль/кг/день Н+ образуется в виде нелетучих кислот, таких как H2SO4 и Н3РО4. Кислотность крови,
выражением которой является рН, зависит от соотношения ряда факторов:
624
величины легочной вентиляции, функции почек, уровня оксигенации,
интенсивности метаболиченских реакций, состояния гемодинамики и др. рН отражает взаимодействие этих факторов. В то же время определение только рН не позволяет установить возможные причины нарушения кислотно-
основного состояния (КОС).
Механизмы регуляции рН крови. Непосредственно за поддержание постоянства рН крови отвечают буферные системы, из которых наиболее важной является бикарбонатный буфер. Буферная емкость этого буфера, а
значит и физиологическая способность противостоять изменениям концентрации иона Н+, составляет более половины всей буферной емкости крови. Составные части этого буфера – угольная кислота (Н2СО3) и ионы бикарбоната (НСО3-). Угольная кислота – нестойкое соединение, разлагается с образованием воды и двуокиси углерода, последний через дыхательную систему удаляется в атмосферу. Учитывая эту особенность, бикарбонатную буферную систему называют летучим буфером
Действие бикарбонатного буфера дополняется в организме действием нелетучих буферных систем, наиболее важным из которых является гемоглобиновый буфер, составляющий около одной трети всей буферной емкости крови. Кроме того, в организме суфествуют еще фосфатный и белковый буфер. При оценке способности крови противостоять изменению рН нужно принимать во внимание участие всех буферных систем крови.
Показателем, характеризующим это свойство, является концентрация буферных оснований крови (ВВ, по международной номенклатуре Buffer Bases) состоящая из бикарбонатного и небикарбонатного буферных компонентов.
Концентрацию буферных оснований легче интерпретировать с помощью показателя избытка или недостатка буферных оснований (ВЕ, по международной номенклатуре Buffer Excess), который определяется разницей между актуальной и должной концентрацией буферных оснований.
В норме по определению ВЕ равен нулю. Учитывая биологическую
625
вариабильность, принято считать референтными значениями ВЕ: взрослые 0
2,5 ммоль/л, дети 0 3 ммоль/л.
При патологическом увеличении содержания буферных оснований ВЕ становится положительным, а при снижении – отрицательным. В последнем случае лучше использовать термин «дефицит оснований». Этот параметр имеет значительное клиническое и диагностическое значение. Он позволяет:
оценить степень метаболической компенсации дыхательных нарушений КОС;
оценить степень недыхательных нарушений КОС.
Легочная система регуляции КОС. Летучие кислоты экскретируются из организма только через легкие. Если в результате обменных нарушений кислотность крови увеличивается, то повышение содержания Н+ приводит к возрастанию легочной вентиляции (гипервентиляции); при этом молекулы СО2 выводятся в большем количестве и рН возвращается к нормальному уровню. Напротив, увеличение содержания оснований сопровождается гиповентиляцией; в результате напряжение СО2 и концентрация ионов Н+
возрастает; сдвиг реакции крови в щелочную сторону частично или полностью компенсируется.
Дыхательные нарушения КОС часто связаны с заболеваниями легких.
Первичная функция дыхательной системы – поддерживать оптимальный уровень напряжения кислорода (рО2) и углекислого газа (рСО2) в
артериальной крови. При альвеолярной гиповентиляции повышается альвеолярное и артериальное рСО2 и падает альвеолярное и артериальное
рО2. Оценку альвеолярной вентиляции проводят путем измерения артериального рСО2. Параметрами, характеризующими функцию дыхательной системы, являются не только рО2 и рСО2, но и насыщение гемоглобина кислородом (SO2), общее содержание кислорода в крови (ТО2),
фракция оксигемоглобина в общем гемоглобине (О2Hb).
Почечная система регуляции КОС и электролитов. Нелетучие
кислоты экскретируются только почками. Поставка в кровоток
626
дополнительных количеств ионов HCO3-, уравновешивающих образование ионов Н+ в организме, относится к основным фунциям почек. Как правило,
компенсаторные механизмы КОС связаны с включением противоположных механизмов. В случае метаболического ацидоза компенсация происходит через дыхательный алкалоз. При дыхательном ацидозе – через метаболический алкалоз.
Почки поддерживают КОС двумя механизмами: 1) реабсорбция отфильтрованного в клубочках HCO3- и 2) выведения Н+ с мочой.
Реабсорбция HCO3- происходит главным образом в проксимальных канальцах нефрона. Существует взаимосвязь между количеством реабсорбированного бикарбоната и ионами хлора. Так рост реабсорбции
HCO3- при дыхательном ацидозе или метаболическом алкалозе сопровождается снижением реабсорбции Cl- и ведет к гипохлоремии.
Поэтому определение концентрации Cl- в плазме и HCO3- в моче может предоставить дополнительную информацию о типе нарушения КОС. В
дистальных отделах нефрона происходит образование дополнительных количеств HCO3-. Этот процесс возможен благодаря активной секреции и выведению ионов Н+ с мочой. В просвете канальца акцептором Н+ является аммиак и фосфаты. Минимальное значение рН мочи может быть 4,6, что эквивалентно концентрации ионов Н+ 25 мкмоль/л. Так как за сутки обычно выделяется примерно 1,5 л мочи, следовательно, в свободном виде выделяется только примерно тысячная часть общего экскретируемого количества ионов Н+. Основным буфером мочи является фосфатный буфер.
Так в гломерулярном фильтрате 80 % фосфатов присутствует в форме двувалентного аниона (НРО4-2). При взаимодействии с секретируемым ионом Н+ он превращается в одновалентный фосфат Н2РО4- . При минимальном рН мочи практически все фосфаты находятся в форме Н2РО4-. За сутки примерно
30 - 40 ммоль ионов Н+ нормально экскретируется этим путем.
Желудочно-кишечная система и ее роль в поддержании постоянства КОС. В регуляции pH крови и тканей роль желудка
627

заключается в торможении секреции соляной кислоты при защелачивании и усилении этого процесса при закислении. Этим желудок сохраняет для внутренней среды организма щелочные или кислые элементы в зависимости от сдвига КОС. Печень также активно участвует в регуляции КОС. В ней осуществляется нейтрализация молочной кислоты, кетокислот кислот в основном путем их дезаминирования. При поступлении в организм избытка кислот в печени усиливается их нейтрализация и одновременно тормозится мочевинообразование. В результате этого неиспользованный аммиак нейтрализует кислоты и увеличивается выведение аммонийных солей с мочой. При защелачивании, наоборот, мочевинообразование увеличивается,
аммониогенез ослабевает. Поджелудочная железа активно участвует в регуляции pH крови. Она секретирует большое количество ионов гидробикарбоната, что является ее уникальной и исключительно важной физиологической функцией. Образование ионов гидрокарбоната тормозится при избытке кислот в межклеточной жидкости и усиливается при их недостатке.
Референтные показатели КОС, изменения КОС при патологических состояниях. Показатели крови при нормальном газообмене в покое при
дыхании воздухом представлены в табл. 5.40.
Таблица 5.40
Показатели крови при нормальной функции легких
Показатель |
Артериальная кровь |
Венозная кровь |
[Н+] |
36-43 нмоль/л |
35-45 нмоль/л |
рН |
7,35-7,45 |
7,35-7,45 |
рСО2 |
38-42 мм Нg |
36-50 мм Нg |
рО2 |
85-95 мм Нg |
30-50 мм Нg |
Отклонение рНа за диапазон между 7,35 и 7,45 единиц рассматривается как нарушение кислотно-основного состояния (КОС). Значения рН ниже 7,35
свидетельствуют об «ацидемии» (выражение для крови) или «ацидозе»
(выражение для ткани). Значения рН выше 7,45 указывают на развитие
628
«алкалемии» (выражение для крови) или «алкалозе» (выражение для ткани).
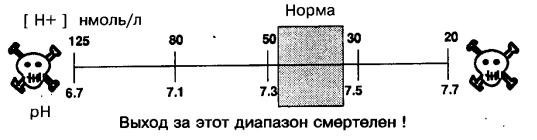
Диапазон возможных изменений рНа представлен на рис. 5.9.
Рис. 5.9. Диапазон изменения концентрации ионов водорода и рН артериальной крови у человека
СО2 образуется в процессе клеточного метаболизма и освобождается в кровь, в которой транспортируется до легких, где экскретируется из организма Парциальное давление углекислого газа в пробах крови – рСО2
отражает только одну из нескольких форм, в которых СО2 присутствует в крови. СО2 находится также в составе угольной кислоты (Н2СО3), иона бикарбоната (НСО3-), в комбинации с разными белками плазмы и в связанном виде с гемоглобином (карбогемоглобин). При нормальной вентиляции рСО2 артериальной крови находится в диапазоне 38-42 мм Hg
(5,06-5,60 кПа). Некоторые авторы за нормальный диапазон принимают
раСО2 35-45 мм Hg. Патологическими являются отклонения за пределы < 30 и > 50 мм Hg (< 4 и > 6,7 кПа). Изменение рСО2 первично отражает состояние дыхания, так как легкие контролируют уровень рСО2, изменяя частоту и глубину дыхания.
Показатели КОС на анализаторах. Современные анализаторы позволяют одновременно определять показатели газов крови, кислотно-
основного состояния, электролитов и метаболитов. На основании измеряемых покаателей проводится расчет параметров, отражающих метаболические и компенсаторные сдвиги. При анализе показателей КОС измеряемыми являются парциальное давление углекислого газа pCO2 и рН.
Расчетные показатели КОС:
629

HCOact |
– ион бикарбоната актуальный (истинный , реальный) |
HCOstd |
– ион бикарбоната стандартный |
BE |
– избыток буферных оснований внеклеточной жидкости |
BB |
– концентрация буферных оснований крови |
ctCO2 |
– содержание двуокиси углерода в плазме крови |
Клинико-диагностическое значение определяемых показателей КОС. Первичное развитие метаболического ацидоза происходит при увеличении образования или снижении экскреции ионов Н+ или их
комбинации. Непрямым механизмом нереспираторного ацидоза может быть потеря HCO3- из организма. Наиболее общие причины метаболического ацидоза представлены в таблице табл. 5.41.
Таблица 5.41
Причины метаболического ацидоза
Увеличение образования ионов Н+:
кетоацидоз (диабетический , алкогольный); лактоацидоз при гипоксии;
интоксикация этанолом, метанолом, этиленгликолем, салицилатами
Снижение экскреции Н+:
кетоацидоз (диабетический , алкогольный); лактоацидоз при гипоксии;
интоксикация этанолом, метанолом, этиленгликолем, салицилатами
Потеря HCO3-:
профузный понос кишечная фистула
Практически единой причиной дыхательного ацидоза и роста рСО2
является нарушение альвеолярной вентиляции. В результате увеличения
рСО2 растет образование Н2СО3 с последущей диссоциацией на Н+ и HCO3-. К
снижению альвеолярной вентиляции могут приводить множество причин,
основные из которых представлены в табл. 5.42.
Во всех случаях при дыхательном ацидозе повышается рСО2. В
организме практически на каждый образующийся ион Н+ формируется анион
HCO3-. Ионы Н+ связываются внутриклеточными буферными системами, в
частности, гемоглобиновым буфером. При остром повышении рСО2 на
630
