
Учебник
.pdfобразуются другие иммуноглобулины, развивается синдром возвратных инфекций.
При выявлении на электрофорезе сыворотки парапротеинов
обязательным является электрофоретическое исследование мочи (табл. 5.7).
Примерно в 20% случаев миеломной болезни опухоль продуцирует только легкие цепи иммуноглобулинов, которые из-за низкой молекулярной массы быстро фильтруются в почках и могут не обнаруживаться в сыворотке,
но будут присутствовать в моче. Для подтверждения диагноза в моче методом электрофореза определяют белок Бенс-Джонса, который располагается недалеко от старта соответственно М-градиенту в сыворотке,
между - и - глобулинами.
Таблица 5.7
Парапротеины при множественной миеломе
|
Встречае |
Белок Бенс- |
|
Белок |
мость, % |
Джонса в моче, |
Примечание |
|
|
% |
|
|
|
|
Пациенты устойчивы к иммунодефициту, |
IgG |
50 |
60 |
парапротеинемия бывает очень высокой |
IgА |
25 |
70 |
Тенденция к гиперкальциемии и |
|
|
|
амилоидозу |
|
|
|
Часты внекостные поражения, амилоидоз, |
IgD |
2 |
100 |
почечная недостаточность, в половине |
|
|
|
случаев увеличены лимфоузлы, селезенка, |
|
|
|
печень. Плохой прогноз. |
IgМ |
1 |
100 |
Часто увеличена вязкость крови |
Только |
|
|
Часто развивается почечная |
белок |
20 |
100 |
недостаточность, амилоидоз, повреждения |
Бенс- |
|
|
костей. Плохой прогноз |
Джонса |
|
|
|
С целью количественного определения классов иммуноглобулинов и парапротеина используется метод иммунодиффузии с антисыворотками и иммунофиксацией. Если парапротеины относятся к IgM, то более вероятно,
что это макроглобулинемия Вальденстрема, а не множественная миелома.
Электрофорез белков сыворотки крови. Электрофорез широко используется для полуколичественного определения белков сыворотки и для
выявления парапротеинов. Электрофорез проводится с сывороткой, а не с
481
плазмой, так как присутствие фибриногена в плазме приводит к образованию выраженной 2-полосы, что может быть расценено как парапропротеинемия.
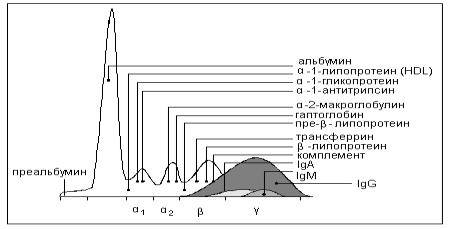
Электрофорез на ацетате целлюлозы или геле агарозы разделяет белки на фракции альбумина, 1-, 2-, - и -глобулины. Обычный состав фракций представлен на рисунке 5.1, количественный состав фракций – в табл. 5.8.
Рис. 5.1. Электрофоретическое разделение белков плазмы крови
Полоса преальбумина может проявиться в зависимости от использованного метода. -Фетопротеин при увеличении примерно в 100 раз
(рак печени) может проявиться отдельной полосой между альбумином и 1-
зоной. Выраженное повышение С-реактивного белка может дать резкую полосу в области -глобулинов. Парапротеины двигаются, как правило,
отдельной полосой. Электрофоретическая подвижность белков, особенно альбумина, может меняться, когда белки связывают лекарственные препараты, билирубин и другие лиганды. В частности, подвижность альбумина повышается при связывании пенициллина, салицилатов, большого количества билирубина или жирных кислот. Подвижность 1-антитрипсина уменьшается при связывании тиоловых групп или белка Бенс-Джонса.
Многие физиологически важные белки присутствуют в плазме в очень низких концентрациях. Значения фракций белков зависят от типа носителя
(бумага, ацетат целлюлозы, агарозный гель), применяемого красителя,
482

способа денситометрии, поэтому электрофореграмма дает только качественное представление о распределении белковых фракций.
Белок-теряющие нефропатии приводят в первую очередь к интенсивной потере относительно низкомолекулярных белков, в результате возникает гипоальбуминемия/гипопротеинемия. Однако концентрация альбумина должна снизиться примерно на 1/3 нормального уровня, чтобы это было отчетливо видно на электрофореграмме. Неселективная стимуляция белкового синтеза в печени при белок-теряющих нефропатиях сопровождается увеличением в сыворотке 2-макроглобулина и -
липопротеидов (компенсаторная гиперхолестеринемия). При прогрессировании поражения базальной мембраны клубочков почек белки с большей молекулярной массой, включая IgG и IgA, также теряются с мочой,
приводя к гипогаммаглобулинемии и неселективной протеинурии с потерей всех основных сывороточных белков. При дефектах иммунной системы со снижением IgG, основного компонента -глобулинов, может уменьшиться интенсивность полосы -глобулинов.
Таблица 5.8
Белки плазмы крови, влияющие на размер электрофоретического
разделения на классы
Электрофоретическое распределение белков
|
% при |
|
Молеку- |
Концентра |
Класс |
разделе-нии |
Основные белки |
лярная |
ция в |
|
на ацетате |
фракции |
масса |
сыворотке, |
|
целлюлозы |
|
|
г/л |
|
|
преальбумин |
54000 |
0,25 |
альбумин |
48-61 % |
альбумин |
66000 |
44 |
1-глобулин |
2,5-5 % |
1-антитрипсин |
55000 |
2,9 |
|
|
1-кислый |
40000 |
1,0 |
|
|
гликопротеин |
|
|
2-глобулин |
8-11 % |
гаптоглобин |
85000 |
2,0 |
|
|
2-макроглобулин |
800000 |
2,6 |
|
|
церулоплазмин |
16000 |
0,35 |
-глобулин |
11-15 % |
трансферрин |
77000 |
3,0 |
|
|
-липопротеиды |
300000 |
1,0 |
|
|
483 |
|
|
|
|
С3 комплемент |
340000 |
1,0 |
-глобулины |
16-25 % |
IgG |
160000 |
14,0 |
|
|
IgA |
170000 |
3,5 |
|
|
IgM |
900000 |
1,5 |
Основные типы протеинограмм.
Острофазный ответ – повышение α1- и α2-глобулинов в связи с усилением биосинтеза в печени белков острой фазы при воспалении любой этиологии (травма, хирургическое вмешательство, острый инфаркт миокарда,
инфекция и др.).
Хроническое воспаление – увеличение γ-глобулинов (хронические гепатиты разной этиологии, ревматоидный артрит, некоторые хронические инфекции).
Цирроз печени – увеличение γ-глобулинов, слияние β- и γ-глобулинов вследствие мезенхимально-воспалительного синдрома, при развитии гепатодепрессивного синдрома возможно снижение альбумина.
Нефротический синдром – повышение α2-глобулинов в связи с усилением синтеза и повышением сывороточного уровня α2-макроглобулина,
возможно снижение альбумина из-за его массивной потери с мочой.
Моноклональная гаммапатия – появление на электрофореграмме отдельной дискретной полосы в области глобулярных фракций
(моноклональный белок, М-градиент, М-белок), состоящей из иммуноглобулинов или их фрагментов, синтезирующихся злокачественно трансформированными клонами В-лимфоцитов. Концентрации М-белка более 15 г/л с высокой вероятностью свидетельствует о миеломной болезни.
При болезни лёгких цепей М-белок при электрофорезе сыворотки может не определяться, поскольку лёгкие цепи иммуноглобулинов (белок Бенс-
Джонса) проходят через почечный фильтр и выводятся с мочой. Появление М-белка может наблюдаться при хронических гепатитах, циррозе печени, а
также у некоторых пациентов престарелого возраста без клинических патологий, ассоциированных с моноклональной гаммапатией. Имитировать
484
М-белок могут высокие концентрации C-реактивного белка и некоторых других острофазных белков, а также фибриноген. При выявлении М-белка необходима его последующая иммунохимическая идентификация методом электрофореза с иммунофиксацией.
5.1.5. Специфические белки плазмы крови. Клиническое значение их
определения Белки острой фазы воспаления. В ответ на любое повреждение при
физической травме, ожогах, хирургических операциях, инфекциях в организме развивается комплекс воспалительных реакций, направленных на локализацию очага повреждения и скорейшее восстановление нарушенных функций. Местные и системные изменения, возникающие непосредственно вслед за повреждением, в совокупности составляет понятие острой фазы воспаления. Развитие острой фазы воспалительного ответа инициируется и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины,
факторы роста и глюкокортикоиды. Некоторые из них выделяются непосредственно в очаге воспаления активированными макрофагами,
лимфоцитами, фибробластами и другими клетками и могут оказать как местное, так и общее воздействие. Цитокины обеспечивают своего рода коммуникационную сеть. Регуляция синтеза белков острой фазы не является универсальной. Это сложный многофакторный механизм, отдельный для каждого белка. В общих чертах можно представить, что цитокины действуют как первичные стимуляторы генной экспрессии, глюкокортикоиды и факторы роста являются модуляторами действия цитокинов.
Как правило, концентрация белков острой фазы меняется в течение первых 24-48 часов. Классически острая фаза длится несколько дней, что указывает на защитное значение этого важного ответа. Однако цикл может быть пролонгирован при продолжении действия повреждающих факторов или при нарушении механизмов контроля и регуляции.
485
Особенностью большинства белков острой фазы является их неспецифичность и высокая корреляция концентраций в крови с активностью заболевания, стадией процесса. Это выгодно отличает белки острой фазы от таких показателей как СОЭ, подсчет количества лейкоцитов и сдвиг лейкоцитарной формулы. В связи с этим наиболее эффективно использовать тесты на белки острой фазы для мониторинга течения заболеваний, контроля лечения. В то же время диагностическая значимость этих тестов в силу их неспецифичности может быть весьма ограниченной.
Изменение концентрации разных белков в условиях повреждения и воспаления варьирует в широких пределах. Удобна для практического использования классификация белков острой фазы в зависимости от степени увеличения их концентрации при физической травме (табл. 5.9).
|
|
Таблица 5.9 |
Классификация белков острой фазы по степени увеличения их |
||
|
концентрации |
|
|
|
|
|
Белки острой фазы |
|
Группа |
Белок |
Концентрация в сыво- |
|
|
ротке в норме (г/л) |
«Главные» реактанты, |
С-реактивный белок (СРБ) |
0,005 |
увеличение в 20-1000 раз в |
Амилоидный белок А |
|
течение 6-12 ч |
сыворотки (SAA) |
0,001-0,03 |
|
1-Антитрипсин |
1,4-3,2 |
Умеренное увеличение |
1-Антихимотрипсин |
0,3-0,6 |
концентрации (в 2-5 раз) в |
1-Кислый гликопротеин |
0,4-1,3 |
течение 24ч |
Гаптоглобин |
0,5-3,2 |
|
Фибриноген |
1,8-3,5 |
Незначительное увеличение |
C3-компонент комплемента |
0,5-0,9 |
концентрации (на 20-60%) в |
C4-компонент комплемента |
0,1-0,4 |
течение 48 ч |
Церулоплазмин |
0,2-0,5 |
К «главным» белкам острой фазы у человека относят С-реактивный белок (СРБ) и амилоидный А белок сыворотки крови. Уровень их возрастает при повреждении очень быстро (в первые 6-8 ч) и значительно ( в 20-100 раз,
в отдельных случаях в 1000 раз).
Вторую группу составляют белки, концентрация которых может увеличиваться существенно (в 2-5 раз). К острофазным относятся белки с
486
разной биологической функцией, однако все они выполняют важную роль в месте повреждения или на уровне организма и непосредственно участвуют в реакциях, направленных на удаление повреждающего фактора, локализацию очага повреждения, восстановления нарушенной структуры.
При острых воспалительных заболеваниях, сепсисе самым чувствительным и самым быстрым маркером повреждения является С-реактивный белок. Для определения и наблюдения за течением хронических процессов желательно следить за изменением концентрации сразу нескольких более медленно реагирующих белков – 1-кислого гликопротеина (орозомукоида), 1-антитрипсина. Использование только одного из маркеров воспаления рискованно, так как у разных больных возможен дисгармоничный острофазный ответ. В частности, для белков,
обладающих антипротеазной активностью ( 1-антитрипсин, 1-
антихимотрипсин, 2-макроглобулин), характерно в начальной стадии острого воспаления снижение уровней из-за потребления, вслед за этим происходит повышение концентраций, связанное с увеличением синтеза этих белков. Снижение уровней ингибиторов протеиназ при септическом шоке или остром панкреатите является плохим прогностическим признаком.
Повышенное потребление гаптоглобина, C3-компонента комплемента,
фибриногена может указать на наличие сопутствующего патологического процесса помимо воспаления.
С-Реактивный белок. С-Реактивный белок (СРБ) – компонент иммунного ответа. Может связывать не только полисахариды,
присутствующие на поверхности бактерий, грибов и паразитов, но и полианионы, поликатионы, нуклеиновые кислоты. Присоединенный к мембранам микроорганизмов и поврежденным клеткам, СРБ активирует каскад комплемента, способствует фагоцитозу. Важной функцией является распознавание потенциально токсических веществ, образующихся при
487

распаде собственных клеток организма, связывание их, детоксикация и удалении из крови.
Уровень СРБ повышается в течение 6-10 ч после заболевания, травмы,
хирургического вмешательства. Применяется для оценки активности
воспалительных процессов, наблюдения за их динамикой,
дифференциальной диагностики бактериальных и вирусных инфекций,
выбора адекватного лечения и контроля его эффективности. После травмы или операции при отсутствии осложнений концентрация СРБ возвращается к норме в следующие 5-7 сут. Плохой прогноз, если СРБ 200 мг/л более 10
сут или через 7-10 сут происходит только незначительное снижение СРБ.
Персистенция СРБ указывает на сохраняющийся в организме воспалительный процесс, неадекватное лечение (табл. 5.10).
Таблица 5.10
Оценка активности воспалительных процессов по уровню
C-реактивного белка
СРБ – 10-50 мг/л |
СРБ 50 мг/л |
Местные бактериальные инфекции; |
Тяжёлые бактериальные, в т.ч. |
Инфаркт миокарда (максимум после 2-х сут); |
послеоперационные инфекции (сепсис, |
Вирусные инфекции; |
пневмония, пиелонефрит); |
Хронические инфекции (туберкулёз, |
Активный ревматоидный артрит, крайне |
сифилис); |
активный серонегативный |
Саркоидоз; |
спондилоартрит; |
Ревматоидный артрит; |
Системные васкулиты; |
Псориатический артрит, подагра; |
Активная болезнь Крона; |
Заболевания соединительной ткани, такие |
Тромбоз глубоких вен; |
как СКВ, дерматомиозит; |
Острый панкреатит; |
Язвенный колит; |
Метастазирующие некротизирующие |
Внутриутробная инфекция. |
опухоли. |
Высокочувствительный С-реактивный белок (hs-СРБ) – концентрация СРБ, которая стабильно выявляется у практически здоровых лиц или у пациентов при отсутствии острого воспалительного процесса или вне обострения заболевания. Уровень hsСРБ 3-10мг/л – признак вялотекущего воспалительного процесса в интиме сосудистой стенки, связан с высоким риском сердечнососудистых заболеваний и их осложнений (инфаркта
488

миокарда, мозгового инсульта), а также риском внезапной сердечной смерти у лиц, не страдающих сердечнососудистыми заболеваниями. Применяется для выделения пациентов, нуждающихся в профилактическом лечении, для оценки эффективности профилактики сердечнососудистых заболеваний и их осложнений. При отказе от курения, регулярной физической нагрузке, при лечении ожирения уровень hsСРБ снижается. У больных нестабильной стенокардией и острым инфарктом миокарда риск летальности: hsСРБ <1
мг/л – низкий; hsСРБ 1-3 мг/л – средний; hsСРБ >3 мг/л – высокий.
Белки системы комплемента. В состав комплемента входит большая группа глобулинов сыворотки крови. Белки комплемента синтезируются в печени, присутствуют в плазме в неактивной форме. Активация комплемента способна привести к необратимому нарушению структуры и функции биологических мембран и лизису клетки. Общая направленность действия системы комплемента состоит в том, что она вместе с антителами и специализированными клетками участвует в защите организма от инфекций.
Активация комплемента происходит классическим или альтернативным путем (рис. 5.2).
Рис. 5.2. Схема активации комплемента
Классический пути активации инициируется иммунным комплексом,
содержащим антитела IgG, IgM или С-реактивный белок (СРБ). После адгезии иммуноглобулинов на мембране чужеродной клетки образуется комплекс с фрагментами С1-компонента комплемента. Затем через этап активации формируется атакующая группа комплемента, которая способна
489
внедряться в гидрофобную часть мембраны бактерии и лизировать чужеродные клетки.
Альтернативный путь активации комплемента является быстрым,
неспецифичным, не связанным с антителами. Альтернативный путь индуцируется действием системы пропердина. Пропердин активируется рядом соединений, в частности эндотоксином (бактериальным полисахаридом) и действует сразу на С3-компонент комплемента, минуя этап взаимодействия с иммуноглобулинами. При определении индивидуальных белков иммунохимическим методом определяют содержание С3- и С4-
компоненты комплемента, в наибольших концентрациях присутствующих в
плазме крови.
Генетически обусловленные состояния дефицита компонентов
комплемента представлены в табл. 5.11.
|
Таблица 5.11 |
Генетически обусловленные состояния дефицита компонентов |
|
|
комплемента |
|
|
Дефицит компонента |
Клинические проявления |
|
Обычно не вызывает клинически выраженных расстройств, |
Дефицит С1 |
т.к. есть возможность замещения по альтернативному пути |
|
активации; тенденция к развитию системных коллагенозов. |
Дефицит С2 |
Протекает часто с развитием ювенильного ревматизма, |
|
системной красной волчанки, бронхиальной астмы и экземы |
Дефицит С3 |
Аутоиммунные заболевания со значительным |
|
полиморфизмом, часто сопровождающиеся |
|
гломерулонефритом и системной красной волчанкой; |
|
возвратные инфекции |
Дефицит С4 |
Увеличение частоты болезней иммунных комплексов: |
|
системная красная волчанка, болезнь Шенляйн-Геноха, |
|
полимиозит, гломерулонефрит |
Дефицит С5 |
Отсутствует агрегация тромбоцитов; возвратные инфекции |
Дефицит С6 |
Кровоточивость |
Дефицит С7-С9 |
Возвратные инфекции, персистируют бактериальные |
|
инфекции |
Дефицит С1-ингибитора |
Врожденный ангионевротический отек |
Вторичные изменения уровня компонентов комплемента могут быть
как в сторону увеличения, так и снижения. Увеличение происходит в
490
