
Учебник
.pdfреакциях острой фазы, снижение – при болезнях иммунных комплексов.
Уровень С3 и С4 отражает баланс между этими состояниями – потребление в иммунных комплексах и синтез в острой фазе. Причины, вызывающие изменение концентрации С3 и/или С4 в сыворотке крови, представлены в табл. 5.12. Уровень С3 и С4 в сыворотке может быстро падать в результате ожогов или потери белка (энтеропатия).
Таблица 5.12
Причины, вызывающие изменение уровней С3 и /или С4 в сыворотке
С3 |
С4 |
Механизм |
Заболевания |
|
|
Острофазная |
Острое воспаление, травмы, инфекции и т.д. |
|
|
реакция |
|
|
|
Активация |
ДВС-синдром, мембранопролиферативный |
|
|
альтернативног |
гломерулонефрит, инфицирование грам-отрица- |
|
норма |
о пути |
тельными бактериями, укус змеи, криптококкоз, |
|
|
|
паразитарные инвазии, аллергические |
|
|
|
грануломатозные ангииты, инфицирование грибами. |
|
|
Активация |
Шок при грам-отрицательном сепсисе, равматоидный |
|
|
протеолизиса |
артрит, повреждение тканей, гепатит В, артефакты, |
|
|
|
привнесенные in vitro |
|
|
Активация |
Бактериальный эндокардит, острый |
|
|
классического |
постстрептококковый гломерулонефрит, болезнь |
|
|
пути |
иммунных комплексов, серповидноклеточная анемия, |
|
|
|
тяжелые хронические заболевания печени |
|
|
Активация |
Обострение системной красной волчанки, болезнь |
|
|
обоих путей |
иммунных комплексов, гломерулонефрит |
|
|
|
|
|
|
|
Смешаная криоглобулинемия, малярия vivax, |
норма |
|
|
врожденный ангионевротический отек, |
|
|
|
анафилактоидная пурпура, аллергические |
|
|
|
гранулематозные ангииты |
При классическом пути активации С4 часто снижается более выражено, чем С3. Наследственная недостаточность С4 обычно связана с системной красной волчанкой. При наследственном ангионевротическом отеке С4 снижен, а С3 остается в пределах нормы, но основное значение имеет недостаток С1-ингибитора.
С1-ингибитор эстераз – 2-глобулин, белок острой фазы, тормозит активность компонентов комплемента С1 и С3, плазминогена, калликреина,
491
ХII фактора свертывания крови. Его содержание в сыворотке в норме 150-
350 мг/л. Дефицит этого белка вызывает ангионевротический отек (отек Квинке). Врожденный ангионевротический отек наследуется как аутосомное доминантное заболевание. Болезнь сопровождается приступообразным отеком бронхов, слизистой желудочно-кишечного тракта или подкожной клетчатки.
Транспортные белки. Трансферрин – металлсвязывающий транспортный белок плазмы крови, основной переносчик железа к клеткам.
Связывание с трансферрином предупреждает токсический эффект железа.
Каждая молекула трансферрина может связать максимум два иона Fe3+, что эквивалентно 1,4 мг железа на 1 г трансферрина. В качестве сопутствующего аниона обычно связывается бикарбонат. Определение трансферрина используется для выявления функционального (скрытого) дефицита железа и перегрузки организма железом, дифференциальной диагностики анемий,
мониторинга лечения железодефицитной анемии. У пациентов с уремией и находящихся на гемодиализе трансферрин не пригоден для определения недостатка железа.
Референтные значения концентрации в сыворотке: новорожденные до
7 дней – 1,3-3,6 г/л; Дети с 1 года и взрослые 2,0-3,6 г/л.
Увеличение содержания: железодефицитная анемия.
Снижение содержания: реакция острой фазы (снижается в первые
17-48 ч), неэффективный эритропоэз (талассемия, мегалобластные анемии),
гемохроматоз, анемия при хронических инфекциях, опухоли.
Ферритин – растворимый в воде комплекс железа с белком апоферритином. Белок, обеспечивающий депонирование железа. Ферритин содержит примерно 15-20% от общего количества железа в организме взрослого человека. Каждая клетка тела и все жидкости организма содержат ферритин. Циркулирующий в кровотоке ферритин практически не содержит железа, но его количество находится в равновесии с резервным депо железа.
Хотя в крови ферритин присутствует в небольших количествах, его
492
концентрация в плазме отражает запасы железа в организме. Снижение уровня ферритина – это первый показатель уменьшения запасов железа.
Концентрация ферритина в сыворотке крови прямо коррелирует с количеством депонированного железа в организме, её измерение используется для диагностики и мониторинга дефицита или избытка железа,
дифференциальной диагностики анемий, слежения за развитием опухолей. В
отличие от железа, уровень ферритина не имеет суточного ритма, его концентрация не зависит от эстрогенов и синтеза в печени, однако,
концентрация ферритина повышается в острой фазе воспаления. Особое значение имеет контроль лечения железом, так как перегрузка клеток железом приводит к их повреждению.
Референтные значения: в сыворотке (плазме) крови. 6 мес-15 лет – 15120 мкг/л; мужчины – 30-300 мкг/л; женщины до 50 лет – 10-160 мкг/л,
старше 50 лет – как у мужчин.
Увеличение содержания: гипохромная анемия с нормальным или увеличенным депо железа; повышение запасов железа в тканях, анемия вследствие инфекции или злокачественного новообразования
(лимфогранулематоз, острый лейкоз); талассемия, сидеробластная анемия;
избыток железа при гемохроматозе, неэффективный эритропоэз,
гемотрансфузии, пероральное и парентеральное лечение препаратами железа,
реакция острой фазы (воспаление, инфекции, злокачественные опухоли);
Снижение содержания (при дефиците железа): острая и хроническая (в
частности меноррагии) кровопотеря, железодефицитная и гемолитическая анемия, воспалительные заболевания кишечника с нарушением всасывания железа, гемодиализ.
Для диагностики латентного недостатка железа, помимо ферритина,
следует определить уровни трансферрина, железа и сделать гемограмму.
Церулоплазмин – белок плазмы крови, чья молекула содержит 6 или
7 ионов меди. Церулоплазмин транспортирует медь, связывая 90-95% меди плазмы крови. Участвует в обмене (окисляя Fe2+ до Fе3+), транспорте и
493
утилизации железа. Играет важную роль в регулировании окислительно-
восстановительного потенциала. Обладает антиоксидантной активностью:
предупреждает окисление липидов в мембране клеток, способствует увеличению синтеза оксида азота эндотелием сосудов, тем самым контролирует NO-зависимую вазодилатацию. Церулоплазмин способен инактивировать свободные радикалы кислорода, предотвращая окисление полиненасыщенных жирных кислот, усиливает окисление аскорбиновой кислоты, катехоламинов, серотонина и соединений, содержащих сульфгидрильные группы, в частности гомоцистеина и цистеина.
Референтные значения в плазме (сыворотке) крови 0,2-0,6 г/л.
Увеличение содержания: острая фаза воспаления, первичный биллиарный цирроз, лейкемия, хронический алкоголизм.
Снижение содержания: болезнь Вильсона–Коновалова (гепато-
церебральная дистрофия), дефицит белка при нефротическом синдроме,
гастроэнтеропатия с потерей белка, синдром мальабсорбции.
Глобулин, связывающий половые гормоны.
Глобулин, связывающий половые гормоны (ГСПГ) участвует в связывании и транспорте половых гормонов (связывает тестостерон и 5-
дигидротестостерон с высоким сродством, эстрадиол несколько слабее).
Защищает тестостерон и эстрадиол от метаболической инактивации во время их транспорта от места секреции к органу-мишени. Уровень синтеза ГСПГ в печени зависит от половых гормонов: эстрогены увеличивают, а андрогены снижают его продукцию. Сниженние уровня ГСПГ бывает при гирсутизме,
угрях обыкновенных и синдроме поликистозных яичников. Уровень ГСПГ на поздних стадиях беременности или после введения эстрогенов увеличен.
После 60 лет содержание ГСПГ возрастает примерно на 1,2% в год.
Референтные значения в сыворотке крови у пациентов в возрасте старше 14 лет: женщины (до 50 лет) — 20–120 нмоль/л; мужчины — 13– 71 нмоль/л.
Увеличение содержания:
494
гиперэстрогенемия, гипертиреоидное состояние;
цирроз печени;
хронический простатит, нарушение потенции.
Снижение содержания:
гиперандрогенизм, гипотиреоз, гирсутизм, гиперпролактинемия;
ожирение;
синдром поликистозных яичников, аменорея, ановуляция;
акромегалия, синдром Кушинга;
Иммуноглобулины. Иммуноглобулины сыворотки человека – это группа -глобулинов с идентичной базовой структурой, но отличающаяся по иммунологическим, биологическим и физическим свойствам. Синтезируются и секретируются лимфоцитами В-линии. При антигенной стимуляции В-
лимфоциты продуцируют в основном IgМ. При пролиферации В-лимфоциты превращаются в плазматические клетки, которые секретируют в кровь высокоспецифичные антитела класса IgG, способные связывать дополнительное количество антигенов.
Иммуноглобулины представляют собой гликопротеины с молекулярной массой от 150000 до 1000000 Да. В простейшем случае они состоят из 4 цепей: 2 одинаковых тяжелых цепей (Н, мол. масса 50000) и 2
одинаковых легких цепей (L, мол. масса 25000). Каждая цепь в свою очередь состоит из доменов (мол. масса 12500), соединенных дисульфидными мостиками (рис.5.3).
Все 4 цепи образуют симметричную Y-образную структуру. N-
концевые участки Н- и L-цепей представляют собой антиген-связывающие фрагменты (Fab). Посредством гибкого участка - «шарнира» - они соединены с фрагментом Fc. Последний не участвует в связывании антигенов, но может реагировать с макрофагами, лимфоцитами и компонентами комплемента. В
зависимости от структуры и функции иммуноглобулины относятся к одному из пяти классов: IgA, IgG, IgM, IgD и IgE.
495
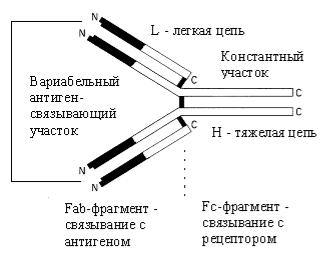
Рис. 5.3. Базовая структура молекулы иммуноглобулина. Молекула иммуноглобулина состоит из 2 тяжелых (Н) и 2 легких (L) цепей, связанных дисульфидными мостиками. Молекула бифункциональна: Fab-фрагмент изменчив, он отвечает за связывание с антигеном; Fc-фрагмент определяет эффекторную функцию
Гипогаммаглобулинемия может быть физиологической или свидетельствовать о патологическом процессе в организме.
Физиологическая гипогаммаглобулинемия имеет место у новорожденных. Контакт новорожденных с антигенами стимулирует В-
лимфоциты, которые начинают активно продуцировать IgM. После трансформации в плазматические клетки начинается синтез и секреция IgG и IgA. Этот процесс происходит с одновременным снижением материнских
IgG, поэтому у детей уровень IgG минимален в возрасте 3 месяцев. Особенно сильно подвержены инфекциям недоношенные дети, так как у них меньше,
чем у доношенных материнских IgG.
Патологическая гипогаммаглобулинемия как у детей, так и взрослых может быть как врожденной, так и приобретенной. Общим клиническим признаком для назначения лабораторного определения иммуноглобулинов в сыворотке у пациентов, особенно у детей, являются рецидивирующие инфекции. Инфекционные заболевания могут быть связаны с нарушением синтеза одного или нескольких иммуноглобулинов. Наиболее часто возникают острые респираторные заболевания. При врожденной
496
недостаточности заболевания возникают с самого раннего возраста, при приобретенной гипогаммаглобулинемии склонность к инфекциям не зависит от возраста.
Врожденные дефекты иммунной системы достаточно редки. Они могут затрагивать В и/или Т клетки, фагоциты или систему комплемента. Из них примерно 50-75 % приходится на нарушения образования иммуноглобулинов, 5-10 % на клеточные иммунодефициты, 10-25 % на комбинированные иммунодефициты и около 1-2 % на нарушения фагоцитоза и системы комплемента. Неверно ставить диагноз иммунодефицита только на основании определения уменьшения в сыворотке содержания IgG, IgA IgM, необходимо провести сопоставление лабораторных и клинических данных, включая анализ частых, особенно инфекционных заболеваний. В то же время ранняя постановка диагноза необходима для лечения больных с
иммунодефицитами, особенно детей.
Приобретенные иммуннодефициты. Больных с приобретенными дефицитами иммунной системы значительно больше, чем с врожденными.
При злокачественных лимфомах, болезни Ходжкина, хроническом лимфолейкозе, плазмацитоме и злокачественных опухолях нарушается гуморальный и клеточный иммунитет. Концентрация иммуноглобулинов в сыворотке может быть снижена в разной мере, а иногда увеличена. Лечение
цитостатиками, стероидными гормонами, глюкокортикоидами,
рентгеновское облучение, ионизирующая радиация влияют на образование иммуноглобулинов. Иммуносупрессоры могут уменьшать уровень иммуноглобулинов сыворотки.
Нарушения иммунитета с уменьшением иммуноглобулинов в сыворотке могут возникнуть после массивных потерь белка, в частности, при обширных ожогах, заболеваниях почек, белок-теряющих энтеропатиях.
Тяжелые травмы, серьезные оперативные вмешательства, массивные
трансфузии, |
недоедание, |
угнетения |
иммунореактивной |
ткани |
|
|
497 |
|
|
токсикоинфекционным воздействием, злокачественные поражения лимфоплазмацитарной системы могут привести к иммунодефицитам.
Среди приобретенных иммунодефицитов особое место занимает СПИД. Агаммаглобулинемия возникает только у детей и схожа с некоторыми формами врожденного иммунодефицита. У взрослых при СПИД, как правило, имеет место гипергаммаглобулинемия с различными нарушениями иммунной системы.
Гипергаммаглобулинемия возможна при повышенном синтезе антител,
как при острых, так и хронических инфекционных заболеваниях. Нарастают все классы Ig, но преобладают IgG. Иммуноглобулины увеличиваются при бактериальных инфекциях, сепсисе, хронических инфекциях, паразитарных заболеваниях. Предпочтительное повышение IgG имеет место при аутоиммуных заболеваниях, IgА – при инфекционных поражениях кожи,
желудка, дыхательных путей, почек, IgМ – при первичной вирусной инфекции и паразитарных инфекциях с накоплением паразита в крови
(малярия). Изменение общих Ig, также как IgM не имеет четкого диагностического значения, однако специфические Ig, направленные против специфических антигенов, имеют важное диагностическое значение.
Апобелки липопротеидов. АпоА и апоВ-белки. Каждый липопротеин
(ЛП) содержит белковые компоненты – аполипопротеины. Существует два класса апо-ЛП в зависимости от их роли в организации первичных частиц ЛП и их последующих превращениях. К одному относят апо-белки, которые формируют мицеллярную структуру ЛП комплексов. В эту группу входят апоВ (апоВ-100 и апоВ-48) и апоА (А-I и А-II), ответственные за осуществление афферентного и эфферентного транспорта липидов. К
другому классу относятся апо-белки, основной ролью которых является регуляция метаболизма ЛП и липидов в сосудистом русле и процесса интернализации их клетками. Эти апо-протеины содержатся в ЛП в значительно меньших количествах и в процессе взаимопревращения ЛП
498
частиц в кровеносном русле перемещаются между ЛП разных классов в виде белок-липидных комплексов.
Все липопротеиды, несущие липиды к периферическим тканям, имеют в своей структуре АпоВ-белок. Рецепторы к АпоВ-белку имеются практически во всех клетках тканей, за исключением клеток нервной системы и эритроцитов. Транспорт холестерина из клеток периферических тканей в печень (обратный транспорт холестерина) осуществляется ЛПВП.
Основными белковыми компонентами ЛПВП является АпоА-1 (65%) и
АпоА-II (30%). Физиологическая функция АпоА-1 – активация фермента лецитинхолестеринацилтрансферазы (ЛХАТ) и удаление свободного холестерина из клеток периферических тканей. АпоА-II – структурный белок ЛПВП, который может активировать липазу гепатоцитов и ингибировать ЛХАТ.
Определение в крови АпоА и АпоВ имеет значение для выявления риска атеросклероза коронарных артерий в популяции, а отношение АпоВ/АпоА-1 превосходит прогностическое значение отдельных АпоЛП.
Рекомендуемое значение АпоВ/АпоА1 – менее 1,1. Чем больше в сыворотке АпоА1 и меньше АпоВ, тем ниже вероятность развития сердечно-сосудистой патологии. В таблице 5.13 представлены референтные значения уровня аполипопротеинов, установленные для здоровых взрослых лиц иммунотурбидиметрическим методом, и рекомендуемые значения этих показателей.
|
|
Таблица 5.13 |
|
Значения аполипопротеинов в сыворотке взрослых людей |
|||
|
|
|
|
Показатель |
Референтные значения |
Рекомендуемые величины |
|
Апо А-1 |
муж. 1,04 - 2,02 г/л |
|
|
|
жен. 1,08 - 2,25 г/л |
> 1,15 г/л |
|
Апо В |
муж. 0,66 - 1,33 г/л |
|
|
|
жен. 0,60 - 1,17 г/л |
< 1,00 г/л |
|
Апо А-1/Апо В |
|
< 1,1 |
|
499
Липопротеин(a). Липопротеин (а) (Апо(а)) – обогащенная холестерином
(ХС) и белком частица, содержит молекулу апо(а) в дополнение к молекуле апо В. Особый интерес представляет выявление сходства в аминокислотной последовательности апо(а) и плазминогена. Апо(а), тем не менее, не обладая ферментативной активностью сериновой протеазы, не способен превращаться в активный плазминоподобный фермент. Увеличение концентрации ЛП(а) в крови считают независимым фактором риска атеросклероза и инфаркта миокарда. Концентрация ЛП(а) выше 300 мг/л
связана с 2-х кратным повышением риска ИБС, если же одновременно повышена концентрация ЛПНП, то риск ИБС повышается до 5 раз.
Атерогенность ЛП(а) обусловлена высокой способностью ЛП(а)
взаимодействовать с белками клеточного матрикса, такими как фибронектин и протеогликаны. Образующиеся комплексы активно поглощаются моноцитами, макрофагами и гладкомышечными клетками, в результате клетки трансформируются в пенистые. Скевенджер-рецепторы на макрофагах и моноцитах имеют высокое сродство к ЛП(а), что объясняет интенсивный захват этими клетками ЛП(а) и облегчает развитие атеросклероза. ЛП(а) блокирует рецептор плазминогена и тем самым может ингибировать фибринолиз, повышая риск развития тромбоза и атеросклероза.
5.1.6. Клиническое значение определения маркерных белков
Клиническое значение определения индивидуальных белков плазмы крови связано с тем, что большое количество заболеваний, как врожденных,
так и приобретенных, сопровождается изменениями в белках плазмы. Анализ количественных и качественных изменений белков плазмы используют для диагностики, мониторинга и прогноза заболеваний. Примеры качественных изменений белков для диагностики: обнаружение в плазме крови тропонина и миоглобина при остром инфаркте миокарда, натрийуретического пептида для диагностики сердечной недостаточности, терминальных петидов
500
