
Учебник
.pdfхарактеризующий основные виды субстратов, участвующих в данном типе химических превращений. Например, у трансфераз вторая цифра указывает на природу той группы, которая подвергается переносу. Эти подклассы в свою очередь делятся на более частные подгруппы (обозначаемые подподклассами), отличающиеся химической природой соединений (доноров или акцепторов). Цифра подподкласса ставится на третьем месте в шифре фермента. У гидролаз эта цифра уточняет тип гидролизуемой связи, а у лиаз -
тип отщепляемой группы. Первые три цифры кода точно определяют тип фермента. Все ферменты, относящиеся к данному подподклассу, получают порядковый номер в алфавитном порядке, который ставится на четвертом месте в шифре. Использование данной классификации является обязательным требованием в тех случаях, когда необходима точная идентификация фермента, в частности в инструкциях к наборам реактивов,
разного рода указателях, публикациях в научных журналах. Однако многие систематические названия громоздки, поэтому удобнее пользоваться тривиальными названиями. В табл. 5.15 приведены два примера соответствующих обозначений ферментов.
Таблица 5.15
Примеры обозначений ферментов по международной классификации и
при тривиальном названии
Шифр |
Систематическое название |
Тривиальное название |
Обозначение, |
фермента |
|
|
используемое в |
|
|
|
КДЛ |
2.6.1.2. |
L-аланин:2-оксоглутарат- |
Аланинаминотрансфераза |
АЛТ или АлАТ |
|
аминотрансфераза |
|
|
2.7.1.1. |
АТФ: D-гексоза-6- |
Гексокиназа |
ГК |
|
фосфотрансфераза |
|
|
Органные особенности биосинтеза и локализации ферментов. В
клетках человека содержится 10-40 тысяч различных белков, многие из которых обладают каталитической активностью. Большинство ферментов,
представляющих интерес с точки зрения энзимодиагностики заболеваний,
обладают молекулярной массой 90000 Да и выше, и не способны проникать
511
через интактные мембраны клеток. Активность большинства ферментов в клетках в норме значительно превышают их активность во внеклеточной жидкости. Уровень ферментативной активности в кровяном русле после повреждения ткани определяется в первую очередь содержанием фермента в этой ткани, а также стадией патологического процесса. Имеются ферменты,
которые присутствуют только в определенной ткани или одной из тканей в высокой концентрации. При повреждении этой ткани в крови появляются органоспецифичные ферменты (таблица 5.16).
Таблица 5.16
Специфичность ферментов для диагностики патологических процессов
|
|
|
Фермент |
Орган |
Диагностическое значение |
амилаза |
Поджелудочная железа, |
Острый панкреатит |
|
слюнные железы |
|
АЛТ |
Печень |
Заболевания паренхимы печени |
АСТ |
Миокард, печень |
Инфаркт миокарда, заболевания паренхимы |
|
|
печени, поражения скелетных мышц |
ЩФ |
Печень, костная ткань, |
Метаболические заболевания костной ткани, |
|
кишечник, почки |
гепатобилиарная патология |
КК |
Скелетные мышцы, сердце, |
Инфаркт миокарда, поражения мышечной |
|
гладкие мышцы |
ткани |
Холинэсте |
Печень |
Отравления фосфорорганическими |
раза |
|
соединениями, заболевания паренхимы |
|
|
печени |
ГГТ |
Печень |
Патология желчевыводящих путей, |
|
|
алкоголизм |
ЛДГ |
Печень, сердце, скелетные |
Заболевания паренхимы печени, инфаркт |
|
мышцы, эритроциты, |
миокарда, гемолиз, неэффективный |
|
тромбоциты, лимфатические |
эритропоэз, лимфомы |
|
узлы |
|
Небольшие по размерам молекулы первыми покидают поврежденные клетки, позднее ее покидают большие по размерам молекулы – белки и ферменты, в конечном итоге все содержимое некротизированных клеток поступает во внеклеточную жидкость. Молекулы фермента, покинувшие клетку, мигрируют из интерстицииальной жидкости в кровь. Выход ферментов непосредственно в кровь происходит только в хорошо васкуляризированных тканях, например, печени. В скелетной мышце
512
большая часть ферментов попадает в кровяное русло через лимфатические пути. При пассаже ферментов, вышедших из поврежденных кардиомиоцитов в кровоток, имеет значение скорость лимфотока. Полагают, что насосная функция сердца поддерживает постоянный поток лимфы, обеспечивая постоянную скорость выхода ферментов в перикардиальную жидкость.
Ферменты локализуются в разных клеточных компартментах, таких как цитозол, лизосомы, плазматическая мембрана или митохондрии. Появление определенной группы ферментов может свидетельствовать о степени и тяжести повреждения клеток. При обратимых дистрофических процессах,
характеризующихся только увеличением проницаемости мембран,
высвобождаются только ферменты из цитоплазмы. Появление в сыворотке как митохондриальных, так и цитоплазматических ферментов свидетельствует о некрозе клеток. На это в частности, может указывать тот факт, что значительные количества митохондриальной формы аспартатаминотрансферазы в сыворотке обнаруживают только при тяжелой форме гепатита, после обширного инфаркта миокарда.
Изоферменты. Ферменты, катализирующие одну и ту же реакцию, но различающиеся величиной молекулярной массы, аминокислотным составом,
электрофоретической подвижностью, термостабильностью, оптимумом рН,
субстратной специфичностью, по действию на них активаторов и ингибиторов и иммунологическим характеристикам, называют
изоферментами. Существует несколько механизмов их образования,
основным из которых следует считать различия в четвертичной структуре их молекул. Например, КК является димером, состоящим из 2 типов субъединиц: В и М. Поэтому в организме представлены 3 изофермента креатинкиназы – ВВ, МВ и ММ. Синтез субъединиц находится под контролем соответствующих генов, активность которых определяет различия в распределении изоферментов в разных тканях. Анализ изоферментного спектра дает возможность существенно увеличить специфичность энзимодиагностики заболеваний разных органов и тканей. Изоферментный
513
анализ позволяет дифференцировать по спектру КК инфаркт миокарда от повреждений мышц, по спектру -амилазы – панкреатит от повреждения слюнных желез, по изоферментам щелочной фосфатазы – заболевания печени от метастазов опухолей в костную ткань, по изоферментам кислой фосфатазы выделить простатит.
5.2.2. Клинико-диагностическое значение определения активности
отдельных ферментов Лактатдегидрогеназа и ее изоферменты. Лактатдегидрогеназа (ЛДГ)
– фермент, катализирующий обратимую реакцию превращения пирувата в лактат. Содержится в цитоплазме клеток практически всех органов и тканей организма. Наибольшая активность представлена в миокарде, почках,
скелетной мускулатуре, паренхиме печени, эритроцитах; меньшая — в
лимфоцитах, лёгких, поджелудочной железе. ЛДГ является тетрамером,
состоящим из двух типов субъединиц: Н и М. Поэтому ЛДГ в организме представлена пятью изоферментами: Н4-ЛДГ-1, Н3М1-ЛДГ-2, Н2М2-ЛДГ-3,
Н1М3-ЛДГ-4, М4-ЛДГ-5. Изоферментный спектр ткани определяется характером углеводного обмена. В тканях с преимущественно аэробным путем обмена (сердце, головной мозг, почки) активность ЛДГ связана с изоферментами ЛДГ1 и ЛДГ2. В тканях с выраженной способностью к анаэробному обмену (печень, скелетная мускулатура) в изоферментном спектре преобладает ЛДГ5. В ряде тканей (миометрий, надпочечники,
селезенка, легкие, клетки крови) активность ЛДГ равномерно распределена между всеми изоферментами. На рис.5.4 представлен спектр изменения изоферментов лактатдегидрогеназы в норме и при некоторых заболеваниях
514
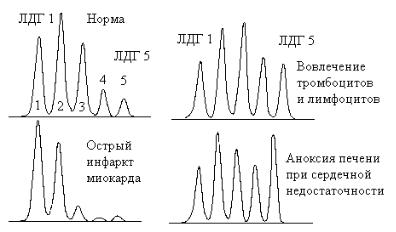
Рис. 5.4. Влияние типа патологии на каталитическую активность изоферментов
лактатдегидрогеназы в сыворотке при некоторых патологических состояниях
Тест может использоваться для диагностики и мониторинга лечения заболеваний скелетных мышц (миопатии), некоторых злокачественных новообразований. Чувствительность и специфичность возрастают при исследовании изоферментов ЛДГ.
Референтные пределы: <250 Ед/л, <4,2 мккат/л.
Увеличением активности фермента сопровождаются:
застойная сердечная недостаточность (при развитии гипоксии печени
идр. органов);
острые гепатиты (при вирусных гепатитах увеличение в течение первой недели желтушного периода в 2-3 и более раз, при типичном течении нормализация активности на 5-8 нед);
хронические гепатиты различной этиологии (как правило, лишь в период обострения);
токсические поражения паренхимы печени;
миопатии различной этиологии, исключая дистрофию нейрогенного характера (более информативным ферментативным тестом является креатинкиназа);
515
острый инфаркт миокарда (начало увеличения через 10-24 ч,
максимальная активность через 36-72 ч, нормализация через 10-15 сут и более);
инфекционный мононуклеоз;
гемолитическая, мегалобластная анемия.
Аланинаминотрансфераза. Аланинаминотрансфераза (АСТ)
относится к группе аминотрансфераз, содержащих в качестве кофермента производное витамина B6 пиридоксальфосфат. АЛТ катализирует обратимую реакцию дезаминирования аминокислоты аланина. Продукт дезаминирования (пируват) метаболизируется во многих направлениях,
включая распад с выделением энергии, синтез глюкозы и другие. Наиболее высокая активность фермента обнаруживается в печени (цитоплазме гепатоцитов), поджелудочной железе, сердце, скелетных мышцах,
эритроцитах, почках.
Определение активности АЛТ используется для оценки выраженности цитолитического синдрома при диагностике и мониторинге заболеваний печени. Тест применяется вместе с определением АСТ. При острых вирусных гепатитах активность АЛТ повышается у больных за несколько суток до клинических симптомов или желтухи. Активность АЛТ достигает максимума (повышение в 5-10 раз и более) на 1-2-й неделе острого пепатита,
что совпадает с максимальной клинической тяжестью болезни. При неосложненном течении заболевания активность аминотрансфераз приближается к нормальным значениям через 2-5 недель после появления желтухи. Удлинение периода гипераминотрансфераземии может свидетельствовать о переходе острого процесса в хронический, но судить об окончании патологического процесса в печени по этому тесту не всегда возможно. Отсутствие гипераминотрансфераземии не исключает хронизации процесса. При остром алкогольном гепатите происходит повышение активности аминотрансфераз, в большинстве случаев 2-3-кратное (не более
чем в 5 раз); как правило, активность АСТ увеличивается в большей степени,
516
чем АЛТ, что объясняют токсическим повреждением не только гепатоцитов,
но и миоцитов, кардиомиоцитов. При хронических персистирующих гепатитах вне обострения активность аминотрансфераз в сыворотке крови,
как правило, в референтных пределах; в период обострения повышена у 70– 80% больных, но относительно немного – в 2-5 раз.
Референтные значения (ориентировочные): 5 - 40 Ед/л.
Увеличением активности фермента сопровождаются:
острые и хронические заболевания печени с повреждением паренхимы любой этиологии (гепатиты, цирроз, внутри- и внепечёночный холестаз, инфекционный мононуклеоз);
шок, сердечная недостаточность с застойными явлениями в печени;
метастазы рака в печень, первичный рак печени;
острый инфаркт миокарда, острый миокардит, миопатии;
травма или операционное повреждение скелетных мышц, печени,
миокарда;
миозит, дерматомиозит;
гемолитическая анемия, мегалобластная анемия;
Аспартатаминотрансфераза. Аспататаминотрансфераза (АСТ)
катализирует обратимую реакцию дезаминирования аминокислоты аспартата. Продукт дезаминирования – щавелевоуксусная кислота метаболизируется во многих направлениях, включая распад с выделением энергии, синтез глюкозы и другие. АСТ широко распространена в органах и тканях организма человека, присутствует в митохондриях и в цитоплазме клеток. Наибольшая активность фермента обнаружена в сердечной мышце,
затем, по убыванию, – в печени (в цитоплазме и в митохондриях гепатоцитов), скелетных мышцах, головном мозге, семенниках и почках.
Высокая активность АСТ обнаружена в эритроцитах. Определение активности АСТ используется для оценки выраженности цитолитического
517
синдрома при диагностике и мониторинге заболеваний печени, сердца. Тест используется вместе с определением активности АЛТ.
Референтные значения (ориентировочные): 5-40 Ед/л
Увеличением активности фермента сопровождаются:
острый инфаркт миокарда;
острый миокардит;
острые и хронические заболевания печени с повреждением паренхимы любой этиологии (гепатиты, цирроз);
инфекционный мононуклеоз;
гемолитическая анемия, мегалобластная анемия.
Креатинкиназа и ее изоферменты. Креатинкиназа (КК) – фермент,
участвующий в энергопродукции, катализирует фосфорилирование креатина и его дефосфорилирование с образованием АТФ. Наибольшая активность фермента выявлена в скелетных мышцах и миокарде, меньшая – в головном мозге, плаценте, гладких мышцах, прямой кишке, предстательной железе и других тканях. Изоферменты КК состоят из двух субъединиц, обозначаемых как M («muscle» – мышца) и B («brain» – мозг). Известно три цитоплазматических изофермента, различающихся комбинацией субъединиц: MM-КК, MB-КК, BB-КК. Общей КК называют их суммарную активность в сыворотке крови. В веществе головного мозга КК представлена почти на 100% BB-КК. В скелетных мышцах присутствует в основном MM-
КК. В наибольших количествах MB-КК присутствует в миокардиоцитах.
Именно поэтому увеличение в сыворотке крови MB-КК – один из наиболее специфичных показателей цитолиза и некроза кардиомиоцитов.
BB-КК – изофермент, не проходит гематоэнцефалический барьер и в норме в сыворотке или плазме крови не обнаруживается. Общая КК крови в норме состоит на 95% из MM-КК и на 5% из MB-КК.
Определение активности КК используется для выявления и мониторинга цитолитического синдрома при заболеваниях миокарда и
скелетной мускулатуры. При диагностике острого инфаркта миокарда,
518
миокардитов специфичным показателем повреждения миокарда является увеличение MB-КК. Для дифференциальной диагностики нейрогенных мышечных заболеваний и миопатий, а также для наблюдения за течением последних определение сывороточной активности КК является наиболее информативным ферментативным тестом. Мышечная слабость, истощение и боль могут наблюдаться как при миопатиях, так и при нарушении иннервации, однако многие формы миопатий сопровождаются специфическим увеличением активности КК сыворотки крови, а при нейрогенных заболеваниях мышц подобные изменения отсутствуют.
Изменения КК в сыворотке могут иметь место в доклинический период наследуемых миопатий, а также при носительстве (доказано для дистрофии Дюшена). При интерпретации лабораторных данных необходимо учитывать,
что наиболее высокие величины гиперферментемии удаётся обнаружить на ранних стадиях миопатий. Позже, когда значительная часть мышечной ткани уже претерпела патологические изменения и биосинтез КК в мышцах снижен, уровень КК сыворотки может быть понижен.
Референтные значения /ориентировочные/: женщины < 170 Ед/л,
мужчины < 190 Ед/л
Увеличением активности фермента сопровождаются:
острый инфаркт миокарда (повышение активности, часто коррелирующее с обширностью инфартка, может быть обнаружено через 4- 6 ч после инфаркта, максимум достигается через 12-24 ч, снижение – через 2- 4 сут; в первые 12 ч после болевого приступа активность повышена в 80-89%
случаев крупноочагового инфаркта и в 60-64% мелкоочагового.
острые миокардиты (инфекционные и токсические);
заболевания скелетных мышц: полимиозиты, дерматомиозиты,
мышечные дистрофии;
злокачественная гипертермия;
судороги;
519
алкоголизм.
Гамма-глютамилтранспептидаза. Гамма-глютамилтранспептидаза
(ГГТ) – фермент, катализирующий реакции переноса аминокислот из плазмы крови в клетки, а также реакции в процессах реабсорбции аминокислот из желчи и мочи в кровь. В значительных количествах фермент обнаруживается в эпителии извитых канальцев нефрона, в желчных канальцах и ближайших к просвету частях эпителиальных клеток, выстилающих желчный проток.
Наибольшая активность фермента отмечается в цитоплазме и гладком эндоплазматическом ретикулуме (микросомах) гепатоцитов, расположенных
вобласти воротной вены. Основным источником сывороточной активности фермента являются гепатоциты.
Определение активности ГГТ используется для диагностики и мониторинга лечения заболеваний печени и билиарного тракта. Повышение фермента при этом является многозначным: отражает внутри- и
внепечёночный холестаз (вследствие деструкции желчевыводящих путей), в
некоторой степени – цитолиз паренхиматозных клеток (фермент менее чувствителен к повреждениям паренхимы, чем аминотрансферазы), является показателем индукции микросомальной гамма-глутамилтрансферазы алкоголем и гепатотоксичными лекарственными препаратами, может отражать поражение печени злокачественным процессом. При острых вирусных гепатитах происходит увеличение активности ГГТ до 10 раз (чаще
в5 раз), это обусловлено в основном холестазом, поэтому при холестатической форме гиперферментемия более выражена; сроки максимума сходны с таковыми для аминотрансфераз, нормализация происходит позже. При алкогольном гепатите активность ГГТ увеличивается
в20 раз, при лекарственном – варьирует в зависимости от природы и дозы лекарственного препарата. Увеличение активности ГГТ может выявляться при отсутствии повышения активности аминотрансфераз. При гепатоцеллюлярной карциноме у 90% больных без желтухи активность ГГТ
увеличивается в 10-20 раз, с желтухой – до 30 раз. Увеличение активности
520
