
3350
.pdf
Например, рассмотрим строение молекулы N2
Связь осуществляется за счет перекрывания 3 - p – электронных облаков вдоль оси x, y и z
Рис. 12. Образование - связи в молекуле N2
Перекрывание электронных облаков происходит вдоль линии, соединяющей центры атомов, а также перпендикулярно линии, соединяющей центры
Рис. 13. Образование - связей в молекуле N2
Как видно, в молекуле N2 между атомами азота осуществляется одна - связь (рис. 12) и две - связи (рис. 13).
73

Рис. 14. Схема образования - связи
- связь возникает при перекрывании двух d – атомных орбиталей, расположенных в параллельных плоскостях, четырьмя лепестками (рис. 14).
Таким образом, s– электроны могут участвовать лишь в образовании - связи, p– электроны – в образовании и - связей, а d– электроны – как в образовании и - связей, так и
- связей.
- и - связи налагаются на - связи, вследствие чего образуются двойные и тройные, как, например, в молекуле азота. Количество связей, образующих между атомами, называется кратностью (порядком) связи. С увеличением кратно-
сти связи изменяются длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинар-
ной связи. Это вызвано тем, что энергия - связи меньше, чем энергия - связей; - связь менее прочная, чем - связь и разрушается при химических взаимодействиях в первую очередь.
Гибридизация атомных орбиталей. При образовании нескольких химических связей иногда участвуют различные атомные орбитали одного и того же атома. Например, в молекуле метана четыре химические связи образованы путем перекрывания трех p и одной s – орбитали атома углерода с четырьмя s – орбиталями атомов водорода. Так как энергия и форма s и p – орбиталей различны, то можно было бы ожидать, что одна из четырех связей в молекуле метана будет отличать-
74

ся от других связей по прочности и по характеру направленности. Однако эксперименты показали, что все четыре связи в молекуле метана равноценны. Этот и другие подобные факты удалось объяснить при помощи теории гибридизации. Согласно этой теории при образовании молекул происходит изменение формы и энергии атомные орбиталей. Вместо неравноценных, например, s и p – орбиталей образуются равноценные гибридные орбитали, имеющие одинаковую форму и энергию, т.е. происходит гибридизация (смешение) атомных орбиталей. При образовании химических связей с участием гибридных орбиталей выделяется больше энергии, чем при образовании связей с участием отдельных s и p – орбиталей, поэтому гибридизация атомных орбиталей приводит к большему понижению энергии системы и соответственно повышению устойчивости молекулы.
Рис. 15. Форма sp – гибридной орбитали
Гибридная орбиталь по форме отличается от атомных орбиталей. Так, гибридная s и p – орбиталь отличается большей вытянутостью по одну сторону от ядра, чем по другую
(рис. 15).
Электронная плотность в области перекрывания гибридного электронного облака будет больше электронной плотности в области перекрывания отдельно s и p – орбиталей. По-
75
этому связь, образованная электронами гибридной орбитали характеризуется большей прочностью, чем связь, образованная электронами отдельно s - или p - орбитали.
Типы гибридизации s- и p- электронных облаков. Пространственная конфигурация молекул.
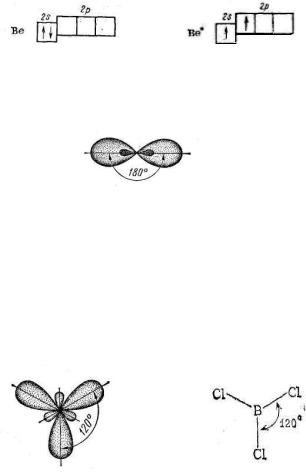
1) sp – или q2 – гибридизация характерна, когда в образовании связи участвует 1 s и 1 p- электрон.
Например, рассмотрим строение молекулы BeCl2
При возбуждении атома образуются две гибридных орбитали расположенные под углом 1800 относительно друг друга (рис. 16)
Рис. 16. Схема sp – гибридизации
Молекула имеет линейное строение типа AB2.
2) sp2 – или q3 – гибридизация. Гибридные облака располагаются под углом 1200 в одной плоскости (рис. 17).
При образовании гибридного облака участвует один s и 2 p электрона.
Рис. 17. Схема sp2 - гибридизации
76

Например, молекула BCl3
Молекула имеет форму плоского треугольника.
3) sp3 – q4 – гибридизация осуществляется за счет одного s и трех p – электронных облаков. Облака при этом типе гибридизации располагаются пол углом 1090 28 (рис. 18). 4 гибридных облака направлены из центра правильного тетраэдра к его вершинам. Примером такой молекулы может быть CH4,
CCl4.
Рис. 18. Схема sp3 – гибридизации
Кроме рассмотренных возможны и другие типы гибридизации валентных орбиталей и отвечающие им типы пространственной конфигурации молекул. Комбинация одной s – трех p
– и одной d – орбиталей приводит к sp3d – гибридизации. Это соответствует ориентации пяти sp3d – гибридных орбиталей к вершинам тригональной бипирамиды. В случае sp3d2 – гибридизации шесть sp3d2 гибридных орбиталей ориентируются к вершинам октаэдра. Ориентация семи орбиталей к вершинам пентагональной бипирамиды соответствует sp3d3 (или sp3d2f) – гибридизации валентных орбиталей центрального атома молекулы.
77

Таким образом, направленность химических связей определяет пространственную конфигурацию молекул.
Рассмотрим еще возможные типы возникающих молекул. Молекулы типа AA или AB. К этому типу относятся мо-
лекулы, образованные двумя одинаковыми или различными атомами, между которыми возникает одна одинарная ( - сигма) связь, последняя может быть образована за счет взаимодействия двух s – электронов, по одному от каждого атома (s - s ), двух p – электронов (p - p ) или двух электронов смешанного типа (s - p ) (рис. 19). Такие связи возникают между атомами элементов, имеющих один s – или p – электрон: водород, элементы группы IA (щелочные металлы) и группы VIIA (галогены). Молекулы этого типа имеют линейную форму, напри-
мер, H2, F2, Cl2, Br2, J2, Zi2, Na2, K2, HCl и др.
Рис. 19. Перекрывание s- и p- орбиталей с образованием - связи
Молекулы типа AB2, AB3. Они образуются за счет взаимодействия двух p – электронов атома В и s – электронов двух атомов A. Два непарных p- электрона характерны для атомов элементов VI А группы, т.е. для кислорода и его аналогов (халькогенов).
Электронные облака p- электронов располагаются относительно друг другу под углом 900 по координатным осям x и y.
78

Рис. 20. Перекрывание орбиталей в молекуле воды
Например, в молекуле H2O (рис. 20) перекрывание облаков s – электронов с облаками p – электронов происходит в месте, обозначенном штриховкой, а потому химические связи должны быть направлены под углом 90º. Такие молекулы называются угловыми. Однако согласно экспериментальным данным значительного чаще встречаются молекулы с иным значением валентного угла. Например, у молекулы воды валентный угол составляет 104,5º. Одной из причин этого явления, согласно теории валентных связей является наличие у центрального атома несвязывающих электронных пар. Искажение валентных углов в этом случае вызывается взаимным отталкиванием связывающих и несвязывающих электронных пар центрального атома. При этом следует учесть, что облако связывающей электронной пары (локализованной между двумя атомами) занимает меньше места, чем облако несвязывающей электронной пары, поэтому в наибольшей степени отталкивание проявляется между несвязывающими парами, несколько меньше эффект отталкивания между несвязывающей и связывающей парой и, наконец, меньшее отталкивание между связывающими электронными парами. Это видно на примере строения молекул метана, аммиака и воды. Центральные атомы этих молекул образуют химические связи за счет электронов s p3 - гибридные орбитали приходится четыре электрона
79

Это определяет образование четырех связей C – H и расположение атомов водорода молекулы метана CH4 в вершинах тетраэдра (рис. 21)
Рис. 21. Перекрывание орбиталей в молекуле метана
У атома азота на четыре sp3 - гибридных орбитали приходится пять электронов:
Следовательно, одна пара электронов оказывается несвязывающей и занимает одну из sp3 – орбиталей, направленных к вершинам тетраэдра. Вследствие отталкивающего действия несвязывающей электронной пары валентный угол в молекуле аммиака H3N оказывается меньше тетраэдрического и состав-
ляет < HNH = 107,3º.
Теперь уже ясно, что при рассмотрении молекулы воды угол валентный должен быть еще меньше, т.е. у атома кислорода на 4 sp3 – гибридные орбитали приходится шесть электронов т.е. две sp3– гибридные орбитали занимают несвязывающие электронные пары. Отталкивающие действия двух
80

несвязывающих пар проявляется в большей степени. Поэтому валентный угол искажается против тетраэдрического еще сильнее и в молекуле воды H2O составляет < HOH = 104º,5 . С увеличением числа несвязывающих электронов центрального атома изменяется и пространственная конфигурация молекул (табл. 7). Так, если молекула имеет форму правильного тетраэдра с атомом углерода в центре, то в случае молекулы H3N можно считать, что одна из вершин тетраэдра занята несвязывающей электронной парой и молекула имеет форму тригональной пирамиды. В молекуле H2O две вершины тетраэдра заняты электронными парами, а сама молекула имеет угловую V- образную форму.
тетраэдр |
тригональная |
угловая |
тип АВ4 |
пирамида |
тип АВ2 (А2В) |
СН4 |
тип АВ3 NH3 |
H2O |
Полярности связи. Связь между атомами разных электронов всегда более или менее полярна. Это обусловливается различием размеров и электроотрицательностей атомов. Например, в молекуле хлорида водорода HCl связывающее электронное облако смещено в сторону более электроотрицательного атома хлора. Вследствие этого заряд ядра водорода уже не компенсируется, а на атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра.
81
Таблица 7
Пространственная конфигурация молекул ABn
Тип |
Число электронных |
Тип |
Про- |
Примеры |
||
гиб- |
|
пар |
мо- |
странст- |
|
|
ри- |
|
атома A |
ле- |
венная |
|
|
ди- |
Связыва- |
Несвязы- |
ку- |
конфигу- |
|
|
за- |
ющих |
|
вающих |
лы |
рация |
|
ции |
|
|
|
|
|
|
sp |
2 |
|
0 |
AB2 |
линейная |
BeCl2 (г) |
|
|
|
|
|
|
CO2 |
sp2 |
3 |
|
0 |
AB3 |
треуголь- |
BCl3, CO 32 |
|
|
|
|
|
ная |
|
|
2 |
|
1 |
|
|
O3 |
|
|
|
|
AB2 |
угловая |
|
|
|
|
|
|
||
sp3 |
4 |
|
0 |
|
тетраэд- |
CCl4, |
|
|
|
|
AB4 |
рическая |
BH 4 ,NH 4 |
|
3 |
|
1 |
|
триго- |
H3N, H3P |
|
|
|
|
AB3 |
нально- |
|
|
|
|
|
|
перми- |
|
|
2 |
|
2 |
|
дальная |
|
|
|
|
|
AB2 |
угловая |
H2O |
|
|
|
|
|
|
|
sp3d1 |
5 |
|
0 |
AB5 |
триго- |
PF5, SbCl5 |
|
|
|
|
|
нально- |
|
|
|
|
|
|
бипира- |
|
|
|
|
|
|
мидаль- |
|
|
|
|
|
|
ная |
|
Иными словами, атом водорода в HCl поляризован положительно, а атом хлора отрицательно; на атоме водорода возникает положительный заряд, а на атоме хлора – отрицательный. Этот заряд - называют эффективным, его можно установить экспериментально. Согласно имеющимся данным, эф-
82
