
3350
.pdfРастворение газов в |
воде |
идет с |
выделением тепла |
H < 0 и с убылью энтропии ( S < 0). |
|
||
Согласно уравнению |
G = |
H – Т |
S (или H = Т S) |
самопроизвольному течению процесса растворения газов в воде способствуют низкие температуры. Чем выше температура, тем более вероятно, что величина Т S достигнет значения H, а равенство H = Т S отвечает равновесию процесса
растворения ( G = 0), т.е. насыщению раствора.
Растворение кристаллических веществ часто идет с поглощением теплоты ( H > 0) и обычно сопровождается ростом энтропии ( S > 0). Самопроизвольному течению процесса растворения кристаллических веществ в воде способствуют высокие температуры. При низких температурах, возможно, что величина Т S не достигнет значения H, и энергия Гиббса процесса будет положительна ( G > 0).
7.4. Свойства растворов неэлектролитов
Для количественного описания свойств растворов используют модель идеального раствора. Идеальным называют раствор, в котором силы межмолекулярного взаимодействия отдельных компонентов одинаковы и между компонентами нет химического взаимодействия. Образование такого раствора сопровождается нулевым тепловым эффектом ( H = 0); каждый компонент ведет себя в идеальном растворе независимо от остальных компонентов, и свойства раствора при данных условиях определяются только концентрацией растворенного вещества. Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
Давление насыщенного пара над веществом (в жидком или твердом состоянии является его важнейшей характеристикой. Эта характеристика определяет состояние равновесия в процессах испарения (сублимации) и конденсации:
Жидкость |
испарение |
193

или |
(сублимация) |
твердое вещество |
пар |
|
конденсация |
Смещение этих равновесий зависит от термодинамических условий сублимации и подчиняется принципу Ле – Шателье.
По аналогии с чистым веществом давление насыщенного пара над раствором также является важной его характеристикой, определяющей физико - химические свойства.
I закон Рауля. Для двухкомпонентного идеального раствора при данной температуре T давления насыщенных паров
чистых компонентов обозначим для растворителя P10 и для растворенного вещества P20
Выразим состав раствора в мольных долях
N1 + N2 = 1;
где N1 - мольная доля растворителя, а N2 - растворенное вещество.
Общее давление P насыщенного пара над раствором, очевидно, слагается из парциальных давлений компонента 1 p1 и компонента 2 p2
P = p1 + p2 |
(1) |
Уравнение (1) математически описывает закон Дальтона, согласно которому давление насыщенного пара над системой равно сумме парциальных давлений компонентов, образующих данную систему.
Парциальное давление компонентов зависит от их количественного соотношения в смеси или от их мольной доли:
p1 = P10 N1, p2 = P20 N2 (2)
194
Тогда из уравнений (1) и (2) следует:
P = P 0 |
N |
1 |
+ P 0 |
N |
2 |
(3) |
1 |
|
2 |
|
|
Если компонент 2 (растворенное вещество) является нелетучим веществом, то P20 = 0, и поэтому P2 = 0 и уравнение
(1) принимает вид:
P = p |
1 |
= P 0 |
N |
1 |
= P 0 |
(1 - N |
) (4), т.е. |
|
1 |
|
1 |
2 |
|
Общее давление насыщенного пара над раствором определяется только парциальным давлением летучего компонента. Уравнение (4) можно привести к виду:
P = P 0 |
- P = P 0 |
- p |
1 |
= P 0 |
N |
2 |
(5) |
1 |
1 |
|
1 |
|
|
где P – понижение давления насыщенного пара над раствором.
Из уравнения (5) следует также, что:
|
P |
|
P0 P |
|
P0 |
p |
N |
|
|
|
|
1 |
1 |
1 |
|
, где |
|||
|
P0 |
P0 |
P0 |
2 |
|||||
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
|
1 |
|
1 |
|
|
1 |
|
|
|
P |
- относительное понижение давления насыщенного пара |
||||||||
P 0 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
над раствором.
Уравнения (1.3), (1.4), (1.5) являются аналитическим выражением первого закона Рауля, который может быть сформу-
лирован: понижение давления насыщенного пара над раствором пропорционально мольной доле растворенного вещества.
195
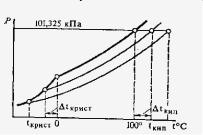
Рис. 57. Температуры кипения и кристаллизации разбавленных растворов
IIзакон Рауля. Любая жидкость кипит, когда давление
еенасыщенного пара достигнет величины внешнего давления. Температура, при которой давление насыщенного пара жидко-
сти равно нормальному давлению (760 мм рт. ст. или 101 325 н / м2) называется температурой кипения. Согласно I закону Рауля давление насыщенного пара растворителя над раствором меньше давления насыщенного пара над чистым растворителем при той же температуре.
Это значит, что при температуре кипения чистого растворителя давление насыщенного пара над раствором нелетучего вещества не достигает нормального давления и раствор кипит при более высокой температуре. Разность между температурами кипения раствора нелетучего вещества и чистого растворителя называется повышением температуры кипения и
обозначается ∆ t кип. (рис.1).
При замерзании жидкостей кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой становится равным давлению насыщенного пара над твердой фазой. Так, вода замерзает при 00 С потому, что при этой температуре давление насыщенных паров H2O над жидкостью и над льдом одинаково (0,61 кПа). Поскольку при заданной температуре давление насыщенного водяного пара над раствором меньше, чем над чистой водой
196
( P |
< |
P 0 |
), то при 00 С значение |
P |
не достигает |
H2O |
|
H 2O |
|
H2O |
|
0,61 кПа, и раствор при 00 С не замерзает.
При более низких температурах давление насыщенных паров H2O над жидкой и твердой фазами становится одним и тем же, раствор замерзает. Температура замерзания раствора тем ниже, чем больше его концентрация.
Для разбавленных растворов малолетучих неэлектролитов повышение температуры кипения ∆ t и понижение температуры замерзания ∆ t не зависят от природы растворенного вещества и прямо пропорциональны концентрации раствора
∆ t кип = Кэ · См; ∆ t зам = Кк · См,
где Кэ и Кк – эбулиоскопическая и криоскопическая константы соответственно; См – моляльность раствора малолетучего неэлектролита.
Физический смысл постоянных Кэ и Кк раскрывается следующим образом. Если в приведенном уравнении принять
Ск = 1, ∆ t кип = Кэ, ∆ t кр = Кк, т.е. числовые значения Кэ и Кк показывают, на сколько градусов выше кипел бы и насколько
градусов ниже замерзал бы раствор, содержащий 1 моль вещества в 1000 г растворителя по сравнению с температурами кипения и кристаллизации чистого растворителя.
Например, КК = 1,86 для H2O - КЭ = 0,52
Это значит, что водный раствор с одномоляльной кон-
центрацией растворенного вещества (См = 1) начинает кри-
сталлизоваться при 0 – 1,86 = -1,86 0С, а кипеть при 100 + 0,52 = 100,52 0С.
Если раствор состоит из x г растворенного вещества с молекулярным весом М и y г растворителя, то моляльная концентрация такого раствора равна:
|
|
|
x |
|
|
||
|
|
|
|
|
|
|
1000x |
m = |
|
|
М |
|
|||
|
|
y |
|
Мy |
|||
|
|
|
|
||||
|
1000 |
|
|
||||
197

Подставив это значение во II уравнение Рауля, и решив их относительно М, получим значение молекулярного веса растворенного вещества, вычисленного по понижению температуры кристаллизации растворов (криоскопический метод):
М = К к 1000x ,
t зам y
или по повышению температуры кипения растворов (эбулиоскопический метод):
М = К э 1000x ,
tкип . y
Применение – антифризы, холодные растворы; 30 % - ный раствор CaCl2 замерзает при – 550 С.
Осмотическое давление. При соприкосновении раствора с чистым растворителем на границе между ними наблюдается передвижение молекул растворенного вещества в среду чистого растворителя. Этот процесс диффузии обусловлен способностью растворенного вещества равномерно распределяться во всем объеме раствора; одновременно идет и диффузия растворителя в раствор, т.е. происходит процесс выравнивания концентраций.
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя. При условии, что C1 > C2 , молекулы растворителя с большей скоростью будут диффундировать в направлении C2 → C1, и объем раствора с концентрацией C1 несколько возрастет. Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом. (рис.58).
198

Рис. 58. Схема осмометра 1 – раствор; 2 – вода; 3 – полупроницаемая перегородка.
Столб жидкости с высотой h образовался за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул растворителя через полупроницаемую перегородку в обоих направлениях становятся одинаковыми.
Для количественной характеристики осмотических свойств растворов по отношению к чистому растворителю вводится понятие об осмотическом давлении, равном силе, приходящейся на единицу площади поверхности и заставляющей проникать молекулы растворителя через полупроницаемую перегородку.
Осмотическое давление Pосм. численно равно гидростатическому давлению столба жидкости высотой h, препятствующему односторонней диффузии растворителя. Величина Pосм. зависит от температуры раствора и его концентрации и не зависит от природы растворителя и растворенного вещества.
Для разбавленных растворов неэлектролитов зависимость осмотического давления от температуры и концентрации выражается уравнением:
Pосм. = CRT, закон Вант – Гоффа (1886 г.)
где С = Vn - молярная концентрация;
199

R - универсальная газовая постоянная; T - абсолютная температура.
Это уравнение выводится из уравнения Клайперона – Менделеева:
Pосм. = Vn RT
7.5. Свойства растворов электролитов
Электролитами называют вещества, которые в полярных растворителях или в расплавленном виде распадаются на ионы и проводят электрический ток.
Распад вещества на ионы под влиянием полярных молекул растворителя называется электролитической диссоциацией. Разделение веществ на электролиты и не электролиты понятие условное.
Соли, кислоты, основания - электролиты в воде, а в бензоле - неэлектролиты. Это связано с диэлектрической постоянной растворителя .
f = e1 .e2 , r 2
где f - связь между ионами; r - расстояние между ионами; e1 и e2 - заряды ионов.
Например, H 2O = 80, это значит, что связь в воде ослабляется в 80 раз.
C6 H6 = 2, следовательно, связь в бензоле ослабляется в
2 раза.
Электролитической диссоциации подвергаются вещества с ионной связью или сильно полярной.
Перенос тока в растворах и расплавах осуществляется ионами, поэтому их в отличие от электронных проводников
200
называют ионными проводниками или проводниками второго рода. Положительно заряженные ионы называют катионами.
Отрицательно заряженные анионами. Ионы в растворе находятся в состоянии неупорядоченного теплового движения. Растворы электронейтральны Σ + = Σ –
Особенности растворов электролитов. Растворы элек-
тролитов не подчиняются законам Рауля и Вант - Гоффа. Опытные величины tкип , tзам , Росм превышают расчет-
ные в одно и тоже число раз.
Объясняется это тем, что в растворах электролитов содержится больше ионов, чем в растворах не электролитов.
Pпрак.. |
|
tпр. |
|
tпр. |
i |
|
кип. |
з. |
|||
P |
|
tтеор. |
|
tтеор. |
|
теор. |
|
кип.. |
|
з. |
|
Например, в NaCl n = 2 i 2 , а в MgCl2 n = 3 i 3
Вант - Гофф ввел поправочный коэффициент i, который называется изотоническим коэффициентом. Подстановка это-
го коэффициента позволяет использовать эти формулы для всех растворов. Физический смысл этого коэффициента был выяснен, когда был установлен механизм электролитической диссоциации.
Как известно теорию электролитической диссоциации предложил шведский химик Аррениус, который, однако, рассматривал растворы как механическую смесь молекул и ионов растворенного вещества с молекулами растворителя. Таким образом, отрицая взаимодействие между ними, теория Аррениуса имела лишь физический смысл. Менделеев развил теорию растворов и предложил свою сольватную теорию растворения (гидратную). И. А. Каблуков объединил эти две теории и развил свою физико-химическую теорию растворения.
По Аррениусу диссоциация уксусной кислоты:
CH3COOH CH3COO- + H+
201

По Менделееву:
CH3COOH + (n+m) H2O CH3COO- · nH2O + H+· mH2O
Особенностью сольватов как химических соединений является то, что коэффициенты n и m меняются с изменением концентрации, температуры и других параметров раствора.
Слабые и сильные электролиты. В растворах некото-
рых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации – отношение числа молекул, диссоциированных на ионы, к общему числу
молекул: Nn ,
выражается в долях единицы или в %. Если =20 %, значит из 100 растворенных молекул 20 диссоциирует на ионы.
зависит от: 1) природы электролита;
2)концентрации раствора;
3)температуры раствора;
4)природы растворителя.
Примеры:
1) Для солей изменяется от 35 до 90 %. Для кислот HF = 8 % - слабая
H2SO4 = 60 % - сильная
HNO3 , HCl = 90 - 95 % CH3COOH = 1,4 %
H2CO3 =0,17 % первая ступень практически не диссоциирует.
HCN = 0,01 %
H2O = 1,8· 10-9 %
202
