
3350
.pdfЭлектрический ток в гальваническом элементе возникает за счѐт окислительно - восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделѐнными: на положительном электроде происходит процесс восстановления, на отрицательном - процесс окисления. Электрод, на котором происходит процесс восстановления, называется катодом (Cu), окис-
ления - анодом (Zn).
Необходимое условие работы гальванического элемента -
разность потенциалов электродов, которая называется электродвижущей силой гальванического элемента – ЭДС или ε.
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определѐнная условность в значении схемы элемента. Она заключается в том, что записанный слева электрод должен быть отрицательным. Например, элемент Даниэля - Якоби схематически изображается так:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
Двойная черта указывает на то, что диффузионный потенциал между растворами ZnSO4 и CuSO4 устранѐн. Это достигается применением промежуточного насыщенного раствора KCl или KNO3 с одинаковой подвижностью катионов и анионов. ЭДС элемента определяется разностью электродных по-
тенциалов меди и цинка, т.е. ЭДС = Е Cu0 2 / Cu0 - E 0Zn2 / Zn0
ЭДС = Е Cu – Zn = 0,34 - (- 0,76) = 1,1 (В), если концентра-
ция ионов цинка и меди равна 1 г – ион / л.
Если на электродах испытывает превращение один г – экв. вещества, то по закону Фарадея через систему протекает один фарадей электричества, при превращении одного моля вещества - n фарадеев электричества, равное числу грамм - эк-
243
вивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества Aэр равна
Aэр = nFE,
где Е - Э.Д.С. гальванического элемента.
С другой стороны, максимальная полезная работа Амр, которую может совершить система при протекании реакции (p = const), равна энергии Гиббса реакции:
Aмp = - G
Так как Aэp = Aэр, то получим
Е = - G / nF
Для реакции, протекающей в элементе Даниэля – Якоби
Zn + CuSO4 = ZnSO4 + Cu
Изменение свободной энергии в стандартных условиях равно -51,85 ккал (-216946 Дж); подставляя эту величину получим:
|
G0 |
|
216946 |
|
1,1 В. |
|
Е = - |
298 |
|
|
|||
nF |
2 96494 |
|||||
|
|
|
||||
Эта величина совпадает с ЭДС, вычисленной по разности стандартных потенциала меди и цинка.
Таким образом, главный критерий возможности самопроизвольного течения реакции в данном направлении - положительное значение вычисленной ЭДС соответствующего элемента.
Прямым измерением разности потенциалов на клеммах гальванического элемента при помощи обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента: U < ЭДС, что обусловлено падением напряжения внутри элемента и другими эффектами. Поэтому измере-
244
ние ЭДС обычно проводят компенсационным методом, при котором сила тока, протекающего через элемент, близка к нулю. Для этого к элементу подводят ЭДС с противоположным знаком от внешнего источника тока, значение которой можно регулировать тем или иным способом. В измерительную цепь включают также гальванометр для регистрации тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно ЭДС гальванического элемента (момент компенсации ЭДС), сила тока в цепи равна нулю (стрелка гальванометра не отклоняется). Измеренное в этот момент напряжение на клеммах гальванического элемента равно его ЭДС. Менее точный метод измерения ЭДС может быть использован с помощью высокоомного вольтметра, при измерении которым мала сила тока, протекающего через элемент, поэтому невелика разница между ЭДС и напряжением элемента.
9.3. Стандартный водородный электрод
ЭДС элемента равна разности равновесных потенциалов катода и анода. Если потенциал одного из электродов принять равным нулю, то относительный потенциал Е второго элемента будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода. В настоящее время известны лишь относительные электродные потенциалы. За нуль принят потенциал стандартного водородного электрода.
Водородный электрод представляет собой Рt - пластинку, покрытую тонким слоем очень рыхлой пористой платины для увеличения еѐ поверхности. Пластинка опускается в 2 н. водный раствор H2SO4 (рис. 62). Активность ионов водорода в таком растворе равна 1 г – ион/л. Через раствор пропускается химически чистый водород под атмосферным давлением. Водород насыщает поверхность Pt - пластины, часть его переходит в атомарное состояние H2 2H и на границе электрода с рас-
245
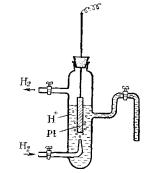
твором устанавливается равновесие Н ↔Н+ + ē или 2Н+ + 2ē
↔ Н2.
Водородный электрод условно обозначают Н2 / 2Н+, где вертикальная черта обозначает поверхность раздела фаз.
Если давление водорода в газовой среде, соприкасающейся с раствором равно 1 атм, активность ионов Н+ в растворе равна 1 г – ион/л , то потенциал такого электрода условно принимается за 0 В и его в этом случае называют нормальным
(стандартным) водородным электродом.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов
Рис. 62. Схема водородного электрода
которого является измеряемый, а вторым стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева - водородный электрод, справа - измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
Н2, Pt |H+| |Zn2+| Zn,
а схема для измерения потенциала медного электрода:
246
H2, Pt |H+| |Cu2+| Cu.
Поскольку потенциал водородного электрода условно принят за нуль, то измеряемая величина ЭДС элемента будет равна потенциалу электрода.
9.4. Поляризационные явления в гальванических элементах
ЭДС работающего элемента с течением времени уменьшается. Причиной этого является поляризация электродов. Поляризация - смещение величины электродного потенциала от его равновесного значения при прохождении тока.
E = Еi - Ep
где Е - поляризация; Еi - потенциал электрода при прохождении тока; Ep - равновесный потенциал. В элементе Даниэля - Якоби с растворением цинкового электрода накапливаются ионы Zn2+ в приэлектродном слое. В уравнении Нернста связь потенциала с концентрацией имеет вид:
E Zn2 / Zn0 = E |
0Zn2 / Zn0 + |
0,059 |
lg [Zn2+]; при [Zn2+] = 1 г – ион / л |
|||||
2 |
||||||||
|
|
|
|
|
|
|
||
|
|
|
|
Е = Е0 = -0,76 В. |
||||
Если концентрация увеличилась в 100 раз, то: |
||||||||
E |
|
|
0 = -0,76 + |
0,059 |
lg 102 = - 0,702 В |
|||
2 |
/ Zn |
|
||||||
|
Zn |
|
2 |
|
||||
|
|
|
|
|
||||
Это приводит к повышению потенциала цинка. Таким образом, при анодной поляризации потенциал смещается в положительную сторону.
247
У медного электрода концентрация катионов меди Cu2+ уменьшается в результате их восстановления и потенциал меди понижается:
E |
|
|
0 = 0,34 + |
0,059 |
lg 10 -2 = 0,282 В |
2 |
/ Cu |
|
|||
|
Cu |
2 |
|
||
|
|
|
|
||
При катодной поляризации потенциал катода смещается
вотрицательную сторону.
Врезультате уменьшается ЭДС элемента
ЭДС = 0,282 В - 0,702 В = 0,984 В (< 1,1 В)
Изменение величины потенциала электрода по сравнению с исходным равновесным значением, вызванное изменением концентрации потенциалопределяющих ионов в раство-
ре, называется концентрационной поляризацией. Этот вид по-
ляризации наблюдается и в элементе Вольта
Zn |H2SO4| Cu
Электродные реакции в элементе Вольта
А: Zn = Zn2+ + 2ē K: 2H+ + 2ē = H2
При протекании тока в этом элементе происходит концентрационная поляризация отрицательного электрода, вызванная растворением цинка, а также химическая поляризация медного электрода. Поляризация называется химической в том случае, когда она вызывается изменением химической природы электрода. Так, в элементе Вольта поверхность медного электрода насыщается водородом и образуется "водородный электрод", потенциал которого более низкий, чем потенциал медного электрода.
248
Поляризация может быть обусловлена и замедленной кинетикой электрохимической реакции окисления и восстановления. Как правило, при работе элемента падение напряжения вызывается рядом причин.
При использовании гальванического элемента, как источника тока, большое значение приобретает процесс устранения поляризации - так называемая деполяризация. Перемешивание раствора уменьшает концентрационную поляризацию. Химическую поляризацию можно устранить, вводя в электролит специальные вещества (деполяризаторы), вступающие в
реакцию с продуктами, обуславливающими поляризацию. Например, поляризация, вызываемая выделением водо-
рода, снижается под действием специально добавленных окислителей (К2Cr2O7, O2, KMnO4 и др.)
2KMnO4 + 5H2 + 3H2SO4 → 2MnSO4 + K2SO4 + 8H2O
В результате этой реакции поверхность катода очищается от водорода и ЭДС возрастает.
9.5. Химические источники тока
Для своих нужд в настоящее время человечество использует в основном химическую энергию ископаемого вещества. Химическая энергия превращается в электрическую на паро-
турбинных тепловых электростанциях и в механическую энергию в двигателях внутреннего сгорания, используемых на транспорте. Т.е. производство электроэнергии станциями, работающими на угле, природном газе, бензине или других подходящих носителях энергии, осуществляется по следующей, ставшей уже классической схеме: химическая энергия топлива
– тепловая энергия - энергия движения, электроэнергия. При современных способах преобразования химической энергии топливо используется неэффективно: к.п.д. двигателей внутреннего сгорания и электростанций составляет 15 – 40 %. Если бы удалось преобразовывать химическую энергию в электри-
249
ческую, минуя промежуточные стадии, был бы получен значительный выигрыш как в материалах, так и в энергии. Кроме того, паротурбинные установки и двигатели внутреннего сгорания не могут быть использованы во многих областях техники, например: в системах, работающих в космосе и под водой,
впортативных устройствах. Существенным недостатком тепловых электростанций и двигателей внутреннего сгорания является то, что они дают большое число вредных выбросов, загрязняют окружающую атмосферу. В связи с этим ведутся поиски новых методов преобразования энергии.
Одним из наиболее перспективных является электрохимический способ преобразования химической энергии в электрическую, которая осуществляется в химических источниках тока. К ним относятся: гальванические элементы, аккумуляторы и топливные элементы. Достоинством их является высокий к.п.д., бесшумность, безвредность, возможность использовать
вкосмосе и под водой, в переносных устройствах на транспорте и т.п.
Гальванические первичные элементы. Гальваниче-
скими первичными элементами называют устройство для прямого преобразования химической энергии заключенных в них реагентов в электрическую энергию. Реагенты входят непосредственно в состав гальванического элемента и расходуются
впроцессе его работы. После расхода реагентов элемент не может больше работать. Таким образом, это источник тока одноразового действия, поэтому его еще называют первичным химическим источником тока. Гальванический элемент харак-
теризуется ЭДС, напряжением, емкостью и энергией, которую он может отдать во внешнюю цепь.
Напряжение элемента U меньше ЭДС из-за поляризации электродов и омических потерь.
U = E - I (r1 + r2) – E,
250
где Е – ЭДС элемента; I – сила тока; r1 и r2 – сопротивление проводников первого и второго рода внутри элемента; Е – поляризация элемента, равная сумме катодной и анодной поляризаций:
Е = Ек + Еа
В свою очередь катодная и анодная поляризация является суммой концентрационной и электрохимической поляризаций анода и катода.
Поляризация возрастает с увеличением плотности тока. Кроме того, при увеличении плотности тока растет омическое падение напряжения. Таким образом, при увеличении плотности тока напряжение элемента падает.
Емкость элемента – это количество электричества, которое источник тока отдает при разряде. Она определяется количеством запасенных в элементе реагентов, их эквивалентом и степенью превращения. Если элемент разряжается при постоянной силе тока I, то емкость практически определяют по уравнению
CI = I · η,
где CI – емкость при постоянной силе тока, А; η – время разряда элемента.
Если элемент разряжается при постоянном внешнем сопротивлении R, то емкость имеет вид:
|
1 |
|
|
CR = Id = |
Ud |
||
R |
|||
0 |
0 |
||
|
Если элемент разряжается при постоянной силе тока I, то энергию элемента определяют по уравнению
251

A I = I Ud IU ср.
0
и если элемент разряжается при постоянном внешнем сопротивлении R, то по уравнению:
|
|
|
|
2 |
|
|
А R |
= |
1 |
U2d |
Uср. |
, |
|
R |
R |
|
||||
|
|
0 |
|
|
||
|
|
|
|
|
|
где А I и А R – энергия элемента, которую он отдает во внешнюю цепь, соответственно при постоянной силе тока I или постоянном внешнем сопротивлении R; U ср. – среднее напряже-
ние при разряде элемента.
Важной характеристикой элемента служит удельная энергия, т.е. энергия, отнесенная к единице массы или объема элемента. Так как при увеличении силы тока напряжение элемента падает, то энергия элемента, и удельная энергия также падают. Более высокую удельную энергию можно получить в элементах с большим значением ЭДС, малой поляризацией, ма-
лыми значениями электрохимических эквивалентов. В качестве анодов обычно применяют электроды из цинка и магния; катодов – электроды из окислов металлов (марганца, меди, ртути, серебра) и хлоридов (меди и свинца) на графите, а также кислородный электрод.
Широко применяется для питания радиоаппаратуры, аппаратуры связи, магнитофонов, карманных фонарей.
Марганцево - цинковый элемент. Анодом в элементе служит цинковый электрод, катодом – электрод из смеси диоксида марганца с графитом, токоотводом служит графит. В качестве электролита используется паста, состоящая из раствора хлорида алюминия с добавкой муки или крахмала (загустите-
ли). Схема элемента: Zn NH 4Cl MnO 2 , C
252
