
3350
.pdf
качестве катализаторов. Если не использовать катализаторы, получаются вложенные или многослойные нанотрубки, то есть нанотрубка внутри нанотрубки, как показано на рис. 42. Дуговым методом можно получить однослойные нанотрубки диаметром 1-5 нм и длиной порядка 1 мкм.
Рис. 42. Схема вложенных нанотрубок, когда одна трубка находится внутри другой
Методом химического осаждения из паровой фазы заключается в разложении газообразного углеводорода, например, метана (СН4), при температуре 1100 °С. При разложении газа образуются свободные атомы углерода, конденсирующиеся затем на более холодной подложке, которая может содержать разнообразные катализаторы, такие как железо. Этот процесс позволяет получать продукт непрерывно и, возможно, является наиболее предпочтительным для увеличения масштабов при промышленном производстве.
Механизм роста нанотрубок до сих пор неясен. Так как для роста однослойных трубок необходим металлический катализатор, механизм должен объяснять роль атомов кобальта или никеля. Одно из предложений, называемое «механизмом скутера», состоит в том, что атомы металлического катализатора присоединяются к оборванным связям на открытом конце трубки и, обегая ее по краю, способствуют захвату атомов углерода из паровой фазы и их встраиванию в стенку трубки.
Обычно при синтезе получается смесь нанотрубок раз-
123
ных типов с различным характером и величиной электропроводности. Группа из IBM разработала метод отделения полупроводящих нанотрубок от металлических. Для разделения смешанные пучки нанотрубок осаждают на кремниевую подложку, а затем на эти пучки напыляют металлические электроды. Используя подложку как электрод, на него подают небольшое напряжение смещения, запирающее полупроводниковые трубки и эффективно превращающее их в изоляторы. Затем между металлическими электродами прикладывается высокое напряжение, создающее большой ток в металлических нанотрубках, что приводит к их испарению, после чего на подложке остаются только полупроводниковые нанотрубки.
Молекулярные кристаллы представляют собой молекулы, соединенные силами межмолекулярного взаимодействия, включая и другие дополнительные виды связей. Кристаллы молекулярного типа характерны для органических веществ, а также и других, в молекулы которых входят атомы с близкими значениями электроотрицательностей (так как в противном случае будет проявляться также связь ионного типа).
И о н н ы е к р и с т а л л ы построены из отдельных разноименно заряженных ионов. Энергия ионных кристаллических решеток должна создаваться за счет электростатических сил взаимодействия, однако, как это было указано ранее, ионной связи в чистом виде не бывает и между ионами в какой-то степени сохраняется также ковалентная связь.
Кроме того, между ионами возникает явление поляризации, что также влияет на энергию ионной кристаллической решетки.
Расчет энергии кристаллических решеток различных соединений дает величины 700 - 1000 кДж/моль, что, вообще говоря, близко совпадает с опытными данными.
Геометрические формы кристаллов простых неорганических соединений (галидов, оксидов) обычно не очень сложны и определяются соотношением радиусов ионов. В присутствии ио-
124
нов с большим обобщенным потенциалом, вызывающим поляризацию, происходит усложнение кристаллической решетки.
Наиболее простыми кристаллическими решетками ионного типа являются решетки NaCl и CsCl, рассмотренные нами ранее. Однако в кристаллах веществ, содержащих комплексные ионы, структура элементарных ячеек может быть очень сложной. Также очень сложными структурами обладают кристаллы, построенные за счет весьма устойчивого координационного числа 4, характерные для диоксида кремния и его многочисленных соединений.
4.4. Металлическая связь
Металлические кристаллы отличаются от всех остальных кристаллов высокой пластичностью, электропроводностью и теплопроводностью. Эти свойства, а также и многие другие, обусловлены особым видом связи между атомами металла – металлической связью. Она возникает между атомами металлов в результате их сближения за счет перекрывания внешних орбиталей. Эта связь не является ковалентной неполярной связью, так как электроны не фиксируются между двумя атомами, а переходят в состояние проводимости и могут принадлежать всем атомам данного кристалла и даже куска металла, содержащего громадное количество кристаллических зерен. Эти мигрирующие электроны, или обобщенные электроны, - электроны проводимости (свободные электроны или электронный газ) – и осуществляют ненаправленную связь между остовами атомов в кристаллической решетке металлов.
Металлическая связь представляет собой результат перекрытия делокализованных орбиталей атомов, сближающихся между собой в кристаллической решетке металлических кристаллов.
Особенностью кристаллической структуры металлов являются высокие координационные числа (8-12), свидетельствующие о большой плотности упаковки в кристаллических
125
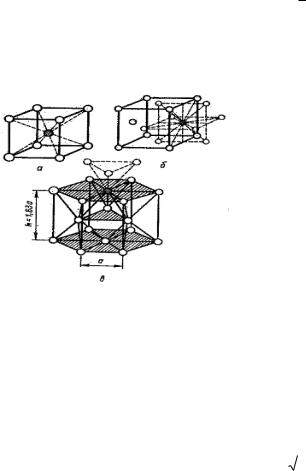
ячейках. Высокая плотность упаковки объясняется тем, что остовы атомов, лишенные внешних электронных уровней, укладываются в пространстве как шары одинакового радиуса. Типичные для металлов кристаллические решетки показаны на рис. 43.
ОЦК - Объемноцентрированная кубическая решетка
(К 8) (рис. 43, а) характеризуется следующими данными: а) координационное число К = 8; б) кратчайшее расстояние между
центрами атомов равно половине диагонали куба а
 3 / 2 ; в) число атомов, необходимое для построения, п = 2, так как 8 вершин содержат 1/8 атома, приходящегося на данный куб, и в центре куба находится еще один атом;
3 / 2 ; в) число атомов, необходимое для построения, п = 2, так как 8 вершин содержат 1/8 атома, приходящегося на данный куб, и в центре куба находится еще один атом;
Рис. 43. Металлические решетки
г) плотность упаковки или часть пространства, занятая атомами в данном кубе, составляет ~68 %. В таких решетках кристаллизуются К, Na, W, α- Fe, β- Ti и др.
ГЦК - Гранецентрированная кубическая решетка (К 12)
(рис. 43, б) определяется следующими данными: а) координационное число К = 12; б) кратчайшее расстояние между
|
|
|
|
центрами атомов равно половине диагонали |
грани а 2 / 2 ; |
||
в) число атомов, необходимое для построения, |
равно 4, так как |
||
126
на все вершины нужен только один атом, а атом, находящийся в центре грани, наполовину принадлежит данному кубу, а таких граней 6. Следовательно, n = 8(1/8) + 6(1/2) = 4; г) плотность упаковки в данной решетке составляет ~74 %. В таких решетках кристаллизуются Сu; Ni; γ- Fe; Pb и др.
ГПУ - Гексагональная решетка плотной упаковки (Г 12)
(рис. 43, в) более сложная, но по степени упаковки совпадает с гранецентрированной кубической. Ее данные: а) координационное число К = 12; б) кратчайшее расстояние между центрами атомов а равно стороне правильного шестиугольника основания призмы. Все атомы, если их представить шарами радиусом а/2, будут в этой решетке касаться друг друга. Поэтому высота призмы h в идеальном случае (Mg, Be) должна быть рав на 1,63 а или двум высотам тетраэдров, построенных из этих шаров; в) число атомов, необходимых для построения, равно 6. На каждой вершине призмы расположен атом, одновременно принадлежащий шести сходящимся в одной точке решеткам. Вершин 12 x 1/6 = 2. В центре верхнего и нижнего основания лежат атомы, половина которых относится к данной решетке: 2 x 1/2 = l. Внутри призмы находятся еще три атома и всего получается n = 12 х 1/6 + 2 х 1/2 +3 = 6; г) плотность упаковки 74 %. В таких решетках кристалли-
зуется Be, Mg, Zn, α- Ti и др.
4.5. Реальные кристаллы и нарушения кристаллической структуры
Дефекты кристаллической структуры. По мере совер-
шенствования методов изучения кристаллов (прецизионные методы рентгеновского анализа, микроскопия и электроноскопия) оказалось, что кристаллические тела не являются идеальными, a обладают рядом дефектов кристаллической структуры. Грубые дефекты кристаллической структуры, образующиеся при получении кристаллов, поры, трещины обычно получаются при нарушении технологии отливки или сварки металлов
127

или при выращивании кристаллов из расплавов, растворов или из газовой фазы. Нарушения микроструктуры кристаллов обнаруживаются c большим трудом, но так как они сильно влияют на физические свойства твердых тел, то их изучение в настоящее время ведется весьма интенсивно.
Все дефекты кристаллической структуры можно условно разделить на два типа: точечные и линейные.
Точечные дефекты или вакансии возникают за счет сме-
щения отдельных частиц в кристалле с их мест в кристаллической решетке с образованием вакансии и атома или иона в междоузлии. Вероятность возникновения таких дефектов увеличивается в зависимости от температуры по экспоненциальному закону:
Q
n ae RT ,
где n - число вакансий в единице объема кристалла; Q - энергия образования пары вакансия - атом в междоузлии; R - газовая постоянная; Т - абсолютная температура; а - постоянная величина для данного кристалла. Вакансии могут возникать в решетках любого типа, ослабляя связи между частицами в кристалле, и прочность кристаллических веществ практически обращается в нуль раньше, чем они полностью перейдут в жидкое состояние.
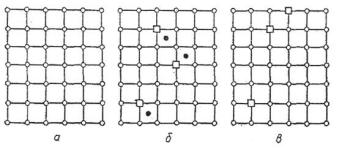
На рис. 44, а, приведена идеальная кристаллическая решетка; решетка с атомами в междоузлиях и вакансиями (Френкель) показана на рис. 44, б, а возникновение вакансий за счет поверхностного испарения (Шоттки) приведено на рис. 44, в.
Вакансии в кристалле перемещаются, так как их место может быть занято соседними атомами. Вакансии могут скапливаться в каком - нибудь одном месте - коагуляция вакансий.
Линейные дефекты или дислокации возникают при пластиче-
ских деформациях кристалла и нарушении совпадения кристаллических плоскостей. Линейные дислокации могут зарождаться не только за счет внешней силы, вызывающей деформа-
128
цию, но и за счет внутренних напряжений (при нагреве или охлаждении и т. д.).
. .
Рис. 44. Точечные дефекты в кристаллах:
а- идеальная решетка; б - вакансии по Френкелю;
в- вакансии по Шоттки
На рис. 45 показано возникновение дислокации при пластической деформации идеального кристалла.
Дислокации могут быть положительными и отрицательными, a самое главное, они могут перемещаться в теле кристалла, накапливаться в месте наибольших напряжений и т.д. Дислокации могут выходить на поверхность кристалла и создавать нарушения поверхностного слоя.
Винтовые дислокации также возникают при деформациях, но уже сдвига. На рис. 46 показано возникновение двух дислокаций - правой и левой - при неполном сдвиге одной части кристалла относительно основной его массы.
Центр выхода винтовой дислокации является высокоактивной точкой поверхности, способной к дальнейшему развитию в виде винтовых нитевидных монокристаллов («усы»), обладающих прочностью, близкой к теоретической.
Получение таких нитевидных монокристаллов и их соединений (Аl2O3 - сапфир), a также графита в настоящее время
129

уже освоено. Они применяются для армирования высокопрочных пластмасс и металлокерамических систем, употребляющихся в особо ответственных конструкциях.
Рис. 45. Возникновение линейных дислокаций
Мозаичная, или блочная, кристаллическая структура получается в результате сращивания отдельных кристаллических зерен под некоторым весьма малым углом (доли градуса). B такой мозаичной структуре даже в пределах одного зерна возникает область на границе мeждy блоками, содержащая большое число нарушений кристаллической структуры (дислокации, вакансии). Естественно, при этом снижаются прочностные свойства поликристаллических конструкционных материалов.
Рис. 46. Возникновение винтовых дислокаций
130
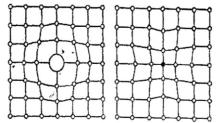
Примесные атомы, входящие в кристаллическую решетку основного металла (матрицы), также создают искажение кристаллической структуры (рис. 47).
Широта области гомогенности. Наличие нарушений кристаллической структуры, особенно при внедрении атомов примеси до концентрации, еще не вызывающей перестройку данной решетки, создает изменение химического состава кристалла при сохранении его формы. Как известно, пределы изменения химического состава при сохранении кристаллической структуры вещества называют широтой области гомогенности.
Рис. 47. Влияние примесных атомов на кристаллическую структуру
Обычно ионные кристаллы отличаются небольшой широтой области гомогенности (1-5 %), однако к таким кристаллам уже нельзя полностью применять закон постоянства состава. Значительно больше широта области гомогенности у соединений металлов c углеродом, бором, кремнием, азотом, водородом и кислородом, сохраняющих до известной степени металлический характер связи (электропроводность).
131
РАЗДЕЛ ВТОРОЙ
ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
Глава 5. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
5.1. Элементы химической термодинамики
Основные понятия и величины. Термодинамика изуча-
ет законы, которые описывают обмен энергией между изучаемой системой и внешней средой.
Химическая термодинамика – наука, изучающая переходы энергии из одной формы в другую при химических реакциях и устанавливающая направление и пределы их самопроизвольного протекания при заданных условиях.
Химическая термодинамика позволяет нам предсказывать устойчивость веществ и их способность реагировать в том или ином направлении, она дает способы расчета тепловых эффектов и глубины протекания реакции по заданному начальному состоянию.
Объектом изучения в термодинамике является система. Системой называется совокупность находящихся во взаимодействии веществ, мысленно обособленная (или фактически) от окружающей среды. Таким образом, вселенная разделяется на две части: систему, которая подвергается теоретическому и экспериментальному изучению и внешнюю среду, в которую входит остальная часть вселенной.
Различают гомогенные и гетерогенные системы. Гомогенной называется такая система, внутри которой нет поверхности раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Системы же, внутри которых такие поверхности раздела имеются, называются гетерогенными. От этих понятий следует отличать понятия однородной и неоднородной систем. Гомогенные системы состоят из одной фазы,
132
