
3350
.pdf
В системе из двух атомов гелия He2 четыре электрона; два на связывающей и два на разрыхляющей орбитали.
Энергия, длина и порядок связи. По характеру распре-
деления электронов по молекулярным орбиталям можно оценить энергию и порядок связи. Как уже было показано, нахождение электрона на связывающей орбитали означает, что электронная плотность концентрируется между ядрами, что обуславливает сокращение межъядерного расстояния и упрочения молекулы. Наоборот электрон на разрыхляющей орбитали означает, что электронная плотность концентрируется за ядрами. В этом случае, следовательно, энергия связывания снижается, а межъядерное расстояние увеличивается, как это показано ниже.
В ряду H2+ - H2 - He2+ по мере заполнения связывающей орбитали, энергия диссоциации молекул возрастает, с появлением же электрона на разрыхляющей МО, наоборот, уменьшается, а затем увеличивается.
Молекула гелия существовать не может в невозбужденном состоянии, так как число связывающих и разрыхляющих электронов у нее одинаково.
Согласно методу МО порядок связи (кратность) (n) оценивается полуразностью числа связывающих и разрыхляющих электронов:
n a b , где
2
a – число электронов на связывающих орбиталях;
93

b - число электронов на разрыхляющих орбиталях.
или n a b , где А – число атомов в молекуле.
А
Нетрудно подсчитать, что в молекулярном ионе водорода и дигелии – ионе порядок связи равен 0,5, в молекуле водорода 1, а в системе из двух атомов гелия – нулю.
Двухатомные гомоядерные молекулы элементов вто-
рого периода. У элементов 2 – го периода кроме 1 s – орбиталей в образовании МО принимают участие 2s -; 2px - , 2py и 2pz – орбитали.
Комбинация из 2s – орбиталей, как и в случае атомных
1s – орбиталей, соответствует образованию двух молекулярных ζ – орбиталей: ζсв2s и ζразр2s.
Иная картина наблюдается при комбинации орбиталей p
– типа. При комбинации атомных 2px – орбиталей, которые вы-
тянуты вдоль оси х, возникают молекулярные ζ – орбитали:
ζсв2px и ζразр2px.
При комбинации 2py и 2pz атомных орбиталей образуют-
ся πсв2py и πсв2pz, πразр2py и πразр2pz.
Поскольку энергия 2py и 2pz - орбиталей одинакова и перекрываются они одинаковым способом, возникающие πсв2py и
πсв2pz – орбитали имеют одинаковую энергию и форму; то же самое относится к πразр2py и πразр2pz – орбиталям. Таким обра-
зом, молекулярные π – орбитали составляют πсв и πразр дважды вырожденные энергетические уровни.
Согласно спектроскопическим данным МО двухатомных молекул элементов конца периода по уровню энергии распола-
гаются в следующем порядке:
ζсв1s < ζразр1s < ζсв2s < ζразр2s < ζсв2px < πсв2py = πсв2pz < πразр2py = πразр2pz < ζразр2px
При энергетической близости 2s и 2p – орбиталей электроны на ζ 2s и ζ 2p – орбиталях взаимно отталкиваются и потому πсв2py и πсв2pz - орбитали оказываются энергетически более выгодными, чем ζсв2px орбиталь. В этом случае порядок
94

заполнения молекулярных орбиталей несколько изменяется и
соответствует следующей последовательности:
ζсв1s < ζразр1s < ζсв2s < ζразр2s < πсв2py = πсв2pz < ζсв2px < πразр2py = πразр2pz < ζразр2px
Энергетическое различие 2s и 2p – орбиталей в периоде увеличивается от I группы к VIII. Поэтому приведенная последовательность молекулярных орбиталей характерна для двухатомных молекул элементов начала II – го периода вплоть до N2. Так, электронная конфигурация N2. в основном (невозбужденном) состоянии имеет вид:
2N [1s2 2s2 2p3] = N 2 |
[(ζсв1s) 2 |
(ζразр1s) 2 (ζсв2s) 2 (ζразр2s) 2 * |
(πсв2py) 2 (πсв2pz) 2 (ζсв.2px) 2] |
|
|
или графически (рис. 28): |
|
|
АО |
МО |
АО |
N 1s2 2s2 2p3 |
N 2 |
1s2 2s2 2p3 |
Рис. 28. Энергетическая диаграмма образования молекулярных орбиталей N2
Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные и диамагнитные вещества. Парамагнитными являются вещества,
95

у которых имеются непарные электроны, у диамагнитных веществ – все электроны парные.
В таблице приведены сведения об энергии, длине и порядке связи гомоядерных молекул элементов начала и конца 2 – ого периода:
В молекуле кислорода имеется два непарных электрона, поэтому она парамагнитна; молекула фтора непарных электронов не имеет, следовательно, она диамагнитна. Парамагнитны также молекула B2 и молекулярные ионы H2+ и He2+, а молекулы С2, N2 и H2 – диамагнитны.
Двухатомные гетероядерные молекулы. Гетероядер-
ные (разноэлементные) двухатомные молекулы описывают методом МОЛКАО, так же как гомоядерные двухатомные молекулы. Однако поскольку речь идет о разных атомах, то энергия атомных орбиталей и их относительный вклад в молекулярные орбитали тоже различны:
Ψ+ = С1 ΨА + С2 ΨB Ψ- = С3 ΨА + С4 ΨB
96
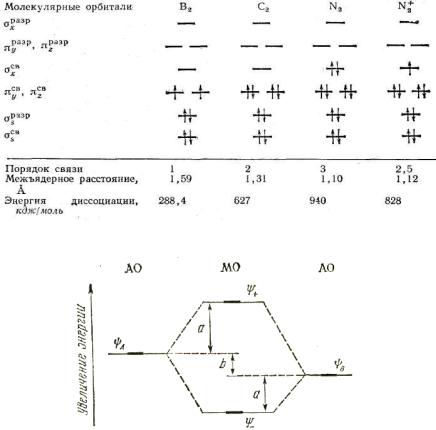
Рис. 29. Энергетическая диаграмма молекулярных орбиталей гетероядерной молекулы АВ
В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного элемента (рис. 29). Допустим, атом B электроотрицательнее атома A. Тогда
С2 > С1, а С3 > С4.
Различие в энергии исходных атомных орбиталей определяет полярность связи. Величина в является мерой ионности,
97
а величина a – ковалентности связи.
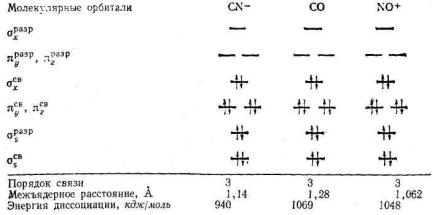
Диаграмма энергетических уровней гетероядерных двухатомных молекул 2 – го периода аналогична диаграмме гомоядерных молекул 2 – го периода. Например, рассмотрим рас-
пределение электронов по орбиталям молекулы CO и ионов
CN- и NO+.
Молекула CO и ионы CN-, NO+ изоэлектронны молекуле N2 (содержит по 10 валентных электронов), что соответствует следующей электронной конфигурации в невозбужденном состоянии:
(ζsсв.)2 (ζsразр.)2 (πусв.)2 (πzсв.)2 (ζхсв.)2
Энергетическая диаграмма уровней молекулы BeH2 имеет
вид: Четыре валентных электрона невозбужденной молекулы
св.
BeH2 располагаются на ζ S и ζ свx - орбиталях, что описывается
св.
формулой (ζ S ) 2 (ζ свx ) 2.
3.8. Ионная связь
Химическая связь, возникающая за счет перехода электронов от атома к атому, называется ионной, или электрова-
98
лентной. Электровалентность определяется числом электронов, теряемых или приобретаемых каждым атомам. Причиной возникновения ионной связи является большая разность ЭО взаимодействующих атомов 2,0 и более. Принципиального различия в механизме возникновения ковалентной и ионной связей нет. Эти виды связи отличаются лишь степенью поляризации электронного облака связи, а, следовательно, длинами диполей и величинами дипольных моментов. Чем меньше разность электроотрицательностей атомов, тем более проявляется ковалентная связь и менее - ионная. Даже в таком ‘‘идеальном‖ ионном соединении, как фторид франция, ионная связь составляет около 9394 %.
Если рассмотреть соединения элементов какого – либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи меняется на ковалентный. Например, у фторидов элементов 2 – ого периода в ряду LiF, BeF2, BF3, CF4, NF3, OF2, F2 ионная связь характерная для фторида лития, постепенно ослабевает и переходит в типично ковалентную связь в молекуле фтора.
Для однотипных молекул, например HF, HCl, HBr, HS (или H2O, H2S, H2Se), дипольный момент тем больше, чем
больше ЭО элементов (ЭОF > ЭОCl; ЭОО > ЭOS, Se). Образующиеся ионы можно представить в виде заряжен-
ных шаров, силовые поля которых равномерно распределяются во всех направлениях пространства (рис. 30). Каждый ион может притягивать к себе ионы противоположного знака по любому направлению. Иначе говоря, ионная связь в отличие от ковалентной характеризуется ненаправленностью.
99
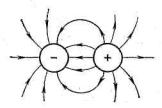
Рис. 30. Распределение электрических силовых полей двух разноименных ионов
В отличие от ковалентной связи ионная связь характеризуется еще и ненасыщенностью. Объясняется это тем, что образующиеся ионы способны притягивать большое количество ионов противоположного знака. Число притягивающихся ионов определяется относительными размерами взаимодействующих ионов. Вследствие ненаправленности и ненасыщаемости ионной связи, энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Таким образом, для ионных соединений понятие простых двухионных молекул типа NaCl, CsCl теряет смысл. Ионные соединения в обычных условиях представляют собой кристаллические вещества. Весь кристалл можно рассматривать как гигантскую молекулу, состоящую из ионов
Na n , Cl n и Cs n Cl n
Лишь в газообразном состоянии ионные соединения существуют в виде неассоциированных молекул типа NaCl и CsCl.
Ионная связь, как было показано выше, не является чисто ионной даже в типичных молекулах (CsF, F2F). Неполное разделение зарядов в ионных соединениях объясняется взаимной поляризацией ионов, т.е. влиянием их друг на друга. Поляризуемость – способность к деформации электронных оболочек в электрическом поле.
Это приводит к деформации электронных оболочек ионов. Наибольшее смещение испытывают при поляризации
100

электроны внешнего слоя, поэтому в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Поляризуемость различных ионов не-
одинакова
Li+ < Na+ < K+ < Rb+ < Cs+
Увеличение R иона, увеличение поляризуемости.
Точно также поляризуемость галогенов изменяется в сле-
дующей последовательности:
F- < Cl- < Br- < I-
Увеличение R иона, увеличение поляризуемости.
Чем меньше заряд иона, тем меньше его поляризуемость. Поляризующая способность ионов, т.е. их способность оказывать деформирующее воздействие на другие ионы зависит от заряда и размера ионов. Чем больше заряд иона и меньше его радиус, тем сильнее создаваемое им электрическое поле, следовательно, тем больше его поляризующая способность. Таким образом, анионы характеризуются (в сравнении с катионами) сильной поляризуемостью и слабой поляризующей способностью.
Рис. 31. Смещение электронного облака аниона в результате поляризации
101
Под действием электрических полей каждого иона внешняя электронная оболочка смещается в сторону противоположно заряженного иона. Действие электрических полей смещает и ядра атомов в противоположных направлениях. Под действием электрического поля катиона внешнее электронное облако аниона смещается. Происходит как бы обратный перенос части электронного заряда от аниона к катиону (рис. 31).
Таким образом, в результате поляризации электронные облака катиона и аниона оказываются не полностью разделенными и частично перекрываются, связь из чисто ионной превращается в сильнополярную ковалентную. Следовательно, ионная связь – предельный случай полярной ковалентной связи. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений. Поскольку с усилением поляризации возрастает степень ковалентности связи, то это сказывается на диссоциации солей в водных растворах. Так, хлорид BaCl2 принадлежит к сильным электролитам и в водных растворах практически полностью распадается на ионы, тогда как хлорид ртути HgCl2 почти не диссоциирует на ионы. Это объясняется сильным поляризующим действием иона Hg2+ радиус которого (1,1 Аº) заметно меньше радиуса иона Ba2+ (1,34 Аº)
Особенно высоким поляризующим действием обладает ион водорода, который может сближаться с анионом до близкого расстояния, внедряясь в его электронную оболочку и вызывая сильную ее деформацию. Так, радиус Cl- равен 1,81 Аº , а расстояние между ядрами атомов хлора и водорода в
HCl – 1,27 Аº.
3.9. Водородная связь
Общие понятия. Водородная связь – разновидность донорно – акцепторной связи, осуществляющаяся между молекулами различных веществ, в состав которых входит водород. Если молекулу такого вещества обозначить НХ, то взаимодействие за счет водородной связи можно выразить так
102
