
3350
.pdf
Рис. 33. Схема встречи рентгеновских лучей с плоскостями в кристалле кубической системы
Отношение обратных величин d100, d110 и d111 является характеристикой для данного типа кристаллической решетки:
1 : 1 : 1 =1: 
 2 :
2 : 
 3
3
d100 d110 d111
Это соотношение, постоянное для данной решетки, в конечном итоге определяет отношение расстояний на рентгенограмме кристалла (рис. 33).
Вторая важная характеристика любой элементарной ячейки - координационное число: координационным числом называется число одинаковых частиц, расположенных на кратчайшем расстоянии от данной частицы (число ближайших соседей). Для простого куба на кратчайшем расстоянии от частицы А равным а расположено 6 частиц, т.е. координационное число K = 6.
Другой характеристикой элементарной ячейки является число частиц, необходимое для ее построения. Каждая частица, находящаяся в вершине куба, принадлежит одновременно 8 кубам, сходящимся в одной точке (А), а, следовательно, на данный куб приходится только 1/8 ее часть. Вершин в кубе 8 и
113

для построения данного куба требуется только одна частица: n = (1/8) 8 = 1.
Зная число частиц, необходимых для построения элемента кристаллической решетки, массу этих частиц и плотность кристалла, можно определить сторону куба, а, следовательно, и значения d, входящих в уравнение Брэггов, а это в свою очередь было необходимо для определения длины волны λ рентгеновских лучей, получаемых от различных антикатодов. Если бы этого не было сделано, то Мозли не смог бы открыть свой закон.
В самом деле, зная систему кристаллической решетки и элементарной ячейки, число частиц, необходимое для построения, их массы и плотность кристалла, можно определить все геометрические размеры. Для кубических форм элементарных ячеек эта задача решается наиболее просто.
Если число частиц n, а масса их A/N, где А - атомная масса, а N - число Авогадро, то масса элементарной ячейки будет m = nA/N. Объем элементарной ячейки выразим через плотность кристалла ρ, и он будет равен кубу стороны:
υ = (nA/ρN) = a3. Отсюда величина ребра куба
nA a= 3 N
Элементарный куб - тип NaCl, n = l; K = 6, но так как в узлах элементарной ячейки находятся ионы Na+ и ионы Сl-, то это необходимо учесть: n = (l/8) 4Na++ (l/8) 4Cl- = (l/2) NaCl,
т.е. требуется половина молекулы для построения ячейки
a = 3 М NaCl
2 N
Плотность кристалла NaCl ρ = 2,164·103 кг/см3; MNaCl = 58,5 кг/кмоль; число Авогадро N = 6,02·1026кмоль-1. Подставля-
ем данные в уравнение и получаем
114

a 3 |
|
|
58,5кг кмоль 1 |
|
|
2,814 10 10 |
м =2,814 Ǻ |
|
2,164 103 кг м 3 6,02 1026 |
кмоль 1 |
|
||||
2 |
|
|
|
||||
Объемноцентрированный куб - тип CsCl. В этом случае
К = 8; n = (1/8) 8+1 = 2. При построении ячейки также нужно учесть, что в узлах элементарной ячейки находятся ионы Cs+ и Сl-. Тогда Cs+ + Cl- = CsCl или уравнение для этого случая будет
а = 3 |
М CsCl |
|
N |
||
|
4.3. Виды элементарных ячеек
Частицами, из которых построены элементарные ячейки, могут быть атомы, молекулы, ионы и атомы металлов, связанные между собой металлической связью. Мы различаем следующие типы кристаллических решеток: атомные, молекулярные, ионные и металлические.
Атомные решетки построены из атомов, связанных между собой ковалентными неполярными связями. Эти химические связи определяют геометрию кристаллов и энергию кристаллической решетки, которая характеризует прочность и устойчивость данного кристалла. Так как строение атома периодично, то, казалось бы, и строение кристаллов тоже должно быть периодичным, но это выполняется не строго, поскольку атомы могут перестраивать свои орбитали при различных степенях возбуждения и таким образом изменять свои химические связи. Это ведет к образованию различных форм кристаллов - полиморфизму или аллотропическим модификациям у данного элемента. У его электронных аналогов, находящихся в разных периодах, возможно возникновение других форм связи за счет наличия другого числа свободных орбиталей.
Координационное число атомной решетки должно зависеть от распределения электронов внешнего уровня и количе-
115

ства валентных орбиталей. Это хорошо учитывает правило Юм-Розери, которое можно представить следующим образом:
K = 8 - N,
где К - координационное число, N - номер группы в периодической системе Д. И. Менделеева. Так, например, кристаллы иода, находящегося в VII группе и имеющего электронную формулу s2p5 по Юм-Розери, должны иметь координационное число, равное 1.
В действительности кристаллы иода состоят из отдельных молекул - I2, связанных между собой межмолекулярными силами. Кристаллы иода очень непрочны и легко при нагревании переходят в пар (сублимация), состоящий из молекул I2. По существу, кристаллы, иода следует отнести к молекулярным кристаллам.
Кристаллы кислорода, которые по правилу 8 - N имеют К = 2, представляют собой цепочечные структуры, а сера, атомы которой имеют свободные орбитали и могут возбуждаться, дает уже две аллотропические формы - моноклиническую и ромбоэдрическую серу, кристаллы которых образованы за счет дополнительных связей. Однако сера имеет и другие кристаллические формы, образованные цепочками из атомов серы, подобно кислородным.
Рис. 34. Кристаллические структуры фосфора
Кристаллы азота с координационным числом 3 (К = 8 - 5) тоже очень непрочные (tплавл = - 209,86 С°), а его электронный
116

аналог фосфор образует или молекулярную решетку из молекул Р4, в которой сохраняется координационное число 3 (рис. 34, а), - белый фосфор, или образует красный фосфор переменной структуры и только при особых условиях (200 °С и 12 000 атм.) образует черный фосфор Бриджмена, также имеющий слоистую структуру с координационным числом 3. Структура черного фосфора показана на рис. 34, б.
Наиболее типичными атомными кристаллами являются кристаллы алмаза. Так кристаллизуется углерод; его атомы находятся в состоянии s1p3 и орбитали их полностью гибридизированы. Координационное число кристалла алмаза 4, что также соответствует правилу Юм-Розери. Кристаллическая решетка алмаза представляет собой центрированный тетраэдр, который можно отнести к кубической системе, так как он вписывается в куб, а макроформа кристаллов алмаза представляет собой модифицированный куб.
Элементарная ячейка алмаза довольно сложна. Она представляет собой гранецентрированный куб, в который еще дополнительно вписано 4 атома углерода. Число частиц, необходимое для построения такой элементарной ячейки, n = (1/8)
117

Рис. 35. Элементарная ячейка алмаза: а - гибридные орбитали; б - тетраэдр; в - тетраэдр вписанный в куб; г - элементарная ячейка алмаза
8 + (1/2) 6 + 4 = 8. Координационное число 4, так как в данном случае оно равно числу гибридных орбиталей атома углерода. Формы гибридных орбиталей, связи между углеродными атомами в кристалле алмаза и элементарная ячейка алмаза приведены на рис. 35, а, б, в, г.
Однако кроме алмаза, обладающего наибольшей твердостью из всех твердых тел (за счет очень малых межатомных расстояний - 1,54 Ǻ), углерод образует кристаллы графита. В его решетку входят тоже возбужденные атомы углерода, но, с неполностью гибридизированными орбиталями, вследствие чего расстояния между атомами в кристаллической решетке графита (в плоскости и межплоскостном расстоянии) различны и в результате графит оказывается очень мягким, легко скалывающимся по плоскостям спайности. Графит применяется в машинах как высокотемпературная смазка, в то время как алмазные резцы обрабатывают самые твердые материалы.
Неполностью гибридизированный атом углерода и кристаллическая решетка графита приведены на рис. 36.
Кристаллы графита более устойчивы, чем кристаллы алмаза, которые при нагревании около 1000 °С (без доступа
118
воздуха) переходят в графит. Кристаллы графита проводят
электрический ток по типу полупроводников d < 0, так как dT
не все связи между атомами углерода строго локализованы и миграция связей создает условия полупроводимости.
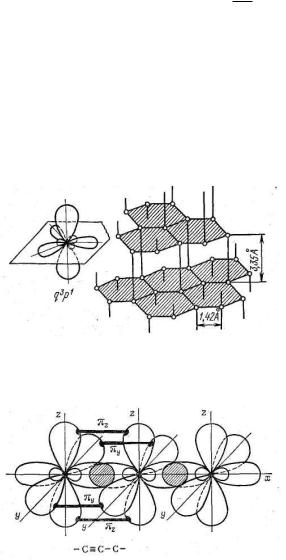
Третья кристаллическая модификация углерода - карбин - образует гексагональную решетку из цепочек, образованных атомами углерода. Расстояние между атомами углерода в карбине очень мало (1,284 А). Карбин обладает также полупроводниковыми свойствами. Схема цепочки атомов углерода в карбине показана на рис. 37.
Рис. 36. Кристаллическая структура графита
Рис. 37. Цепочная структура кристаллов карбина
119

Четвертая кристаллическая модификация углерода – фуллерен. Он был экспериментально открыт в 1985 г. и является частицей состоящей из 60 атомов углерода с массой 12 атомных единиц каждый (С60). Схема молекулы показана на рис. 38
Она имеет 12 пентагональных (пятиугольных) и 20 гексагональных (шестиугольных) симметрично расположенных граней, образующих форму, близкую к шару. На самом деле, геометрия молекулы фуллерена ближе к форме футбольного мяча, также состоящего из пяти- и шестигранных фасеток. Эти шарообразные молекулы могут соединяться друг с другом в твердом теле с образованием гранецентрированной (ГЦК) кристаллической решетки, показанной на рис. 39.
Рис. 38. Структура молекулы фуллерена С60
Рис. 39. Элементарная ячейка кристаллической решетки фуллерена С60 (большие шары), легированного щелочными атомами (темные кружки)
120

Расстояние между центрами ближайших молекул в гранецентрированной решетке, удерживаемых слабыми Ван дер Ваальсовыми силами, имеет наноразмеры (около 1 нм). Поскольку С60 растворим в бензоле, его монокристалл можно вырастить при медленном выпаривании раствора С60 в бензоле.
Наиболее интересными наноструктурами с широким потенциалом применения являются углеродные нанотрубки. Углеродную нанотрубку можно представить себе как лист графита, свернутый в цилиндр. На рис. 40 показано несколько возможных структур, образованных сворачиванием графитового листа вокруг разных осей. Однослойная нанотрубка может иметь диаметр 2 нм и длину 100 микрон, что делает ее квазиодномерной структурой, способной служить нанопроволокой.
Рис. 40. Примеры некоторых из возможных структур углеродных нанотрубок, зависящих от способа сворачивания графитового листа: (а)- кресельская структура,
(б)- зигзагообразная структура, (в)- хиральная структура
Углеродные нанотрубки можно получить лазерным испарением, углеродной дугой и химическим осаждением паров. На рис. 41. показана установка для производства нанотрубок
121
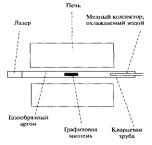
лазерным испарением. Кварцевая трубка, содержащая газообразный аргон и мишень из графита, нагревается до 1200 °С.
Рис. 41. Экспериментальная установка для синтеза углеродных нанотрубок лазерным испарением
Внутри трубки, но за пределами печи находится охлаждаемый водой медный коллектор. Графитовая мишень содержит небольшие количества кобальта и никеля, выступающие в качестве каталитических зародышей образования нанотрубок. При попадании высокоинтенсивного пучка импульсного лазера на мишень графит испаряется. Поток аргона выносит атомы углерода из высокотемпературной зоны к охлаждаемому медному коллектору, на котором происходит образование нанотрубок. Таким методом можно получить трубки диаметром 10 - 20 нм и длиной 100 микрон.
Нанотрубки можно синтезировать, используя и углеродную дугу. К электродам из углерода диаметром 5-20 мм, разнесенным на расстояние около 1 мм, в потоке гелия при давлении 500 Торр прикладывается напряжение 20-25 В. Атомы углерода вылетают из положительного электрода и образуют нанотрубки на отрицательном, при этом длина положительного электрода уменьшается, а на отрицательном электроде осаждается углеродный материал. Для получения однослойных нанотрубок в центральную область положительного электрода добавляют небольшие количества кобальта, никеля и железа в
122
