
3350
.pdfСродство к электрону. Сродством к электрону называют количество энергии, выделяемой нейтральным газообразным атомом, находящимся в состоянии с наименьшей э н е р г и е й , к о г д а о н присоединяет один электрон, т.е. энергию процесса Х + ē →X -. Элементы VII группы обладают особенно большой величиной сродства к электрону, поскольку они имеют тенденцию приобретать устойчивую конфигурацию благородных газов, которая характеризуется 8 электронами на внешней оболочке. Так, например, энергия сродства к электрону атома кислорода равна 1,47 эВ, фтора - 3,52 эВ, а водорода - элемента 1 группы - 0,75 эВ. В общем случае самые большие величины сродства к электрону соответствуют элементам, находящимся справа в периодической системе.
Электроотрицательность. Одним из важнейших свойств атомов является электроотрицательность (ЭО). Мерой ЭО по Малликену служит арифметическая сумма энергий ионизации и сродства к электрону: ЭО = I + Е, где I - энергия ионизации, Е - энергия сродства к электрону.
Чаще пользуются относительной электроотрицательностью по Полингу; ее обозначают ОЭО. Самая большая ОЭО у фтора 4,0. ОЭО имеет смысл оценивать для неметаллических элементов. У элементов, расположенных в одном периоде, ОЭО возрастает слева направо. У элементов, расположенных в одной группе ОЭО наиболее выражена у стоящего выше элемента.
2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
Не только свойства элементов, но и их соединений находятся в периодической зависимости от радиуса атома и заряда ядра.
При рассмотрении свойств и форм соединений элементов часто пользуются упрощенной схемой, предложенной Косселем.
53
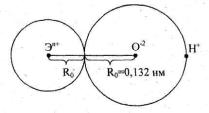
Она изображает группировку атомов Э-О-Н, где Э - атом элемента, О - атом кислорода, Н - атом водорода. Ионы Эn+ и О-2 представлены в виде сфер, радиусы которых соответствуют радиусам ионов. Направление диссоциации соединения, содержащую группировку атомов Э-О-Н, зависит от относительной прочности связей Э-О и О-Н.
Если прочнее связь Э-О, то при диссоциации разрывается связь О-Н и соединение выступает в роли кислоты. Если прочнее связь О-Н, то вещество ведет себя как основание. Если связи Э-О и О-Н приблизительно одинаковы, прочны, то соединение является амфотерным.
Согласно схеме Косселя увеличение степени окисления элемента и уменьшения радиуса иона элемента приводит к упрочнению связи Э-О и, следовательно, усилению кислотного характера соединения.
В периоде слева направо основной характер оксидов и гидроксидов постепенно ослабляется, переходя в амфотерный, а затем в кислотный, усиливающийся к концу периодов. Так,
например, в ряду (III период) NaOH, Mg(OH)2, Al(OH)3, H2SiO3,
H3PO4, H2SO4, HClO4 слева направо наблюдается усиление кислотных свойств гидроксидов.
Это отвечает и тому факту, что NaOH – сильное основание, Mg(OH)2 – основание средней силы, а Al(OH)3 – амфотерная гидроокись. Это объясняется уменьшением радиуса ионов слева направо в периоде, упрочнением связи Э-О и усилением кислотных свойств гидроксидов. Общий характер изменения остается и для других периодов.
54
В группах сверху вниз усиливается основной характер оксидов и гидроксидов и ослабевается кислотный характер, что объясняется увеличением радиуса ионов и ослаблением связи Э - О. Например, в группе 1 А все элементы образуют основные оксиды и гидроксиды, но наиболее резко основной характер выражен у элемента франция. Эта особенность проявляется и на химическом сродстве.
Атомы Си, Аg и Аи, составляющие побочную 1 Б подгруппу имеют также на внешнем уровне 1 электрон (ns1). Но однозарядные ионы этих металлов меньше ионов щелочных металлов. Поэтому у них связь Э - О прочнее, чем в соединениях главной подгруппы. Действительно, их гидроксиды – слабые основания.
Эта закономерность сохраняется по мере перехода к группам с большим номером, при этом возрастает отношение к проявлению различных степеней окисления. Для элементов, например, IV А группы характерны две степени окисления +2 и +4. При переходе от углерода к свинцу степень окисления +2 становится все более характерной, в связи, с чем растет и устойчивость веществ, содержащих Э2+. Для углерода и кремния степень окисления +2 проявляется в очень небольшом количестве соединений (CO, SiO); для них характерна степень окисления +4. Ge(OH)2, Sn(OH)2 и Pb(OH)2 – амфотерные соединения; их основные свойства усиливаются от Ge к Pb; у Pb(OH)2 преобладает основная ионизация, а у Ge(OH)2 – кислотная.
Так как RЭ 4 < RЭ 2 то связь Э+4 – О прочнее связи Э+2 –
О. Поэтому содержащие группу Э+4 – О – Н проявляют кислотные свойства в большей степени. Углерод в степени +4 образует угольную кислоту Н2СО3, это очень слабая кислота. Еще более слабыми кислотами являются H2GeO3, H2SiO3,
H2SnO3 и H2PbO3.
Для элементов IV группы (Ti, Zr, Hg) характерной степенью окисления также является +4. Соединения Э(ОН)4 – амфотерны, их кислотные свойства при переходе от титана к гафнию ослабевают.
55
Для элементов VI группы характерной является степень окисления +6.
В ряду H2SO4, H2SeO4, H2TeO4 слева направо R- ионов растет, связь Э – О ослабевает, и усиливаются основные свойства гидроксидов. Поэтому наиболее сильной кислотой является серная.
Изменение кислотно-основных свойств оксидов в зависимости от степени окисления можно показать на примере одного элемента, так в ряду MnO – Mn2O3 – MnO2 – MnO3 – Mn2O7 основные свойства ослабевают.
Связь Э – О с увеличением степени окисления упрочняется, и таким образом, усиливаются кислотные свойства гидроксидов.
Оксиду MnO соответствует основание, MnO2 проявляет амфотерные свойства, как и его гидроксид – Mn(OH)4 или H2MnO3, а оксиды MnO3 и Mn2O7 проявляют кислотные свойства и им соответствуют кислоты H2MnO4 и HMnO4.
Следует отметить, что рассмотренная выше закономерность изменения кислотно-основных свойств оксидов и гидроксидов наиболее полно проявляется у элементов главных подгрупп; у элементов Б подгрупп она иногда осложняется влиянием побочных факторов.
Приведенные выше данные подтверждают периодичность изменения свойств элементов и их соединений. Периодический закон, таким образом, свел накопленный химиками прошлого огромный, но разнообразный фактический материал в строгую систему. Процесс упорядочения полученных наукой сведений на основе периодического закона интенсивно происходит и в настоящее время.
Периодический закон и периодическая система является основой современной неорганической химии. Они относятся к числу таких общих научных закономерностей, которые реально существуют в природе и поэтому в процессе эволюции наших знаний никогда не потеряют своего значения.
56
Глава 3. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
3.1. Развитие теории химической связи
Центральная проблема современной химии – учение о химической связи. Знание природы взаимодействия атомов в веществе позволяет понять причины многообразия химических соединений строения и механизм их образования.
Одновременно с развитием теории строения атомов развивалась и теория химической связи. В 1800 году Бертолле выдвинул гравитационную теорию, согласно которой химические силы возникают за счет взаимодействия масс, т.е. в результате гравитационного взаимодействия. И хотя эти силы нельзя отрицать, они не являются причиной химического взаимодействия, роль их ничтожно мала по сравнению с другими силами, приводящими к химическому взаимодействию.
В 1812 году шведским ученым Берцелиусом была предложена электрохимическая теория химической связи, согласно которой все атомы обладают положительным и отрицательным полюсами, причем у одних атомов преобладает положительный полюс, а у других – отрицательный. Атомы, у которых преобладают противоположные полюсы, притягиваются друг к другу. К электроположительным были отнесены атомы металлов, электроотрицательными являлись атомы неметаллов. Однако электрохимическая теория противоречила ряду фактов. Так, например, оставалось необъяснимым образование молекул, состоящих из одинаковых атомов (Н2, О2, Cl2 и др.), которые обладали одноименными зарядами. По этой причине теория Берцелиуса перестала пользоваться признанием. Большой вклад в науку химической связи внес выдающий русский химик А.М. Бутлеров. В 1861 году он выдвинул теорию химического строения молекул. Основные положения этой теории сводятся к тому, что все атомы в молекуле соединены друг с другом в определенной последовательности, что валентность
57
атомов стремится к насыщению и определяется числом химических связей, что свойства веществ зависят не только от их качественного и количественного состава, но и от их химического строения. Бутлеров предложил метод изображения молекул – структурные формулы - и показал, что атомы в молекуле могут влиять друг на друга. Теория А.М. Бутлерова получила дальнейшее подтверждение и развитие и является одним из фундаментальных законов современной химии. Однако в его теории не была вскрыта природа химической связи.
С открытием электрона и созданием в дальнейшем планетарной модели строения атома, а также теории, разработанной Нильсом Бором, возникают новые теории химической связи. Первое электронное представление о химической связи появилось в 1916 году, которое было предложено американским физико - химиком Льюисом. Он высказал предположение о том, что химическая связь имеет электрическую природу и возникает путем образования электронной пары, одновременно принадлежащей двум атомам. Эту связь назвали ковалент-
ной.
Втом же 1916 году немецкий ученый Коссель предположил, что при взаимодействии двух атомов один из них отдает,
адругой принимает электроны, при этом первый атом превращается в положительно заряженный, а второй - в отрицательно заряженный ионы. Химическая связь осуществляется за счет электростатического притяжения ионов. На основе идей Косселя сформировались представления об ионной связи.
Всоответствии с современными представлениями о строении атома можно говорить лишь о вероятности нахождения электронов в поле атомных ядер. Данному пространственному положению атомных ядер отвечает определенное распределение электронной плотности. Выяснить, как распределяется электронная плотность по сути дела и означает описать химическую связь в веществе, но для этого, как известно, необхо-
димо точное решение уравнения Шредингера, что пока осуществимо только для иона водорода (Н2+), состоящего из двух
58
протонов и одного электрона, а также для водородоподобных частиц (He2+, Li2+). Для систем с двумя и большим числом электронов приходится применять приближенные решения.
Точность приближенных расчетов оценивается мерой их совпадения с экспериментально полученными сведениями о строении вещества и его свойствах.
3.2. Ковалентная связь. Кривая потенциальной энергии
Химическая связь образуется только в том случае, если при сближении атомов (двух или большего числа) полная энергия системы (сумма кинетической и потенциальной энергии) понижается.
Важнейшие сведения о строении молекул дает изучение зависимости потенциальной энергии системы от расстояния между составляющими ее атомами. Впервые эту зависимость изучили в 1927 году немецкие ученые У. Гейтлер и Ф. Лондон, исследуя причины возникновения химической связи в молекуле водорода. Используя уравнение Шредингера, они пришли к выводу, что энергия системы, состоящей в молекуле водорода из двух ядер и двух электронов, может быть выражена следующим образом:
Е = ~ К О,
где К – кулоновский интеграл, включающий все электростатические взаимодействия, т.е. отталкивание между электронами, отталкивания между ядрами, а так же притяжение электронов к ядрам атомов. О – обменный интеграл, он характеризует возникновение электронной пары и обусловлен движением электронов вокруг обоих ядер водорода. Этот интеграл имеет очень большое отрицательное значение. Таким образом, по расчетам, энергия данной системы может принимать два значения:
Е = ~К + О и Е = ~К - О
59
Следовательно, существуют такие состояния электронов, при взаимодействии которых энергия системы может изменяться в пределах 0 < E < 0.
Первое уравнение соответствует уменьшению энергии системы Е < 0.
Второе уравнение соответствует увеличению энергии системы Е > 0.
Условию уменьшения энергии системы удовлетворяет ― ‖- функция, определяющая состояние взаимодействующих электронов с противоположно направленными (антипараллельными) спинами. Эта ― ‖ - функция называется симметричной ― ‖ - функцией.
Отсюда следует вывод - химическая связь между атомами должна возникать только в том случае, если электроны, принадлежащие различным атомам, имеют противоположно направленные спины. Лишь при этом условии энергия молекулярной системы будет меньше энергии атомных систем, т.е. образуется устойчивая молекула. Следовательно, антипараллельность спинов электронов взаимодействующих атомов является необходимым условием образования ковалентной связи.
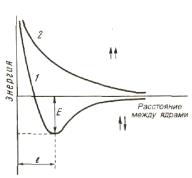
Рис. 8. Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами
60
При сближении двух атомов, если спины электронов параллельны, то суммарная их энергия увеличивается, между атомами возникает и возрастает сила отталкивания (рис.8).
При противоположно направленных спинах сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы.
При r = r0 система обладает наименьшей энергией, т.е. находится в наиболее устойчивом состоянии, характеризующимся образованием молекул водорода Н2. При дальнейшем сближении атомов энергия резко возрастает.
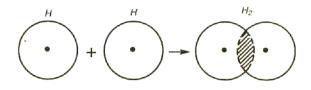
Возникновение молекулы Н2 из атомов можно объяснить перекрыванием атомных электронных облаков с образованием молекулярного облака, которое окружает два положительно заряженных ядра.
Рис. 9. Перекрывание электронных облаков при образовании молекулы водорода
В месте перекрывания электронных облаков (т.е. в пространстве между ядрами) электронная плотность связующего облака максимальна (рис.9). Иначе говоря, вероятность пребывания электронов в пространстве между ядрами больше, чем в других местах. Благодаря этому возникают силы притяжения между положительным зарядом ядра и отрицательными зарядами электронов и ядра сближаются – расстояние между ядрами водорода в молекуле Н2 заметно меньше (0,74 Å) суммы радиусов двух свободных атомов водорода (1,06 Å)
61

Связь, образующаяся в результате обобщения электронных плотностей взаимодействующих атомов получила назва-
ние ковалентной.
Согласно квантово - механическим представлениям взаимодействие атомов может привести к образованию молекулы только при условии, что спины электронов сближающихся атомов с противоположно направленными спинами. При сближении электронов с параллельными спинами действуют только силы отталкивания.
Н + Н →Н 
 Н → Н2
Н → Н2
+1/2 -1/2
Поскольку точное решение уравнения Шредингера для атомно-молекулярных систем невозможно, возникли различные приближенные методы расчета волновой функции, а следовательно распределения электронной плотности в молекуле. Наиболее широкое распространение получили два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В развитии первого метода особая заслуга принадлежит Гейтлеру и Лондону, Слетеру и Полингу. Развитие второго метода связано в основном с именами Малликена и Хунда.
Основные положения метода ВС. 1) Ковалентная хими-
ческая связь образуется двумя электронами с противоположно направленными спинами, при чем эта электронная пара принадлежит двум атомам.
2)При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в межъядерном пространстве увеличивается электронная плотность, что приводит к уменьшению энергии системы.
3)Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в таком направлении, при котором это перекрытие максимально.
Этот метод дает обоснование обозначению с помощью черточки химической связи в структурных формулах соединений.
62
