
3350
.pdf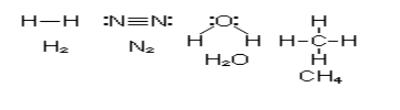
Таким образом, в представлении метода ВС химическая связь локализована между двумя атомами, т.е. она двухцентровая и двухэлектронная.
3.3. Основные количественные характеристики ковалентной связи
Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, следовательно, при образовании химической связи всегда выделяется энергия. Количество энергии, выделяющейся при образовании химической связи, называется энергией образования связи. Так как при образовании химической связи энергия системы понижается, то энергия образования связи имеет отрицательный знак (Есв. < 0). Для разрыва связи необходимо затратить энергию. Ее называют энергией разрыва связи. Энергия разрыва связи по величине равна энергии образования связи, но имеет положительный знак, поскольку при разрыве связи энергия системы возрастает (Еразр.св. > 0). Энергия связи является важнейшей характеристикой связи, определяющей ее прочность (табл. 6, А).
Для двух и многоатомных молекул с одинаковым типом связи рассчитывают среднюю энергию связи. Величину средней энергии связи определяют делением энергии образования молекулы из атомов на число связей. Например, энергия образования молекулы метана CH4 при 298 К равна 1664 кДж/Моль. Соответственно средняя энергия связи C – H равна
1664 / 4 = 416 кДж/моль.
63
Таблица 6
А. Энергия простых связей (кДж/моль)
|
H |
C |
N |
O |
F |
Cl |
Br |
I |
H |
436 |
416 |
391 |
467 |
566 |
431 |
366 |
299 |
C |
|
356 |
285 |
336 |
485 |
327 |
285 |
213 |
N |
|
|
160 |
201 |
272 |
193 |
- |
- |
F |
|
|
|
|
158 |
255 |
238 |
- |
Cl |
|
|
|
|
|
242 |
217 |
209 |
Б. Энергия кратных связей
|
C=N |
C=O |
N=N |
C=C |
C=N |
C=O |
N N |
C=C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
598 |
616 |
695 |
418 |
813 |
866 |
1073 |
946 |
Длиной химической связи называется расстояние между ядрами атомов в молекуле. Ее определяют экспериментально, при помощи молекулярной спектроскопии, дифракции рентгеновских лучей и др. Длины связей определяются размером реагирующих атомов и степенью перекрытия их электронных облаков, например, длины связей в молекуле галоидводородов
HX равны (нм): H - F 0,092; H - Cl 0,128; H - Br 0,142; H-I 0,162. Таким образом, по мере увеличения атомного номера галогена и соответственно размера его атома длина химической связи с водородом возрастает, а ее прочность уменьшается.
3.4. Квантово – механическая теория валентности
Валентность – это способность химического элемента к образованию химических связей. Согласно методу ВС числен-
64
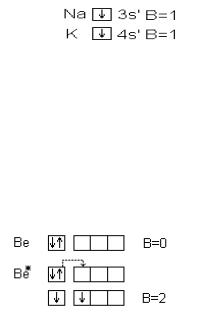
ное значение валентности соответствует числу ковалентных связей, которые образуют атом.
Поскольку пребывание двух электронов с противоположными спинами в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра, поэтому в образовании ковалентных связей принимают участие все одноэлектронные облака. Таким образом, согласно обменному механизму метода ВС, валентность элементов определяется числом содержащихся в атоме непарных электронов. Для s- и p- элементов это электроны внешнего уровня, для d- элементов – внешнего и предвнешнего уровней. Например, валентность элементов I A группы равна 1, т.к. на внешнем уровне атомы этих элементов имеют 1 электрон.
В некоторых случаях число непарных электронов увеличивается в результате возбуждения атома, при котором двухэлектронные облака распадаются на одноэлектронные. Например, валентность элементов II A группы в невозбужденном состоянии равны нулю, а при возбуждении этих атомов p- электроны распариваются и один из электронов переходит в свободную p- ячейку.
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум для кислорода и единицы для
65
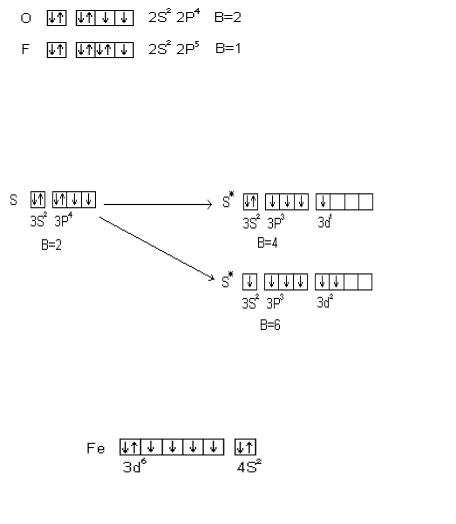
фтора. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет свободных орбиталей:
В то же время сера – аналог кислорода – проявляет переменную валентность 2, 4, 6; хлор – аналог фтора – проявляет валентность 1, 3, 5, 7. Это объясняется наличием свободных АО на третьем энергетическом уровне; например у серы.
Для большинства d- элементов валентность в невозбужденном состоянии равна нулю, так как на внешнем уровне непарных электронов. Например, для железа
B = 0
При возбуждении атома железа s- электроны разъединяются и переходят на свободный p- подуровень четвертого уровня и валентность становится равной двум.
66
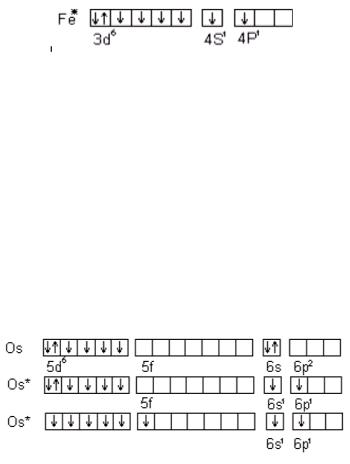
B = 6
Кроме внешних валентными могут быть непарные d- электроны предвнешнего уровня, и валентность атома железа с учетом d- электронов может быть равна 3, 4, 5, а максимально 6. Переход электронов при возбуждении атома возможен лишь внутри одного главного числа. Для перехода электрона с одного уровня на другой требуется очень большая энергия, поэтому такие переходы практически не осуществляются. Например, аналогом железа является осмий, который в отличие от него может проявлять максимальную валентность равную восьми за счет перехода электронов в пределах одного пятого уровня:
B = 8
При возбуждении атома Os s- электроны переходят на свободный p- подуровень шестого уровня, валентность становится равной двум. Неспаренные d- электроны увеличивают ее до шести. Кроме того, спаренные d- электроны имеют возможность разъединяться и переходить на свободный f- подуровень пятого уровня, тогда максимальная валентность осьмия становится равной восьми.
67
3.5. Донорно – акцепторный механизм образования ковалентной связи
Рассмотренный механизм возникновения ковалентных связей путем обобщения непарных электронов двух атомов, получил название ―обменного механизма‖. Образование ковалентной связи может происходить также при взаимодействии одного атома или иона с заполненной атомной орбиталью с другим атомом или ионом, имеющим вакантную (свободную) орбиталь. Такой механизм образования ковалентной связи называется донорно-акцепторным. Атом или ион, поставляющий пару электронов, называется донором, а атом или ион, к которому эта пара электронов перемещается – акцептором. Согласно методу ВС ковалентная связь по донорно-акцепторному механизму возникает при перекрывании орбитали одного атома или иона с заполненными орбиталями донора или донорной группы. Поэтому донорная группа должна содержать по меньшей мере одну неподеленную пару электронов. Например, образование молекулы H2 по донорно-акцепторному механизму можно представить следующим образом:
H- + H+→ H 
 H
H
1S - AO первого иона-протона H+ свободна, что условно обозначается 

У второго иона (гидрид ион H-) имеется два электрона и его электронная конфигурация 1s2. Ядро гидрид - иона окружает двухэлектронное облако с антипараллельными спинами электронов. При сближении ионов двухэлектронное облако гидрид - иона притягивается к протону и в конечном счете становится общим для обеих ядер водорода, т.е. превращается в двухэлектронное молекулярное облако. В данном примере донор – гидрид-ион H- , акцептор – протон H+
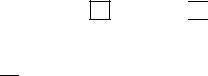
В соответствии с двумя механизмами образования ковалентной связи, рассмотрим валентные возможности атомов бо-
68
ра, углерода и азота. Это элементы второго периода и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего уровня: одной 2s и трем 2p:
Поскольку у бора и углерода имеются энергетически близкие свободные 2p орбитали, при возбуждении эти элементы могут приобретать новые электронные конфигурации:
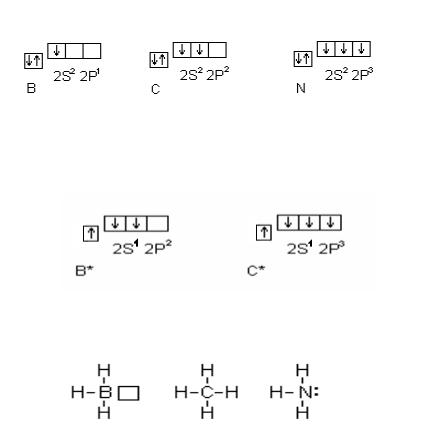
Всоответствии с числом непарных электронов атомы B, C и N могут образовывать соответственно 3, 4, 3 ковалентные связи, например с атомами водорода:
Вмолекуле BH3 дефицит электронов – атом бора имеет свободную орбиталь. В молекуле же NH3 при атоме азота имеется неподеленная, или, как говорят, несвязывающая элек-
тронная пара. Таким образом, молекула BH3 может выступать как акцептор электронной пары, а молекула NH3 – как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму. Простей-
69
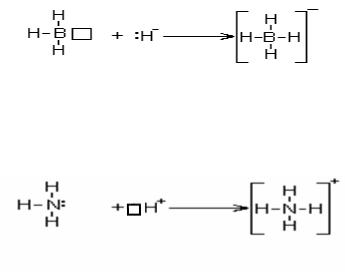
ший донор электронной пары – гидрид-ион H-. Присоединение отрицательного гидрид иона к молекуле BH3 приводит к образованию сложного (комплексного) иона BH4- с отрицательным зарядом:
Простейший акцептор электронной пары – протон; его присоединение к молекуле NH3 тоже приводит к образованию комплексного иона NH4+ , но уже с положительным зарядом:
В этих соединениях атомы бора и азота четырехвалентны. Таким образом, валентность элемента в общем случае определяется числом орбиталей, использованных при образовании химической связи. У элементов 2-го периода имеются 4 валентных орбитали, поэтому максимально возможное число ковалентных связей равно четырем. У элементов 3-его и последующих периодов роль валентных могут играть также внешние d- орбитали и f- орбитали.
3.6. Свойства ковалентной связи
Особенностью ковалентной химической связи является ее насыщаемость, направленность и полярность.
Насыщаемость связи. Из приведенных выше примеров следует, что молекулы существуют в устойчивом состоянии
70
строго определенного состава H2, CH4, BF3, BH4-, BH3 и т.д., но не H3, CH5 и т.д. Таким образом, при образовании ковалентной связи происходит ее насыщение. Объяснить это можно следующим образом: пара электронов (H2, CH4) образующих связь всегда будут отталкивать неспаренный электрон приближающегося третьего атома, т.к. в электронной паре (H2) представлены обе возможности ориентации спина. Кроме того, насыщаемость ковалентной связи можно объяснить тем, что для образования химической связи необходимо оптимальное накопление электронной плотности между ядрами, а ее избыток или недостаток приводит к повышению полной энергии системы.
Направленность связи. Наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определенную форму, то их максимальное перекрывание возможно при определенной пространственной ориентации. Направленность – важнейшее свойство ковалентной связи, зависящее от типа взаимодействующих электронов и числа атомов. Направленность связи объясняется тем, что электронные облака различной формы имеют определенное пространственное направление. s – облако имеет форму сферы, p – облако – форму гантели, расположенные вдоль трех осей (px py pz).
, и - связи. В зависимости от направления перекрывания атомных орбиталей различают , и - связи.
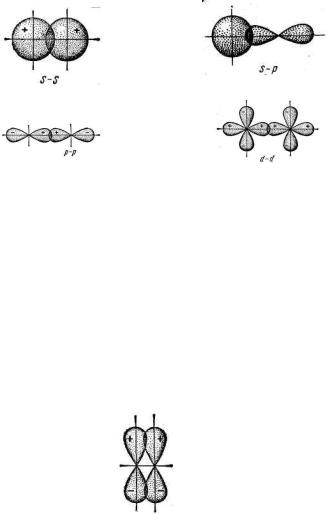
- связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов. Простейший случай - связи наблюдается у молекулы H2, образуется за счет перекрывания s – орбиталей атомов водорода (рис. 10, а); - связь может возникнуть также при перекрывании s и p – орбиталей (б); двух p – орбиталей (в); двух d – орбиталей (г); d и s – орбиталей; d и p – орбиталей
71
а |
б |
в |
г |
Рис. 10. Схема перекрывания орбиталей при образовании - связи
- связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух p – орбиталей, расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания (рис. 11). Соответственно - связь характеризуется двумя областями перекрывания, расположенными по обе стороны, соединяющей ядра атомов.
Рис. 11. Схема перекрывания p – орбиталей при образовании - связи
72
