
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
Контрольные вопросы
1. Что такое дисперсные системы? Из каких компонентов они состоят?
2. Что такое суспензии и эмульсии?
3. Как называются частицы дисперсной фазы в коллоидных растворах?
4. Как образуется мицелла?
5. Что такое коагуляция и чем она вызывается?
1.8. Окислительно-восстановительные реакции
Химические реакции, протекающие с изменением степени окисления атомов в молекулах реагирующих веществ, называются окислительно-восстановительными.
Например:
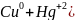
Такая
реакция является окислительно-восстановительной,
так как в процессе реакции атомы меди
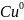 и ртути
и ртути
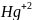 изменяют свои степени окисления на
изменяют свои степени окисления на
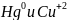 .
.
В окислительно-восстановительных реакциях происходит переход электронов от атомов одного элемента к атомам другого элемента.
Процесс отдачи электронов называется окислением. При окислении происходит повышение степени окисления элемента.
Например:
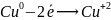
Процесс присоединения электронов называется — восстановлением. При восстановлении происходит понижение степени окисления элемента.
Например:
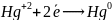
Уравнения выражающие процессы окисления и восстановления, называются — электронными уравнениями.
Восстановителями называются атомы, молекулы или ионы, которые в процессе окисления отдают электроны. Так, в нашем примере атомы меди являются восстановителями.
Окислителями называются атомы, молекулы или ионы, которые в процессе восстановления присоединяют электроны. Ионы ртути, в нашем случае, являются окислителями.
По окислительно-восстановительным свойствам все вещества можно разделить на три группы:
1. Вещества, которые могут быть только окислителями. В таких веществах элементы, изменяющие свою степень окисления, находятся в высшей степени окисления (см. табл. 1).
Таблица 1
Важнейшие окислители
Элемент |
Высшая степень окисления |
Вещества-окислители (примеры) |
N |
+5 |
HNO3 |
Mn |
+7 |
KMnO4, HMnO4 |
Cr |
+6 |
K2Cr2O7, CrO3 |
Pb |
+4 |
PbO2 |
F |
0 |
F2 |
Bi |
+5 |
HBiO3 |
S |
+6 |
H2SO4 (концентрир.) |
Атомы, имеющие высшую степень окисления, не могут отдавать электроны, а могут только присоединять их.
2. Вещества, которые могут быть только восстановителями. В таких веществах элементы, изменяющие свою степень окисления, находятся в низшей степени окисления (см. табл. 2).
Таблица 2
Важнейшие восстановители
Элемент |
Низшая степень окисления |
Вещества-восстановители (примеры) |
N |
-3 |
NH3 |
S |
-2 |
H2S |
F, Cl, Br, I |
-1 |
HF, HCl, HBr, HI |
P |
-3 |
PH3 |
H |
-1 |
гидриды металлов (NaH) |
Все металлы |
0 |
Na, Fe, Al, Zn… |
Атомы с низшими степенями окисления не могут присоединять электроны, а могут только отдавать их.
3. Вещества, которые могут быть и окислителями, и восстановителями (в зависимости от условий протекания химической реакции). Молекулы таких веществ содержат элементы с промежуточной степенью окисления (см. табл. 3).
Таблица 3
Вещества, проявляющие
окислительно-восстановительную двойственность
Элемент |
Промежуточные степени окисления |
Вещества (примеры) |
N |
0 +3 |
N2 HNO2 |
S |
0 +4 |
S SO2, H2SO3 |
Fe |
+2 |
FeSO4, FeCl2 |
Атомы имеющие промежуточную степень окисления могут принимать и отдавать электроны в результате реакции. Различают три типа окислительно-восстановительных реакций.
1. Межмолекулярные реакции — протекают с изменением степени окисления атомов в различных молекулах. Например:
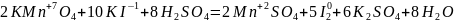 .
.
2. Внутримолекулярные реакции — атомы, изменяющие свою степень окисления находятся в одной молекуле. Например:
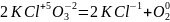 .
.
3. Реакции диспропорционирования (самоокисления-самовосстанов-ления) — реакции, идущие с изменением степени окисления атомов одного и того же элемента. Например:
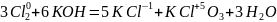 .
.
Необходимо уметь составлять уравнениz окислительно-восстановитель-ных реакций. Наиболее простым является метод электронного баланса, в основе которого лежит правило: общее число электронов, которое отдает восстановитель, всегда равно общему числу электронов, которое присоединяет окислитель.
При составлении уравнения окислительно-восстановительной реакции необходимо:
а) составить схему реакции. Например:
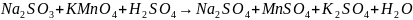 ;
;
б) определить атомы каких элементов изменят степень окисления:
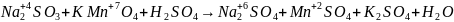 ;
;
в) составить электронные уравнения процессов окисления и восстанов-ления:
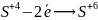 (окисление);
(окисление);
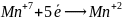 (восстановление);
(восстановление);
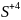 — восстановитель;
— восстановитель;
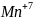 — окислитель;
— окислитель;
г) подобрать коэффициенты, чтобы число элементов, которые отдает восстановитель ( ) было равно числу электронов, которые присоединяет окислитель ( ):
|
5; |
|
2; |
д) перенести эти коэффициенты в схему реакции и подобрать коэффициенты перед формулами других веществ реакции:
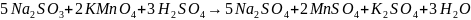 .
.
Правильность составления уравнения реакции обычно определяется по числу атомов кислорода в левой и правой части уравнения.
