
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
Физико-химические основы коагулирования примесей воды
Коагуляцией примесей воды называется процесс укрепления мельчайших коллоидных и диспергированных частиц, происходящий вследствие их взаимного слипания под действием сил молекулярного притяжения. В процессе коагуляции образуются видимые невооруженным глазом агрегаты – хлопья, которые отделяются от жидкой сферы.
В природных водах гидрофильные примеси в основном представлены органическими веществами. На их поверхности удерживается значительное количество воды в виде гидратной оболочки, обусловленное наличием поверхностных полярных групп, таких как –OH, –COOH и др., которые водорастворимы. Они и удерживают вокруг частицы гидратную оболочку. Гидрофильные частицы обычно несут небольшие электрические заряды, как правило, под влиянием электролитов не коагулируют.
Частица ила, глины, пылевидные частицы песка и подобная им взвесь природных вод являются гидрофобными примесями. Они практически лишены гидратной оболочки, но имеют двойной электрический слой и имеют значительные электрические заряды. Ликвидация или уменьшение электрического заряда частиц приводит к нарушению агрегативной устойчивости и коагуляции гидрофобных примесей.
Для гидрофобных частиц характерна кристаллическая структура и большая удельная поверхность, на которой адсорбируются присутствующие в воде ионы.
В целом ядро с адсорбционным и диффузным слоями называется мицеллой (строение мицеллы рассматривалось ранее в п.1.7).
В состоянии покоя мицелла электронейтральна, так как заряд гранулы нейтрализуется противоионами диффузного строя.
Между коллоидными примесями воды существуют молекулярные силы взаимного притяжения, называемые Ван-дер-Ваальсовыми силами, которые действуют на небольшом расстоянии между взаимодействующими частицами и с увеличением расстояния между ними убывают, а при сближении частиц силы отталкивания и притяжения возрастают. Если частицы движутся с большой скоростью, то они преодолевают «барьер» и преобладающими становятся силы притяжения, и они укрупняются объединяясь.
Коагуляция
природных гидрофобных коллоидов, имеющих
обычно
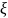 -потенциал
в пределах 0,05…0,1 В, становится возможной
при снижении электролитического
потенциала до 0,03 В и меньше. Оптимально,
когда электрический потенциал равен
нулю. Такое состояние коллоидной системы
называют изоэлектрическим, а величина
pH,
отвечающая ему, называется изоэлектрической
точкой системы (pНиз).
То есть pНиз
изоэлектрической точки — это значение
pH
среды, в которой находится частица и
отталкивающие силы минимальны или равны
нулю.
-потенциал
в пределах 0,05…0,1 В, становится возможной
при снижении электролитического
потенциала до 0,03 В и меньше. Оптимально,
когда электрический потенциал равен
нулю. Такое состояние коллоидной системы
называют изоэлектрическим, а величина
pH,
отвечающая ему, называется изоэлектрической
точкой системы (pНиз).
То есть pНиз
изоэлектрической точки — это значение
pH
среды, в которой находится частица и
отталкивающие силы минимальны или равны
нулю.
При добавлении в воду коагулянтов происходит постепенное снижение электрокинетического потенциала, иногда вплоть до нуля.
При добавлении к воде коагулянта первоначально формируются хлопья (в виде цепочки) из одного реагента, так как обычно в природных водах условия для коагуляции более благоприятные, чем для примесей воды. На поверхности сформировавшихся хлопьев коагулянта адсорбируются примеси воды. В свою очередь цепочки коагулянта могут прилипать к поверхности крупных примесей. Таким образом образуются глобулы (хлопья), при осаждении которых достигается осветление, обесцвечивание воды. Кроме того, на поверхности хлопьев могут адсорбироваться растворенные органические вещества, обусловливающие привкусы и запахи воды, чем достигается определенная ее дезодорация.
Действие коагулянта в воде сводится к трем основным процессам: собственно, коагуляции, флокуляции, осаждения и сорбции.
Вначале при внесении в обрабатываемую воду коагулянта (сульфата алюминия, железного купороса и др.) происходит его диссоциация на ионы металла и анионы сильных кислот. Ионы трехвалентных металлов, принимая
участие в обмене с одновалентными катионами диффузного слоя гидрофобных
примесей воды, способствуют уменьшению их агрегативной устойчивости и вследствие этого сжатию диффузного слоя.
Поскольку природные воды имеют запас щелочности, то введенный катион алюминия вступает во взаимодействие с карбонат- и гидрокарбонат-ионами с образованием малорастворимого гидроксида алюминия:
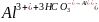 ;
;
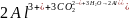 .
.
При использовании в качестве коагулянта железного купороса FeSO4 в результате нейтрализации образуется гидроксид железа (II) Fe(OH)2, который в присутствии растворенного кислорода в воде очень быстро переходит в гидроксид железа (III):
 ;
;
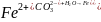 ;
;
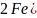 .
.
Гидроксиды алюминия и железа образуют в виде золи с положительным зарядом на грануле. Эти коллоидные частицы усиливают общее коагулирующее действие введенных солей.
Если
в качестве коагулянта применяется
сернокислый алюминий
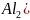 ,
в зависимости от условий процесса
гидролиза возможно образование коллоидов
малорастворимых оснований солей
алюминия:
,
в зависимости от условий процесса
гидролиза возможно образование коллоидов
малорастворимых оснований солей
алюминия:
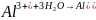 ;
;
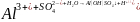 ;
;
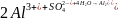 .
.
Выделившиеся при этом ионы водорода задерживают дальнейший ход реакции и снижают величину pH воды, что сдвигает от изометрической точки гидроксид алюминия и основные его соли, и ухудшает тем самым условия их коагуляции. Связывание ионов водорода происходит за счет взаимодействия их с анионами щелочности воды:
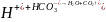 ;
;
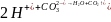 ;
;
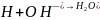 ;
;
При недостатке щелочного резерва к воде добавляют известь или соду (процесс подщелачивания).
