
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
1.6. Гидролиз солей
Одним из важнейших свойств солей является гидролиз. Гидролиз — это разложение водой.
Гидролизом солей называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность
гидролиза сводится к химическому
взаимодействию катионов или анионов
соли с гидроксид-ионами или ионами
водорода из молекул воды. При взаимодействии
образуется малодиссоциирующее соединение
(слабый электролит). Химическое равновесие
процесса диссоциации воды при гидролизе
смещается вправо:
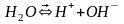 .
Поэтому в водном растворе соли появляется
избыток свободных ионов
и
, и раствор соли показывает кислую или
щелочную реакцию среды.
.
Поэтому в водном растворе соли появляется
избыток свободных ионов
и
, и раствор соли показывает кислую или
щелочную реакцию среды.
Для многих солей процесс гидролиза - обратим.
Для характеристики способности гидролизоваться существует понятие «степень гидролиза»:
 — степень
гидролиза:
— степень
гидролиза:
|
(6) |
|
где |
|
|
Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, повышении его температуры степень гидролиза увеличивается.
Любая соль может быть представлена как продукт взаимодействия кислоты и основания.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа (рис. 4):
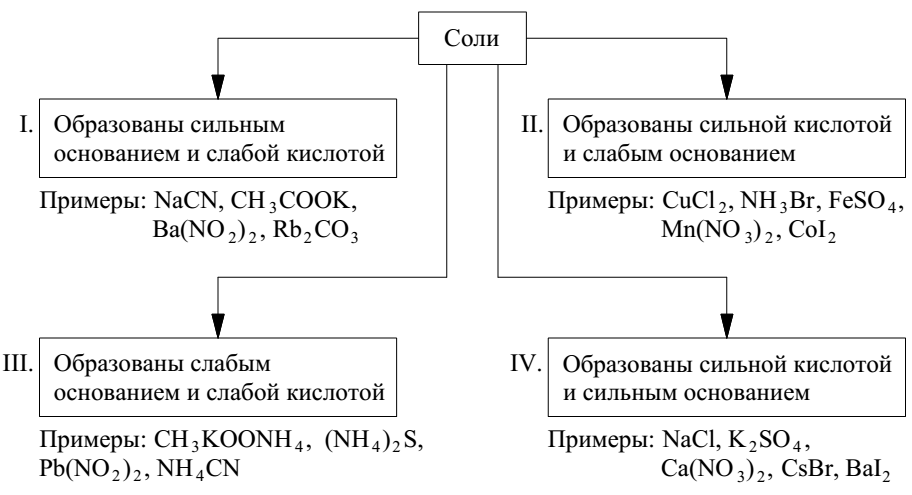
Рис. 4. Типы солей по способу их образования
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу.
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой
Например, соль KNO3 образована сильным основанием KOH и слабой кислотой HNO2.
Молекулярное уравнение:
 .
.
Полное ионное уравнение:
 .
.
Сокращенное ионное уравнение:
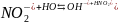 .
.
Как
видно в данном случае среда раствора
будет щелочная так как имеется избыток
гидроксид-ионов
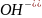 .
.
II. Соли, образованные слабым основанием и сильной кислотой
Например,
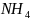 I,
образована слабым основанием
OH
и сильной кислотой HI;
I,
образована слабым основанием
OH
и сильной кислотой HI;
Молекулярное уравнение:
I+HOH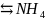 OH+HI.
OH+HI.
Полное ионное уравнение:
 .
.
Сокращенное ионное уравнение:
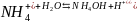 .
.
В
заданном случае при гидролизе такого
типа солей образуется избыток ионов
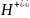 ,
то есть среда раствора будет кислая.
,
то есть среда раствора будет кислая.
III. Соли, образованные слабым основанием и слабой кислотой
Соли, образованные слабым основанием и слабой кислотой, гидролизуются одновременно и по катиону, и по аниону.
Например,
соль
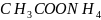 образована
слабой уксусной кислотой
образована
слабой уксусной кислотой
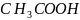 и слабым основанием
и слабым основанием
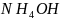 .
.
Молекулярное уравнение:
 .
.
Ионное уравнение:
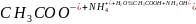 .
.
Для данного случая реакция раствора будет нейтральная, так как контакты диссоциации кислоты и основания равна между собой:
Kg(C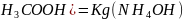 .
.
При аналогичном составе соли подвергающейся гидролизу по III типу, среда раствора будет зависеть от константы диссоциации образующихся слабой кислоты и слабого основания.
Например:
соль
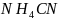 обраована слабой кислотой
обраована слабой кислотой
 и слабым основанием
.
и слабым основанием
.
Молекулярное уравнение:
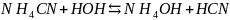 .
.
Ионное уравнение:
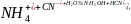 .
.
Так
как степень диссоциации
больше степени диссоциации
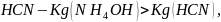 значит,
реакция раствора будет слабощелочная.
значит,
реакция раствора будет слабощелочная.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой.
Например:
соль
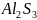 образована гидроксидом
образована гидроксидом
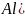 — слабое нерастворимое основание и
— слабое нерастворимое основание и
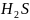 — сероводородная кислота — летучая.
— сероводородная кислота — летучая.
Уравнение гидролиза данной соли

Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, так как катионы и анионы этих солей не связываются с ионами или воды, то есть не образуют с ними молекул слабых электролитов.
Гидролиз может быть ступенчатым. Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. Гидролиз идет с образованием кислой соли и основания.
Например,
соль
 ,
образованная однокислотным основанием
KOH
и
двухосновной кислотой
,
образованная однокислотным основанием
KOH
и
двухосновной кислотой
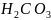 гидролизуется ступенчато.
гидролизуется ступенчато.
Первая ступень:
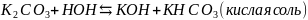 ;
;
2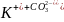 +
+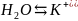 +O
+O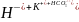 ;
;
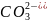 +
+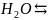 O
O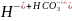 .
.
Вторая ступень:
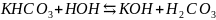 ;
;
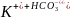 +
+O
+
+O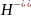 +
;
+
;
 +
O
+
.
+
O
+
.
Гидролиз
по второй ступени протекает в меньшей
степени. Среда раствора щелочная (pH7)
за счет увеличения гидроксид-ионов
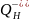 в растворе.
в растворе.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания.
Например, соль NiCl2 образована слабым двухосновным основанием Ni(OH)2 и сильной кислотой HCl, она гидролизуется по схеме:
первая ступень:
Ni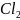 +
NiOHCl+HCl;
+
NiOHCl+HCl;
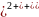 2
2
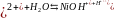 ;
;
вторая ступень:
NiOHCl Ni(OH
Ni(OH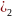 +HCl;
+HCl;
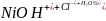 Ni(OH
Ni(OH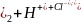
 Ni(OH
Ni(OH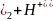 .
.
За
счет избытка ионов
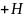 в растворе — среда
раствора кислая.
в растворе — среда
раствора кислая.

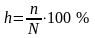 ,
, — число
молекул соли, подвергшихся гидролизу;
— число
молекул соли, подвергшихся гидролизу;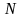 — общее
число растворенных молекул соли.
— общее
число растворенных молекул соли.