
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
1.5. Диссоциация воды. Водородный показатель
Вода по своей природе является слабым амфотерным электролитом.
Уравнение ионизации воды с учетом гидратации ионов водорода следующее:
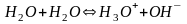 .
.
Без учета гидратации ионов уравнение имеет вид
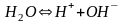
Как
видно из последнего уравнения, концентрация
ионов равна концентрации ионов
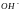 .
При 25 °С
.
При 25 °С
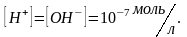
Произведение
концентрации ионов водорода и
гидроксид-ионов называется ионным
произведение воды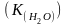 :
:
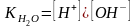 .
.
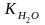 является
постоянной величиной и при температуре
25 °С:
является
постоянной величиной и при температуре
25 °С:
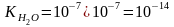 .
.
Среду любого водного раствора можно охарактеризовать концентрацией ионов водорода или гидроксид-ионов в растворе.
В водных растворах различают три типа сред: нейтральную, щелочную и кислую.
Нейтральная среда — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид ионов:
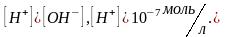
Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
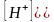
Таким образом избыток ионов водорода в растворе дает кислую реакцию, избыток гидроксид-ионов — щелочную. При равенстве концентраций ионов водорода и гидроксид-ионов в растворе среда нейтральная.
Для
характеристики среды раствора используется
водородный показатель
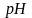 .
.
Водородный
показатель
— это отрицательный десятичный логарифм
концентрации ионов водорода в растворе:
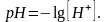
Например,
если
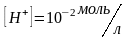 , то
, то
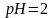 ,
среда раствора — кислая; если
,
среда раствора — кислая; если
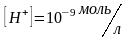 ,
то среда раствора — щелочная; если
,
то среда раствора — щелочная; если
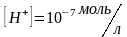 ,
то среда нейтральная.
,
то среда нейтральная.
Зависимость между концентрацией ионов, величиной и средой раствора показана на рис. 2
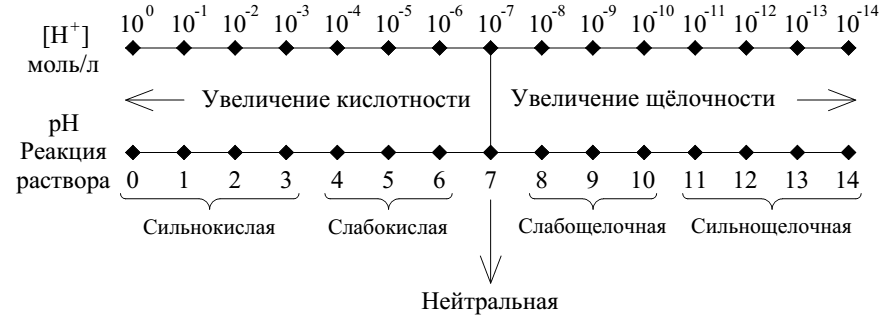
Рис. 2. Зависимость между концентрацией ионов величиной и средой раствора
Для измерения значения существуют различные качественные и количественные методы.
Качественно реакцию среды и водных растворов электролитов определяют с помощью индикаторов.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т.е. раствора.
На практике применяют индикаторы лакмуса, метиловый оранжевый (метилоранж) и фенолфталеин. Они изменяют свою окраску в малом интервале : лакмус — в интервале от 5,0 до 8,0; метилоранж — от 3,1 до 4,4 и фенолфталеин — от 8,2 до 10,0.
На рис. 3 заштрихованные области показывают интервал изменения окраски индикатора.
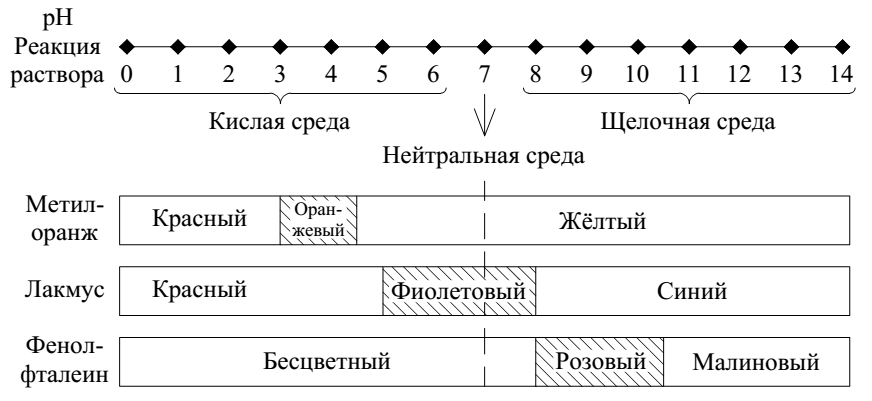
Рис. 3. Изменение цвета индикаторов в зависимости от среды раствора
Для точного измерения раствора служат приборы, называемые pH-метрами, которые определяют водородный показатель с точностью до сотых долей.
Задачи для самостоятельного решения
1.
Вычислить концентрацию ионов
в водном растворе, если концентрация
гидроксид-ионов
равна .
Определите характер среды раствора.
.
Определите характер среды раствора.
2.
Вычислить
водного раствора, в котором концентрация
гидроксид-ионов равна
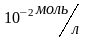 .
Как изменится цвет метилоранжа в этом
растворе?
.
Как изменится цвет метилоранжа в этом
растворе?
3.
Концентрация ионов водорода
в растворе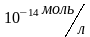 .
Определить концентрацию гидроксид-ионов,
и характер среды раствора. Как изменится
цвет метилоранжа в этом растворе?
.
Определить концентрацию гидроксид-ионов,
и характер среды раствора. Как изменится
цвет метилоранжа в этом растворе?
4.
Определить концентрацию ионов водорода
и гидроксид-ионов в растворе, характер
его среды, если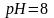 .
Как изменится цвет фенолфталеина в этом
растворе?
.
Как изменится цвет фенолфталеина в этом
растворе?
5.
Вычислить концентрацию гидроксид-ионов
в растворе, если концентрация ионов
равна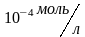 . Определить характер среды.
. Определить характер среды.
