
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
Примеры решения задач
Задача №1
Сахар массой 5 г растворим в воде массой 20 г. Какова массовая доля (%)
сахара в растворе?
Определяем общую массу раствора:
m(р-ра)= m(воды)+ m(сахара);
m(р-ра)= 20 г + 5 г = 25 г.
Вычислим массовую долю (%) сахара в растворе:
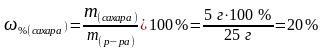
Задача №2
Раствор объемом 500 мл содержит NaOH массой 5 г. Определить молярную концентрацию этого раствора.
Вычислим число молей (n) в 5 г
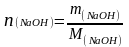 откуда
откуда
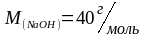 ;
;
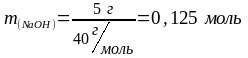
Определим молярную концентрацию раствора:
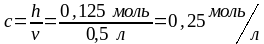 .
.
Задачи для самостоятельного решения
1. Какие массы йода и спирта необходимы для приготовления 300 г раствора с массовой долей йода 5 %?
2. Сколько молекул растворенного вещества содержат 10 мл раствора, молекулярная концентрация которого 0,01 моль/л?
3. Определить массовую долю (%) хлорида меди (II) CuCl2 в растворе, если на 2 моля соли приходится 15 молей воды?
4. В 200 мл воды растворили 50 л хлороводорода HCl (н.у.). Какова массовая доля (%) HCl в этом растворе?
5.
К 300 мл 20 % раствора серной кислоты (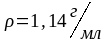 )
прилили 250 мл воды. Определить процентную
и молярную концентрацию полученного
раствора.
)
прилили 250 мл воды. Определить процентную
и молярную концентрацию полученного
раствора.
1.3. Электролитическая диссоциация. Степень и константа диссоциации
Водные растворы различных веществ отличаются друг от друга по способности проводить электрический ток. По этому признаку все вещества могут быть разделены на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам можно отнести соли, кислоты, основания.
Неэлектролитами называются вещества, растворы и расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и т.д.)
Процесс распада молекул электролита на ионы в растворе или расплаве называется электролитической диссоциацией, или ионизацией.
Ионы
могут быть простыми (Na+,
Mg2+,
S2-
и др.) и сложными (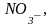
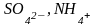 и др.).
и др.).
Положительно
заряженные ионы называются катионами,
например
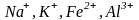 и т.д.
и т.д.
Отрицательно
заряженные ионы называются анионами,
например
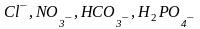 и т.д.
и т.д.
Процесс электролитической диссоциации обратим. Существует понятие «степень электролитической диссоциации». В водных растворах некоторые электролиты распадаются на ионы, другие лишь частично.
Число,
показывающее, какая часть молекул
распалась на ионы, называется степенью
электролитической диссоциации (степенью
ионизации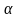 ).
).
Данная величина определяется как
|
(5) |
где
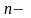 число
молекул распавшихся на ионы;
число
молекул распавшихся на ионы;
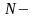 общее
число растворенных молекул.
общее
число растворенных молекул.
Пример диссоциации веществ:
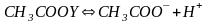 ;
;
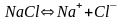 ;
;
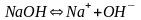 .
.
Степень диссоциации зависит от природы растворителя и природы растворенного вещества, концентрации раствора, температуры и других факторов.
При уменьшении концентрации электролита, т.е. при разбавлении раствора, степень диссоциации увеличивается. При повышении температуры степень диссоциации, как правило, увеличивается.
Электролиты могут быть сильные и слабые.
Сильные электролиты, это те, которые в водных растворах полностью диссоциируются на ионы, т.е. степень диссоциации равна 1 (100 %).
К сильным электролитам относят: соли;
сильные
кислоты (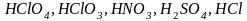 и
др.);
и
др.);
щелочи
(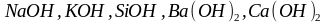 и др.).
и др.).
Слабые электролиты, которые в водных растворах не полностью диссоциируются на ионы, т.е. степень диссоциации меньше 1, меньше 100%.
К
слабым электролитам относятся: слабые
кислоты (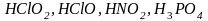 и др.); слабые нерастворимые в воде
основания (
и др.); слабые нерастворимые в воде
основания (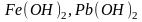 и
т.д.); гидроксид аммония
и
т.д.); гидроксид аммония
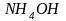 ;
вода
;
вода
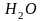 .
.
Для
характеристики слабых электролитов
используется понятие константы
диссоциации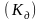 .
В растворах слабых электролитов при их
диссоциации происходит частичная
диссоциация и в растворе устанавливается
динамическое равновесие между
недиссоциированными молекулами и
ионами. Например:
.
В растворах слабых электролитов при их
диссоциации происходит частичная
диссоциация и в растворе устанавливается
динамическое равновесие между
недиссоциированными молекулами и
ионами. Например:
 для
этого случая
для
этого случая
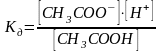 .
.

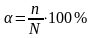 ,
,