
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
Щелочность. Углекислотное равновесие воды
Процесс вступающих в реакцию с сильными кислотами, т.е. ионами водорода, веществ, находящихся в воде — щелочность. Данный критерий является одной из важнейших характеристик природной воды.
Щелочность воды сильно зависит от состояния соединений углекислоты.
Углекислота
может присутствовать в воде в виде
недиссоциированных молекул
(небольшое
количество), растворенного
и гидрокарбонатов (бикарбонатов)
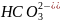 ,
если
воды менее 8,4 и в виде карбонатов
,
если
более 8,4.
,
если
воды менее 8,4 и в виде карбонатов
,
если
более 8,4.
Количественное соотношение между различными соединениями углекислоты определяется уравнением диссоциации первой и второй ступени.
Первая ступень диссоциации:
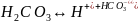 ;
;
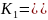 .
.
Вторая ступень диссоциации:
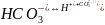 ;
;
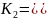 .
.
Константы
диссоциации первой и второй ступени
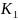 и
и
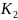 зависят от концентрации ионов водорода,
поэтому существование различных форм
углекислоты в растворе определяется
значением
среды.
зависят от концентрации ионов водорода,
поэтому существование различных форм
углекислоты в растворе определяется
значением
среды.
Так,
при
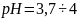 углекислота в воде представленная лишь
диоксидом углерода
углекислота в воде представленная лишь
диоксидом углерода
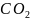 –
уменьшается, а доля гидрокарбонатов,
следовательно, возрастает. При
–
уменьшается, а доля гидрокарбонатов,
следовательно, возрастает. При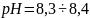 практически
вся углекислота находится в виде
гидрокарбонатов. При значениях
практически
вся углекислота находится в виде
гидрокарбонатов. При значениях
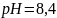 и выше свободного
в воде нет.
и выше свободного
в воде нет.
Жесткость.
Общая жесткость воды
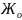 зависит от концентрации катионов
зависит от концентрации катионов
двухвалентных щелочноземельных металлов, главным образом кальция и магния в составе воды. Определение жесткости воды производится лишь для природных и питьевых вод. В сточных водах этот показатель значения не имеет.
Общая жесткость
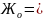 ,
,
где 20,04 и 12,16 – эквивалентные массы С𝑎 и 𝑀𝑔 соответственно.
Жесткость
воды различают как карбонатную, так и
некарбонатную. Количество
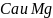 ,
эквивалентное содержанию гидрокорбонатов
,
эквивалентное содержанию гидрокорбонатов
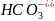 ,
называется
карбонатной жесткостью и обозначается
,
называется
карбонатной жесткостью и обозначается
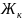 .
Если количество гидрокарбонатов в воде
превышает содержание
,
то карбонатная жесткость эквивалентна
суммарному содержанию
.
При
.
Если количество гидрокарбонатов в воде
превышает содержание
,
то карбонатная жесткость эквивалентна
суммарному содержанию
.
При
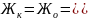 .
.
В табл. 7 приведена степень жесткости природных вод.
Таблица 7
Степень жёсткости природных вод
Характеристика воды |
Жесткость, мг-экв./л |
Характеристика воды |
Жесткость, мг-экв./л |
Мягкая Средней жесткости |
< 4 4-8 |
Жесткая Очень жесткая |
8-12 >12 |
Если же содержание ионов кальция и магния выше, чем количество гидрокарбонатов, то карбонатная жесткость равна концентрации При
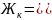 .
.
Разность между общей и карбонатной жесткостью называется некарбонатной жесткостью:
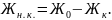
Жесткость речных вод невелика (1-6 мг-экв./л). Вода подземных источников имеет более высокую жесткость, чем поверхностные воды.
Соединения азота и фосфора.
Азот в воде может находиться в виде органических соединений — белковых и небелковых, и неорганических — в виде аммонийного, нитритного и нитратного азота.
Если в природной воде обнаруживается повышенное количество азота в виде органических соединений или в аммонийной форме, то это свидетельствует о загрязнении водоисточника сточными водами. В питьевой воде не допускается наличия органического и аммонийного азота.
В речных водах содержание азота аммонийных солей колеблется от 0 до 1 мг/л в зависимости от степени ее загрязненности.
Так как азот и фосфор являются важнейшими элементами питания бактерий, определение этих элементов и их соединений в сточных водах имеет большое значение.
Одним из основных способов очистки сточных вод является биологическая очистка, которая происходит под действием активного или (совокупность различных микроорганизмов).
Достаточность
элементов питания для микроорганизмов
в процессе биологической очистки,
определяется отношением основных
показателей анализа
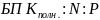 (БПК-биологическое потребление кислорода).
N-азот
в аммонийной форме, а P-фосфор
в виде растворенных фосфатов. Обычно
считают, что для процессов аэробного
окисления должно быть обеспечено
соотношение
(БПК-биологическое потребление кислорода).
N-азот
в аммонийной форме, а P-фосфор
в виде растворенных фосфатов. Обычно
считают, что для процессов аэробного
окисления должно быть обеспечено
соотношение
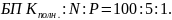 В табл. 8 дана схема превращения азота.
В табл. 8 дана схема превращения азота.
Таблица 8
Схема превращения азота
Форма азотного соединения |
Условия для превращения |
Сооружения |
|||
исходная |
образующая |
||||
Мочевина |
Аммонийный азот |
Факультативные |
Канализационная сеть |
||
Белковый азот фекалий |
Аминокислоты, аммонийный азот |
Факультативные |
Аэротенки, биофильтры, метантенки и др. |
||
Аммонийный азот |
Белковый азот бактериальных клеток, водорослей |
Факультативные |
Биофильтры, метантенки, водоемы, пруды и т.д. |
||
Белковый азот бактериальных клеток |
Аминокислоты, аммонийный азот |
Факультативные |
То же |
||
Аммонийный азот |
Нитриты, нитраты |
Анаэробные |
Нитрификаторы |
||
Нитриты, нитраты |
Азот |
Анаэробные |
Денитрификаторы |
||
Нитриты, нитраты |
Азот клеток водорослей |
Факультативные |
Водоемы, пруды |
||
Как видно из табл. 8 в водоем не должны попадать азотные соединения ни в восстановленной, ни в окисленной форме.
Переход аммонийного азота в нитриты и нитраты идет с большой затратой кислорода:
 .
.
При денитрификации кислород выделяется
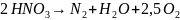 ;
;
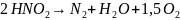 .
.
При денитрификации (сложный многостадийный процесс) конечными предметами распада могут быть молекулярный азот, аммиак, либо окислы азота. Денитрификация сточных вод, как правило, идет с образованием молекулярного азота.
Содержание
фосфатов в питьевой воде нормируется
по
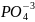 в виде гексаметофосфатов и триполифосфатов
до 3,5 мг/л.
в виде гексаметофосфатов и триполифосфатов
до 3,5 мг/л.
Виды окисляемости. Окисляемость — определение общего содержания в воде восстановителей — органических и неорганических. Как в природных, так и в сточных водах определяют органические восстановители, т.е. всю величину окисляемости относят к органическим примесям воды. Различают химическую и биохимическую окисляемость. Если в качестве окислителя используется химический окислитель — химическая окисляемость. Если же окисление идет с помощью аэробных бактерий — биохимическая окисляемость.
Химическая
окисляемость определяется с использованием
бихромата калия
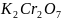 — «бихроматная
окисляемость», или йодата калия
— «бихроматная
окисляемость», или йодата калия
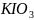 «йодатная окисляемость». Эти два типа
окисляемости называют химической
потребностью в кислороде ХПК.
«йодатная окисляемость». Эти два типа
окисляемости называют химической
потребностью в кислороде ХПК.
Биохимическая окисляемость БПК — при ее определении окислителями являются бактерии, способные существовать за счет использования загрязнений воды в качестве источника питания. Использованные органические вещества (загрязнения) расходуются на энергетические нужды бактерий, а другая часть — на синтез тела клетки. Продукты окисления выводятся из клетки во внешнюю среду. Суммарное количество кислорода, требуемое микроорганизмам на цикл реакции синтеза и получения энергии, и есть БПК.
Если
все органические вещества сточной воды
обозначить
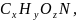 то суммарно реакции биологического
окисления моно представить:
то суммарно реакции биологического
окисления моно представить:
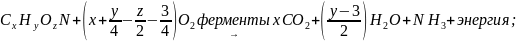
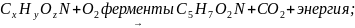
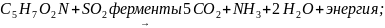
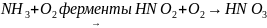 ,
,
где
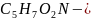 среднее
соотношение основных элементов в
клеточном веществе бактерий.
среднее
соотношение основных элементов в
клеточном веществе бактерий.
Две
первые реакции данной схемы показывают
биохимический процесс очистки сточной
воды от исходных загрязнений (состава
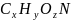 ).
).
Такой
процесс происходит на биофильтрах,
аэротенках, биопрудах и т.п. первая
реакция — окисление вещества на
энергетические потребности клетки,
вторая — на синтез клеточного вещества
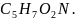 Затратой кислорода на эти две реакции
является полная БПК (
Затратой кислорода на эти две реакции
является полная БПК (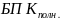 ).
).
Величина — важнейшая технологическая характеристика процесса биологической очистки воды в любых биоокислителях.
