
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
Решение типовых задач
Воду
объемом 1000 мл насыщают нитратом калия
при 60 °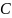 .
Раствор охлаждают до 30 °
.
Какая масса соли выпадет в осадок?
.
Раствор охлаждают до 30 °
.
Какая масса соли выпадет в осадок?
Дано: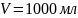 ;
;
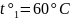 ;
;
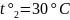 .
.
Найти:
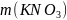 .
.
Решение.
1.
По кривой растворимости (рис. 1) нитрата
калия находим растворимость
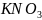 при 60 °
и при 30 °
.
при 60 °
и при 30 °
.
При
60 °
растворимость
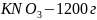 ;
;
При
30 °
растворимость
 .
.
2. Рассчитываем массу соли, выпавшей в осадок:
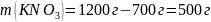 .
.
Ответ: при охлаждении насыщенного раствора от 60 ° до 30 ° выпадает в осадок 500 г соли.
Задачи для самостоятельной работы
1.
Найти растворимость хлорида аммония
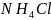 при 20 °
;
60 °
;
90 °
.
при 20 °
;
60 °
;
90 °
.
2. В какой массе воды нужно растворить массой 165 г, чтобы получить раствор, насыщенный при 35 ° ?
3.
Из какой массы медного купороса можно
получить сульфат меди (II)
массой 80 г. Медный купорос -
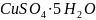 .
.
4.
Какая масса воды соединяется с безводным
сульфатом натрия массой 56,8 г при
образовании кристаллогидрата
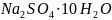 ?
?
5. При выпаривании насыщенного при 20 ° водного раствора хлорида натрия массой 200 г получена соль массой 52,64 г. Какова растворимость в воде хлорида натрия при 20 ° ?
Количественная характеристика состава раствора
При количественной оценке растворов используют также понятие «разбавленный раствор» (это такой раствор, который содержит мало растворенного вещества) и «концентрированный раствор» (содержащий много растворенного вещества).
Для выражения количественного состава растворов используют различные способы.
Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора:
|
(1) |
где |
|
Данную величину можно выразить:
|
(2) |
Существует понятие процентной концентрации раствора — количество граммов растворенного вещества, содержащееся в 100 г раствора.
Например,
если в 100 г раствора содержится 10 г
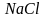 ,
то это будет 10 % раствор хлорида натрия.
,
то это будет 10 % раствор хлорида натрия.
Нормальная концентрация раствора (эквивалентная)
Нормальным называется раствор, в 1 литре которого содержится 1 грамм-эквивалент растворенного вещества.
Грамм-эквивалент
кислоты равен молекулярному весу,
деленному на основность кислоты
(основность кислоты определяется
количеством атомов водорода в составе
кислоты). Например,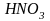 —
одноосновная,
—
одноосновная,
 — двухосновная,
— двухосновная,
 — трехосновная и т.д.
— трехосновная и т.д.
Грамм-эквивалент
 ;
;
Грамм-эквивалент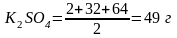 ;
;
Грамм-эквивалент
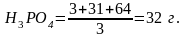
Таким
образом, 1
 —
грамм-эквивалентной концентрацией
раствора
—
грамм-эквивалентной концентрацией
раствора
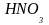 будет 1 л раствора 63 г.
будет 1 л раствора 63 г.
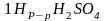 — 1
л раствора содержит 49 гр.
— 1
л раствора содержит 49 гр.
— 1 л раствора содержит 32,6 гр.
Грамм-эквивалент основания равен молекулярной массе основания, деленной на кислотность основания, т.е. на количество гидроксильных групп, входящих в состав основания.
Например
 — однокислотное основание:
— однокислотное основание:
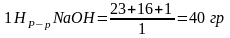 в
1 л р-ра.
в
1 л р-ра.
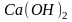 — двухкислотное
основание:
— двухкислотное
основание:
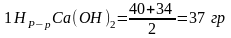 в
1 л р-ра.
в
1 л р-ра.
 — трехкислотное
основание:
— трехкислотное
основание:
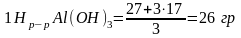 в
1 л р-ра.
в
1 л р-ра.
Грамм-эквивалент соли равен молекулярному весу соли, деленному на произведение атомов металла в составе соли, на количество кислотных остатков, входящих в молекулу соли.
Например,
— грамм-эквивалент:
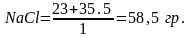
Грамм-эквивалент
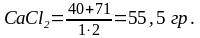
Грамм-эквивалент
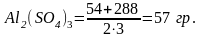
Таким образом, 1 (эквивалентным) будет раствор, содержащий в 1 литре 58,5 гр NaCl; 55,5 гр CaCl или 57 гр Al2(SO4)3.
Для выражения концентрации раствора используют понятие молярная концентрация — количество грамм молекул растворенного вещества в 1 литре раствора.
1Мр-р NaCl — 58,5 гр хлорида натрия в 1 литре раствора;
1Мр-р HCl — 36,5 гр хлороводорода в 1 литре раствора.
Молярную концентрацию можно рассчитать по формуле:
|
(3) |
|
где |
|
|
Часто для практических расчетов переходят от одного способа выражения концентрации к другому, если известна плотность раствора:
|
(4) |


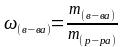 ,
,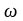 — массовая
доля вещества;
— массовая
доля вещества;
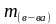 —
масса
растворенного вещества, гр;
—
масса
растворенного вещества, гр;
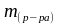 —
масса
раствора, гр.
—
масса
раствора, гр.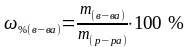 .
.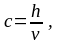
 молярная
концентрация, моль/л;
молярная
концентрация, моль/л; количество
растворенного вещества, моль;
количество
растворенного вещества, моль;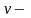 объем
раствора, л.
объем
раствора, л.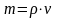 .
.