
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
- •Введение
- •Химия воды
- •Понятие о растворах. Процесс растворения. Растворимость веществ
- •Решение типовых задач
- •Задачи для самостоятельной работы
- •Количественная характеристика состава раствора
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.3. Электролитическая диссоциация. Степень и константа диссоциации
- •Задачи для самостоятельного решения
- •1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
- •Задачи для самостоятельного решения
- •1.5. Диссоциация воды. Водородный показатель
- •Задачи для самостоятельного решения
- •1.6. Гидролиз солей
- •I. Соли, образованные сильным основанием и слабой кислотой
- •II. Соли, образованные слабым основанием и сильной кислотой
- •III. Соли, образованные слабым основанием и слабой кислотой
- •Задачи для самостоятельного решения
- •1.7. Коллоидные растворы
- •Контрольные вопросы
- •1.8. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •2. Физические и химические свойства технологических процессов водоподготовки
- •2.1. Физико-химическая характеристика природных вод
- •2.2. Физические, химические, биологические показатели качества воды
- •Физико-химические основы коагулирования примесей воды
- •2.4. Коагулянты и флокулянты применяемые для осветления воды
- •2.5. Обеззараживание воды
- •Хлорирование воды.
- •2.5.2. Озонирование воды
- •2.5.3. Применение сильных окислителей и сорбентов. Осаждение
- •2.6. Характеристика бытовых и производственных сточных вод
- •Тест №1
- •3. Микробиология
- •3.1. Основы общей микробиологии
- •3.2. Морфологическая характеристика отдельных групп микроорганизмов
- •1) Меноидный слой с выступами и бугорками; 2) ликополисахаридный слой; 3) каналы; 4) молекулы белка; 5) плотный гликопептидный слой; 6) цитоплазматическая мембрана
- •8) Капсула; 9) мембрана протопласта.
- •3.3. Питание бактерий
- •3.4. Ферменты
- •3.5. Химический состав бактерий
- •3.6. Участие микроорганизмов в круговороте веществ в природе
- •3.7. Водоросли, грибы, простейшие, коловратки, черви и микробактерии
- •5) Surirella saxonica (образование ауксоспор); 6) Asterionella gracillima; 7) Pleurosigma attenuatum; 8) Didymosphenia geminata
- •3.8. Влияние внешних факторов на микробов
- •Тест №2
- •4. Санитарная микробиология
- •4.1. Санитарно-бактериологические методы анализа воды
- •4.2 Физические и физико-химические показатели состава воды
- •4.3. Химические и биохимические показатели
- •Примеси в коллоидном и твердом состояниях
- •Общая минерализация и общая загрязненность воды
- •Примеси в растворенном и коллоидном состояниях
- •Щелочность. Углекислотное равновесие воды
- •Тест №3
- •4.4. Индикаторная роль бактерий группы кишечной палочки
- •5. Биологические факторы самоочищения водоемов
- •6. Вредная деятельность микроорганизмов в системах водоснабжения
- •Тест №4
- •7. Сточные воды и методы их очистки
- •7.1. Очистные сооружения
- •11) Песчаные фильтры; 12) хлораторная; 13) контактный резервуар.
- •7.2. Сооружения механической очистки
- •7.3. Сооружения для биологической очистки.
- •7.4. Аэробные процессы очистки сточных вод
- •7.5. Анаэробные процессы очистки сточных вод
- •7.6. Биологические пруды
- •Тест № 5
- •Заключение
- •Библиографический список
- •Химия воды и микробиология Учебно-методическое пособие к практическим занятиям
Задачи для самостоятельного решения
1.
Какие из следующих ионов являются
катионами и какие анионами:
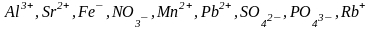 ?
?
2. Раствор фосфорной кислоты разбавили в 3 раза. Уменьшится или увеличится степень диссоциации кислоты?
3. Какие из следующих жидкостей проводят электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор гидроксида натрия, раствор азота в воде, водный раствор сульфата натрия? Ответ объяснить.
4. Написать формулы электролитов, в водном растворе которых содержатся ионы:
а)
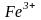 и
и
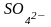 ;
б)
;
б)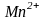 и
и
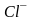 ;
в)
;
в)
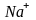 и
и
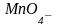 ;
г)
;
г)
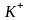 и
и
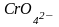 ;
;
д)
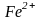 и
и
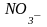 ;
е)
;
е)
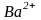 и
и
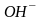 ;
ж)
;
ж)
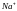 и
и
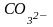 .
.
1.4. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
Кислоты
— это электролиты, которые при диссоциации
образуют только один вид катионов —
катион водорода
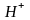 .
.
Кислоты могут быть одноосновными, двухосновными и т.д. Основность кислот определяется количеством атомов водорода в составе кислот.
Например,
— азотная кислота — одноосновная;
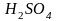 - серная кислота-двухосновная;
- серная кислота-двухосновная;
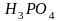 -
фосфорная кислота - трехосновная. Кислоты
по своей природе могут быть сильные (
-
фосфорная кислота - трехосновная. Кислоты
по своей природе могут быть сильные (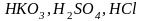 и др.) и слабые (
и др.) и слабые (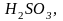
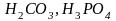 и
др.). Сильные кислоты диссоциируют
полностью в растворе:
и
др.). Сильные кислоты диссоциируют
полностью в растворе:
а)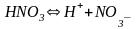 ;
;
б)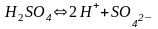 .
.
Слабые многоосновные кислоты диссоциируют ступенчато.
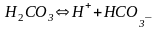 ;
;
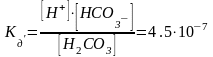 .
.
Вторая ступень диссоциации:
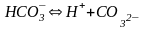 ;
;
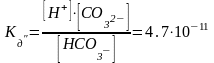 ;
;
Как
видно,
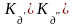 .
.
Основания — это электролиты, которые при диссоциации образуют только один вид анионов- гидроксид иона .
Сильные
основания (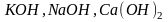 и др.) диссоциируют в одну ступень
полностью, например:
и др.) диссоциируют в одну ступень
полностью, например:
а)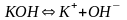 ;
;
б)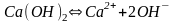 .
.
Слабые многокислотные основания (и др.) диссоциируют ступенчато, например:
Первая ступень диссоциации
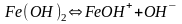 ;
;
Вторая ступень диссоциации
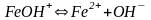 ;
;
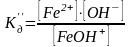 .
.
Если
диссоциация идет в несколько ступеней,
то
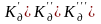 и т.д.
и т.д.
Существуют амфотерные гидроксиды, они могут реагировать и с кислотами, и с основаниями.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода и анионы гидроксида, т.е. диссоциация идет и по типу кислоты, и по типу основания.
К
амфотерным гидроксидам можно отнести
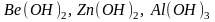 и другие.
и другие.
Уравнение
электролитической диссоциации, например
гидроксида цинка
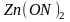 ,
без учета ступенчатого характера:
,
без учета ступенчатого характера:
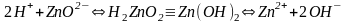 .
.
По типу кислоты по типу основания
Соли могут быть нормальные, кислые и основные.
Нормальные соли — это сильные электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка.
Рассмотрим диссоциацию нормальных солей:
а)
карбоната калия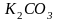
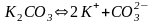 ;
;
т.е.
образуется катион металла
и анион кислотного остатка
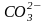 .
.
б)
сульфата алюминия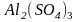 ;
;
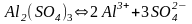 .
.
Кислотные соли — сильные электролиты, которые при диссоциации образуют катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Например,
кислая соль гидрокарбонат натрия
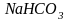 :
:
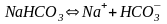 .
.
Основные соли — электролиты, образующие при диссоциации анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп .
Например,
основная соль
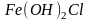 — дигидроксохлорид железа(III):
— дигидроксохлорид железа(III):
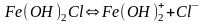 .
.
Задачи для самостоятельного решения
1.
Составьте уравнения электролитической
диссоциации следующих электролитов: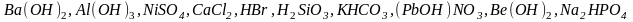 .
.
2.
Даны электролиты: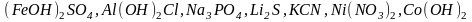 .
Составьте уравнения электролитической
диссоциации этих веществ.
.
Составьте уравнения электролитической
диссоциации этих веществ.
3.
Какие из следующих электролитов образуют
одновременно ионы водорода и
гидроксид-ионы: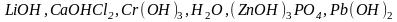 ?
?
4.
Написать выражение констант диссоциации
следующих электролитов: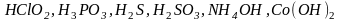 .
.
