
- •Н.А. Андреева
- •Введение
- •Сведения о материальных средах
- •1. Системы микрочастиц
- •1.1 Случай классических частиц
- •1.2. Вырожденные коллективы частиц
- •1.2.1. Фермионы
- •1.2.2 Бозоны
- •2. Кристаллические твердые тела
- •2.1 Трехмерные кристаллические системы
- •Индексы Миллера и кристаллографические направления
- •2. 2 Классификация дефектов
- •2.2.2 Дислокации и их движение
- •Плотность дислокаций
- •Взаимодействие дефектов
- •Физические свойства твердых тел
- •3. Тепловые свойства.
- •3.1. Теплоемкость твердого тела
- •3.1.1. Область низких температур
- •Теплоемкость электронного газа
- •3.2. Тепловое расширение твердых тел
- •3.3. Теплопроводность
- •4. Электрические свойства
- •4.1. Дрейф электронов
- •4.2. Время релаксации
- •4.3. Закон Видемана - Франца
- •4.4. Температурная зависимость подвижности носителей
- •4.5. Электропроводность чистых металлов
- •I II III Рис. 4. 4 Температурная зависимость удельного сопротивления металла ост
- •5. Электрон - электронное взаимодействие.
- •5.1. Взаимодействие электронов
- •5.1.1. Какие электроны участвуют во взаимодействии?
- •5.2. Основное состояние сверхпроводника
- •5.2.1. Энергия основного состояния
- •5.3. Энергетическая щель
- •6. Механические свойства.
- •6.1. Деформация растяжения
- •6.1.1. Расчет технической прочности при хрупком разрушении
- •6.2. Пути повышения прочности
- •7. Магнитные свойства твердых тел
- •7.1. Магнетизм веществ
- •7.1.1. Ферромагнетизм
- •7.1.2 Магнитные материалы
- •7.2. Парамагнетизм
- •7.2.1. Теория Ланжевена
- •7.3. Диамагнетизм
- •Получение низких и сверхнизких температур. Низкотемпературные жидкости.
- •8. Физические основы охлаждения.
- •8.1. Изоэнтропное расширение
- •8.2. Дросселирование сжатого газа
- •8.3. Расширение из постоянного объема
- •8.4. Десорбционное охлаждение
- •8.5. Откачка паров кипящей жидкости
- •9. Получение низких температур
- •Конструкция поршневого детандера
- •10. Получение сверхнизких температур
- •10.1 Метод адиабатического размагничивания
- •Криостат
- •10.2. Метод растворения 3Не в 4Не
- •1 0. 3. Метод Померанчука.
- •Энтропия
- •Криостат
- •11. Низкотемпературные жидкости.
- •11.1 Свойства криогенных жидкостей
- •1 1.2. Сверхтекучесть 4Не
- •11.3. Квантовые жидкости
- •11.4. Температурные волны
- •11.5. Квантовая жидкость 3Не
- •Библиографический список
- •Оглавление
11. Низкотемпературные жидкости.
Известно, что обычная жидкость характеризуется вязкостью, которая определяет силу трения, испытываемую при ее движении по трубам. Чем больше вязкость, тем больше сопротивление течению и тем больше должно быть давление на входе Рвх или точнее разность давлений на входе и выходе трубопровода.
Рвх – Рвых = Р (11.1)
Закон Пуазейля устанавливает прямую пропорциональность между расходом жидкости в единицу времени и перепадом давления и обратнопропорциональную зависимость от вязкости и длины трубопровода
V
=
![]() , (11.2)
, (11.2)
где
V
– объем протекшей жидкости за время t,
R
– радиус трубы,
- длина трубы,
- динамическая вязкость []
= Па с =![]() .
.
Заметим, что это выражение характерно для ламинарного течения (слои движутся с различными скоростями).
Различают еще и кинематическую вязкость
![]() ,
(11.3)
,
(11.3)
где – плотность жидкости.
Напомним еще об одном важном параметре жидкости, движущейся по трубопроводу – числе Рейнольдса
Rе
=![]() ,
,
где – скорость движения среды относительно стенок трубопровода.
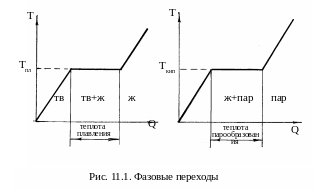 При
малой скорости, т.е. малом числе Rе,
течение жидкости или газа будет
ламинарным. Вспомним также из курса
физики о тройной точке, которая
характеризует фазовое состояние
вещества. На диаграммах рис. 11.1 изображен
фазовый переход «твердое тело – жидкость»
и «жидкость – пар» при изменении только
одного параметра – количества подведенного
тепла. При этом мы отмечали, что критические
температуры Тпл
и Ткип
зависят от давления. Тогда эти
функциональные зависимости, например,
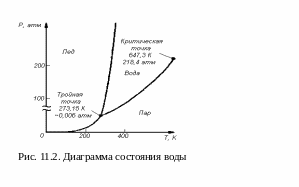
для воды можно представить в виде
графиков Р – Т (рис. 11.2).Видно, что три
кривые сходятся в одной точке, так
называемой тройной точке.
При
малой скорости, т.е. малом числе Rе,
течение жидкости или газа будет
ламинарным. Вспомним также из курса
физики о тройной точке, которая
характеризует фазовое состояние
вещества. На диаграммах рис. 11.1 изображен
фазовый переход «твердое тело – жидкость»
и «жидкость – пар» при изменении только
одного параметра – количества подведенного
тепла. При этом мы отмечали, что критические
температуры Тпл
и Ткип
зависят от давления. Тогда эти
функциональные зависимости, например,
для воды можно представить в виде
графиков Р – Т (рис. 11.2).Видно, что три
кривые сходятся в одной точке, так
называемой тройной точке.
Так ведут себя почти все известные вещества при изменении их агрегатного состояния.
11.1 Свойства криогенных жидкостей
К основным низкотемпературным жидкостям можно отнести жидкости, приведенные в табл. 1, где представлены основные их параметры.
Таблица 1
Параметр |
О2 |
N2 |
Н2 |
4Не |
3Не |
Плотность газа, кг/м3 |
1,429 |
1,250 |
0,090 |
0,178 |
0,134 |
Температура кипения, К |
90,14 |
77,36 |
20,38 |
4,215 |
3,195 |
Температура плавления, К |
54,4 |
63,2 |
13,96 |
- |
- |
Плотность жидкости ,кг/м3 |
1142 |
808 |
70,87 |
125 |
59 |
Теплота испарения, Дж/г |
213,5 |
197,5 |
455 |
20,3 |
8,24 |
Теплота плавления, Дж/г |
14,0 |
25,8 |
58,0 |
- |
- |
Объем газа при испарении 1л |
858 |
690 |
845 |
750 |
- |
Кислород. Он имеет три стабильных изотопа с массовыми числами 16,17 и 18 в соотношении 10000:4:20. В жидком и твердом кислороде образуется очень небольшое количество полимера О. Полагают, что поэтому жидкий кислород имеет светло-голубой оттенок. Кислород – химически активный газ, сильный окислитель, поэтому недопустимо его соприкосновение с маслами, жирами, асфальтом, тканями. Кислород также токсичен, граница токсичности находится вблизи концентрации 60 %. Необходимо помнить, что чистый кислород можно использовать для дыхания только при небольших абсолютных давлениях.
Водород. Существуют три изотопа: протий Н с массовым числом 1, дейтерий Д с массовым числом 2 и тритий Т с массовым числом 3. У всех изотопов по 1 электрону и 1 протону. Остальное дополняют нейтроны. В получаемом водороде содержится 99,987 % атомов протия и 0,013 – 0,016 % дейтерия. Так как молекула водорода двухатомная, то часть атомов дейтерия соединена в молекулы с атомами протия. Они образуют так называемый водородный дейтерий НД с содержанием 0,026 – 0,032 % ,имеющий Ткип = 20,13 К. Выделяют его из смеси за счет ректификации.
Различают две модификации водорода: ортоводород (О-Н2), который составляет 75 % от объема и пароводород (п-Н2) – 25 %. Они отличаются направлением вращения ядер, т.е. ядерными спинами. С понижением температуры увеличивается содержание пароводорода и при 20 К равновесный состав водорода практически, как следует из таблицы 2, соответствует парасостоянию.
Таблица 2
Температура, К |
20,39 |
70 |
120 |
200 |
300 |
Доля параводорода, % |
99,8 |
55,88 |
32,96 |
25,97 |
25,07 |
Такой процесс называется орто-парапереходом. Еще один интересный фактор- это нестабильность состава смеси водорода во времени. В начальный момент жидкость имеет состав исходного газообразного водорода. Однако со временем доля молекул параводорода (хn-Н2) увеличивается и через 100 часов его доля достигает 0.595, а 1000 часов (т.е. 40 суток) уже 0,92. Этот процесс сопровождается выделением тепла. Так, при переходе 1 кг∙ моля нормального водорода в параводород при 20 К выделяется 252 ккал. тепла. Поэтому для уменьшения потерь жидкого водорода при хранении необходимо проводить ожижение водорода с ускоренной конверсией в присутствии твердых катализаторов на поверхности катализатора происходит процесс установившийся адсорбции: молекулы ортоводорода, попавшие на поверхность катализатора, покидают его в состоянии парамодификации. Катализаторы: активированный уголь, окислы металлов. Конверсию можно вести на нескольких температурных уровнях. При охлаждении до температуры жидкого азота равновесная концентрация параводорода повышается с 25 % до 50 % (см. таблицу 2). Поэтому охлаждая, например, промежуточную ступень жидким азотом, можно около 1/3 тепла конверсии снять на азотном уровне, где стоимость криоагента для получениях этих температур термодинамически в 5 раз ниже.
Кроме того необходимо отметить еще одну проблему в производстве водорода – проблему очистки газообразного водорода, который при различных способах получения (электролиз воды, железопаровой способ, каталитическая конверсия углеводородов и др.) в лучшем случае содержит 99,5 % водорода и остальное – газообразный кислород, а в худшем случае только 75 ÷ 80 % водорода. Считается, что для нормальной работы ожижителей водорода сырье должно быть очищено до остаточного содержания примесей 10-5÷ 10-6 по объему, но еще более жесткие требования предъявляются к очистке по кислороду, т.к. при длительной работе или самой ожижительной установки или другого агрегата, использующего водород, происходит накопление твердых частиц кислорода, который локально собирается вблизи дроссельного вентиля установки или сопла ракеты. Накопление даже небольшого количества твердого кислорода в среде водорода может привести к взрыву, а значит – разрушению агрегата. Поэтому тонкая очистка водорода от кислорода производится в два этапа. На первом - удаляют основное количество примесей простой конденсацией, а дальнейшая очистка возможна их вымораживанием либо адсорбцией.
Плотность твердой фазы водорода больше на 12% плотности жидкости.
В настоящее время интенсивно развивается ракетная техника с использованием не только жидкого, но и твердого водорода (вернее смеси жидкой и твердой фаз, т.е. "шуги"). Такая смесь обладает значительно большими запасами "холода" – из-за скрытой теплоты плавления твердой фазы.
Гелий. Единственный элементный газ, имеющий отличительные от других газов свойства: при обычных внешних условиях не отвердевает вплоть до 0К. Различают два изотопа 3Не содержащий один нейтрон и 4Не – два нейтрона. Оба изотопа инертны.
Их добывают из природного газа, в котором содержание 4Не достигает величины 1 – 2 % по объему. Для этого используют процесс очистки. В техническом гелии содержание примесей не должно превышать 0,2 %, а в гелии высокой чистоты - 0,015 %. Изотоп же гелий - 3 содержится в смеси с 4Не обычно в соотношении1 : 103 104. Поэтому 3Не чаще всего получают в ядерных реакторах при распаде трития. Диаграммы для 4Не и 3Не в координатах Р – Т приведены на рис. 11.3. Из фазовых диаграмм видно, что как 4Не, так и 3Не могут находиться в трех агрегатных состояниях (на рис.11.3 не показана линия кипения 3Не, но она существует). Для изотопа 4Не жидкая фаза существует в виде двух модификаций гелий I и гелий II. Переход из области нормального состояния (гелий I) в область сверхтекущего состояния гелий II (рис.11.3, а) обычно называют - переходом. Для 3Не также обнаружен - переход (рис. 11.3, б) при температуре 0,003 К и, как правило - переход происходит без скачка изменения плотности, без поглощения или выделения скрытой теплоты, но сопровождается резким изменением теплоемкости гелия. Характерная ситуация: при откачке паров жидкость кипит по всему объему, но остается при этом светлой по цвету и температура постепенно уменьшается. По мере ее уменьшения интенсивность кипения снижается, т.к. уменьшается теплоемкость и, следовательно, меньше требуется отвести тепла и меньше испаряется жидкости.
При ТТ резко возрастает интенсивность кипения, за счет образования пузырьков в объеме жидкость становится малопрозрачной. Затем при 2,17 К для 4Не интенсивность кипения гелий I резко падает и поэтому видимое кипение прекращается, поверхность гелия становится спокойной, значит произошел переход в жидкую фазу Не II. Откачкой паров Не II можно достичь температуры 1 К.
