
- •Н.А. Андреева
- •Введение
- •Сведения о материальных средах
- •1. Системы микрочастиц
- •1.1 Случай классических частиц
- •1.2. Вырожденные коллективы частиц
- •1.2.1. Фермионы
- •1.2.2 Бозоны
- •2. Кристаллические твердые тела
- •2.1 Трехмерные кристаллические системы
- •Индексы Миллера и кристаллографические направления
- •2. 2 Классификация дефектов
- •2.2.2 Дислокации и их движение
- •Плотность дислокаций
- •Взаимодействие дефектов
- •Физические свойства твердых тел
- •3. Тепловые свойства.
- •3.1. Теплоемкость твердого тела
- •3.1.1. Область низких температур
- •Теплоемкость электронного газа
- •3.2. Тепловое расширение твердых тел
- •3.3. Теплопроводность
- •4. Электрические свойства
- •4.1. Дрейф электронов
- •4.2. Время релаксации
- •4.3. Закон Видемана - Франца
- •4.4. Температурная зависимость подвижности носителей
- •4.5. Электропроводность чистых металлов
- •I II III Рис. 4. 4 Температурная зависимость удельного сопротивления металла ост
- •5. Электрон - электронное взаимодействие.
- •5.1. Взаимодействие электронов
- •5.1.1. Какие электроны участвуют во взаимодействии?
- •5.2. Основное состояние сверхпроводника
- •5.2.1. Энергия основного состояния
- •5.3. Энергетическая щель
- •6. Механические свойства.
- •6.1. Деформация растяжения
- •6.1.1. Расчет технической прочности при хрупком разрушении
- •6.2. Пути повышения прочности
- •7. Магнитные свойства твердых тел
- •7.1. Магнетизм веществ
- •7.1.1. Ферромагнетизм
- •7.1.2 Магнитные материалы
- •7.2. Парамагнетизм
- •7.2.1. Теория Ланжевена
- •7.3. Диамагнетизм
- •Получение низких и сверхнизких температур. Низкотемпературные жидкости.
- •8. Физические основы охлаждения.
- •8.1. Изоэнтропное расширение
- •8.2. Дросселирование сжатого газа
- •8.3. Расширение из постоянного объема
- •8.4. Десорбционное охлаждение
- •8.5. Откачка паров кипящей жидкости
- •9. Получение низких температур
- •Конструкция поршневого детандера
- •10. Получение сверхнизких температур
- •10.1 Метод адиабатического размагничивания
- •Криостат
- •10.2. Метод растворения 3Не в 4Не
- •1 0. 3. Метод Померанчука.
- •Энтропия
- •Криостат
- •11. Низкотемпературные жидкости.
- •11.1 Свойства криогенных жидкостей
- •1 1.2. Сверхтекучесть 4Не
- •11.3. Квантовые жидкости
- •11.4. Температурные волны
- •11.5. Квантовая жидкость 3Не
- •Библиографический список
- •Оглавление
8.1. Изоэнтропное расширение
Для понижения температуры необходимо осущетвлять перенос тепла от тела с более низкой температурой, которое надо охладить к телу с более высокой температурой а для этого требуется совершить работу. Как следует из второго закона термодинамики понижение температуры системы сопряжено с изменением параметров ее состояния. Запишем выражение связывающее температуру с энтропией и параметром состояния в следующем виде
s = f (T, х) (8.4)
где х – параметр состояния, в разных системах он различен: для термодинамической системы, это давление, для магнитной – напряженность магнитного поля (Н), для электрических диполей – напряженность электрического поля (Е).
Для
термодинамической системы, которая
описывается выражением (8.4) является
обязательным условием процесса
охлаждения. Оно может служить основой
для анализа самого процесса охлаждения.
Графически зависимость (8.4) s
-Т можно 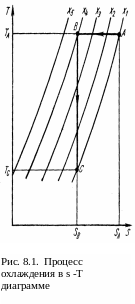 представить,
как показано на рис. 8.1.
представить,
как показано на рис. 8.1.
![]() изотермическое сжатие
изотермическое сжатие
![]() (для термомеханической системы
(для термомеханической системы
![]() ).
Отвод тепла
).
Отвод тепла
![]() .
Затем, теплоизолируя систему, (изоэнтропный
процесс), возвратим параметр s
к исходному значению x,
(процесс
.
Затем, теплоизолируя систему, (изоэнтропный
процесс), возвратим параметр s
к исходному значению x,
(процесс
![]() адиабатического расширение). Происходит
качественное перераспределение энтропии
и в результате температура падает.
адиабатического расширение). Происходит
качественное перераспределение энтропии
и в результате температура падает.
Итак, только уменьшая энтропию, можно обеспечить понижение температуры, а для этого нужны некие физические методы.
Исходя из общего соотношения, связывающего температуру с энтропией и параметром состояния x, как записано в уравнении (8.4), и отождествляя х с давлением р x = p, запишем
![]() .
(8.5)
.
(8.5)
Дифференцируя (8.5) по Т и р получим
![]() .
(8.6)
.
(8.6)
Для рассматриваемого процесса ds = 0 и тогда из уравнения (8.6) получим
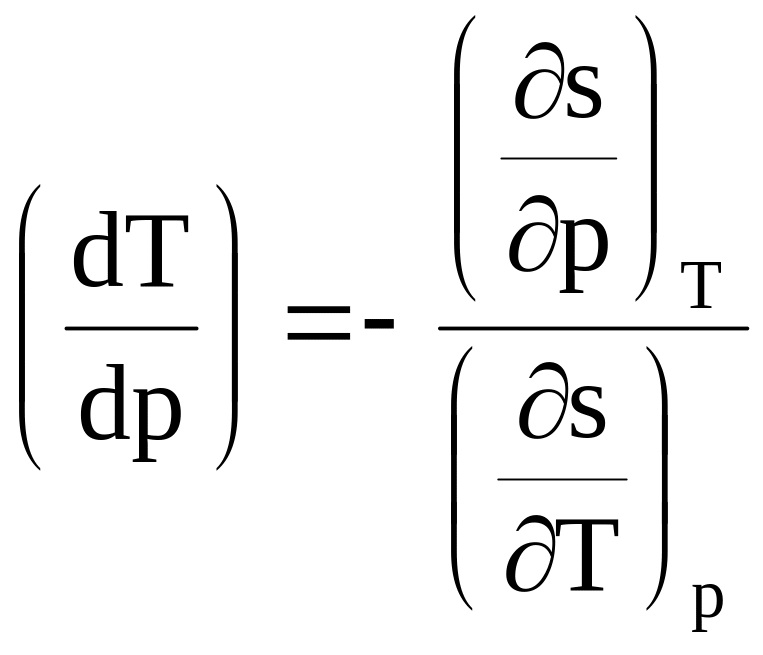 (8.7)
(8.7)
Для изобарного процесса
![]()
запишем
![]() .
(8.8)
.
(8.8)
Используя
выражения термодинамического потенциала
![]() ,
дифференциал которого
,
дифференциал которого
![]() ,
запишем
,
запишем
![]() ,
(8.9)
,
(8.9)
подставляя (8.9) и (8.8) в уравнение (8.7) получим
![]() .
(8.10)
.
(8.10)
Величина
s
характеризует интенсивность охлаждения
в процессе изоэнтропного расширения и
называется дифференциальным эффектом
процесса. Всегда
![]() больше
нуля. Конечное изменение температуры
в этом процессе может быть найдено с
помощью s
-T диаграммы ΔТ = ТА-Тс
(рис. 8.1) или аналитически, интегрированием
уравнения (8.9).
больше
нуля. Конечное изменение температуры
в этом процессе может быть найдено с
помощью s
-T диаграммы ΔТ = ТА-Тс
(рис. 8.1) или аналитически, интегрированием
уравнения (8.9).
 Осуществляется
такой процесс в различного типа
детандерах. Необходимо помнить, что в
реальных условиях эксплуатации существует
небольшая по величине необратимость,
что и дает меньший эффект охлаждения.
К.П.Д. процесса определяется как отношением
величины понижения энтальпии газа от
начальной iн
до конечной (iк)
точек, т.е. Δi
= iн
– iк
к понижению энтальпии Δiuд
при идеальном обратимом расширении
Осуществляется
такой процесс в различного типа
детандерах. Необходимо помнить, что в
реальных условиях эксплуатации существует
небольшая по величине необратимость,
что и дает меньший эффект охлаждения.
К.П.Д. процесса определяется как отношением
величины понижения энтальпии газа от
начальной iн
до конечной (iк)
точек, т.е. Δi
= iн
– iк
к понижению энтальпии Δiuд
при идеальном обратимом расширении
о
=
![]()
Величина о зависит от типа детандера и условий его работы и обычно он составляет 0,85 ÷ 0,6..
8.2. Дросселирование сжатого газа
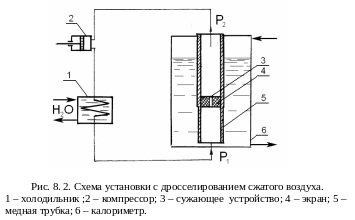
В основе этого процесса изменения температуры лежит эффект, обнаруженный Джоулем и Томсоном. Этот процесс протекает как без теплообмена, так и без совершения внешней работы. Он осуществляется при движении потока газа через сужающее устройство, где и происходит падение давления. Схема установки представлена на рис. 8.2. Компрессор 2 сжимает рабочий газ до давления р1, который охлаждается в холодильнике 1 проточной водой. Далее газ поступает в калориметр 6 по медной трубке 5, где установлено сужающее устройство 3,изолированное экранами 4. В опытах Джоуля и Томсона сужающим устройством служила вата, а экраны изготовлялись из резины. С помощью термометров измеряли температуры на входе Т1 и на выходе Т2, а манометры позволяли определять перепад давления р = р1- р2 между входом газа и его выходом. Устанавливался ламинарный режим течения в местах, достаточно удаленных от сужающего устройства. Работа, связанная с продавливанием газа, рV определяет изменение внутренней энергии U до и после сужающего устройства (изменением кинетической энергии пренебрегаем)
![]()
или перепишем
![]() ,
,
т.е. энтальпии будут равными
i1 = i2 = const.
Определим дифференциальный эффект охлаждения (эффект Джоуля-Томсона) в этом процессе. Для этого используем
d i = Тds + Vdp (8.11)
и подставляя значения для ds из (8.6) в (811) с учетом, что di=0, получим
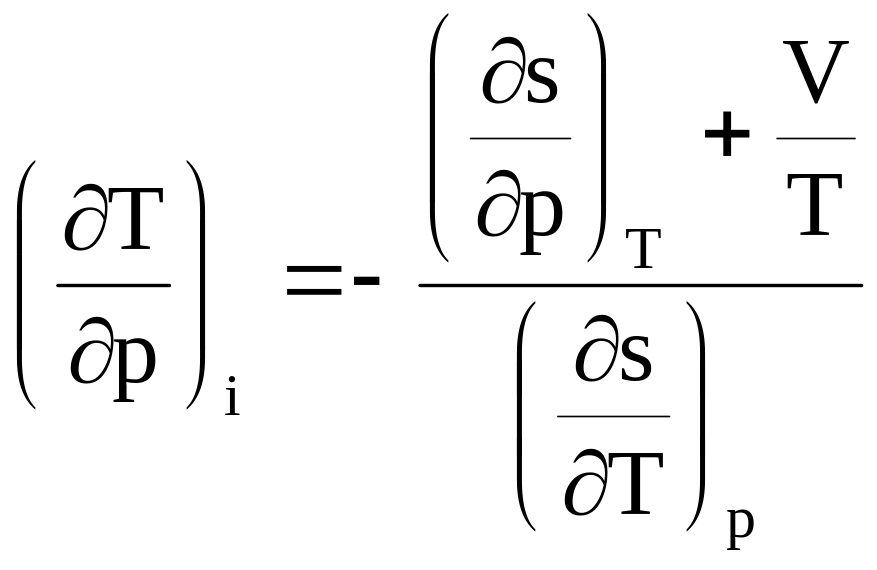 ,
,
используя выражения (8.8) и (8.9) окончательно получим
![]() .
(8.12)
.
(8.12)
Дифференциальный
эффект Джоуля-Томсона (![]() )
также характеризует интенсивность
изменения температуры. Это изменение
температуры является следствием затраты
работы на преодоление сил межмолекулярных
внутренних связей.
)
также характеризует интенсивность
изменения температуры. Это изменение
температуры является следствием затраты
работы на преодоление сил межмолекулярных
внутренних связей.
Как следует из формулы (8.12) знак может быть как отрицательным, так и положительным, то есть – дросселирование может сопровождаться охлаждением или нагреванием рабочей среды. Изменение знака следует из условия =0
Из уравнения
рV = RT
получаем
![]() .
.
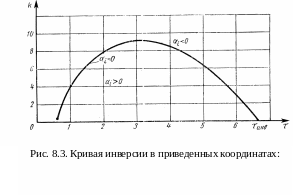
Кривая
инверсии гелия (рис. 8.3) разграничивает
области положительного и отрицательного
эффектов Джоуля Томсона. При
![]() =0
существует температура инверсии
=0
существует температура инверсии
![]() выше которой
всегда отрицательно и охлаждение
получить невозможно. Все газы могут
быть разделены на две группы: газы, у
которых Тинв>Тсреды
и газы для которых, где Тинв<Тсреды.
У гелия Тинв
40 К, а у водорода Тинв
= 204,6 К. При этом температура кипения
жидкого водорода 20.4 К при атмосферном
давлении и за счет уменьшения давления
паров до 54 мм рт.ст может быть понижена
до 14 К. При более низких давлениях, в
отличии от гелия, водород переходит в
твердую фазу (Тк
= 13,95 К).
выше которой
всегда отрицательно и охлаждение
получить невозможно. Все газы могут
быть разделены на две группы: газы, у
которых Тинв>Тсреды
и газы для которых, где Тинв<Тсреды.
У гелия Тинв
40 К, а у водорода Тинв
= 204,6 К. При этом температура кипения
жидкого водорода 20.4 К при атмосферном
давлении и за счет уменьшения давления
паров до 54 мм рт.ст может быть понижена
до 14 К. При более низких давлениях, в
отличии от гелия, водород переходит в
твердую фазу (Тк
= 13,95 К).
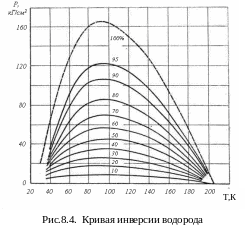
Кривая инверсии водорода показана на рис. 8.4. (пунктирной линией) в координатах абсолютное давление – температура. Сплошные линии соответствуют доле производительности в этом цикле по отношению к 100 %, взятым на кривой инверсии.
Наибольший эффект охлаждения при заданной температуре наблюдается при условии, если за начальное давление процесса принять давление, соответствующее точке на кривой =0, т.е. давление инверсии р = ринв.
 Тепловой
эффект процесса характеризуется
разностью энтальпий в точках,
соответствующих начальному и конечному
давлению при Т= const
Тепловой
эффект процесса характеризуется
разностью энтальпий в точках,
соответствующих начальному и конечному
давлению при Т= const
![]() . (8.13)
. (8.13)
Эта величина называется изотермическим эффектом дросселирования.
