
Учебное пособие 2150
.pdf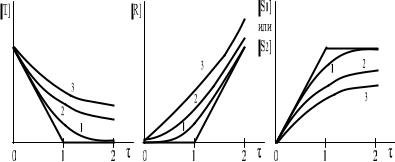
Линейные кривые получают в системе координат, в которой на оси ординат отложены равновесные концентрации (рис. 6). Для реакции, равновесие которой изображается следующем образом:
T + R↔ S1 + S2, kравн = 


 ∙
∙


 /(CT ∙CR),
/(CT ∙CR),
линейные кривые титрования представляют собой две пересекающиеся в точке стехиометричности прямые. Линейные кривые получаются такими, когда на оси ординат откладывают величины, пропорциональные концентрации CT - это CR, CS1 или CS2. Округление кривой титрования связано с тем, что с уменьшением kравн, увеличиваются количества непрореагиро-вавших веществ.
Рис. 6. Линейные кривые титрования: 1- kравн = 102; 2 - kравн = 10
Монологарифмические кривые получают, если на оси ординат откладывают логарифмы от равновесных концентраций реагирующих веществ или продуктов реакции (рис. 7). Можно откладывать величины, пропорциональные логарифмам, например отрицательные логарифмы: pH= - lg
C H , 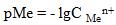 .
.
81
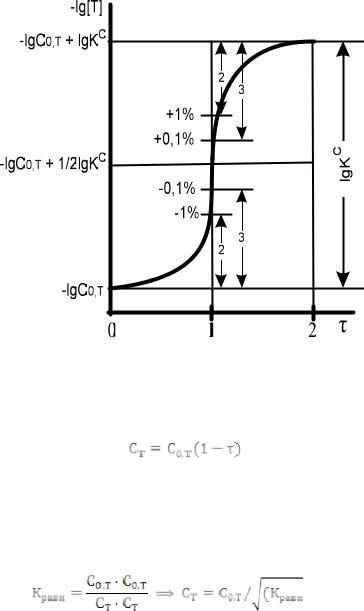
Рис. 7. Монологарифмическая кривая титрования для реакции T + R ↔ S1 + S2
До точки эквивалентности концентрацию определяемого вещества Т вычисляют по формуле:
|
, |
где |
С0,T – начальная концентрация вещества, 1- – |
недотит-рованная доля этого вещества. Логарифм концентрации титруемого вещества Т равен:
рТ = -lgCT = -lgC0,T - lg(l -  ), пределы O <
), пределы O < <1.
<1.
В точке эквивалентности CT = CR и концентрация растворимых продуктов равны С0,T:
82

τ = 1; pT = - lgC0,T + 1/2∙lgKравн
После точки эквивалентности реагент, вводимый в
титрируемый раствор, на химическое взаимодействие с определяемым веществом больше не расходуется. Происходит его накапливание, и концентрацию реагента можно вычислить
по формуле: |
|
|
|
|
– |
CR = C0,R( -1), |
|
де CO R |
концентрация реагента; |
- 1 – доля избытка |
|
реагентаг , . |
|
|
|
При этом концентрации продуктов реакции принимают |
|||
равными С0,Т. Если C0,Т = C0,R , получают: |
|||
|
|
Кравн.= (С0,Т ∙С0,Т)/ (Ст ∙C0,Т ( -1)) ; |
|
|
|
СТ = С0,Т /Кравн.( |
-1); |
|
|
>1; рТ = -lgC0,T + lgKравн. + lg ( -1) |
|
Подставляя в формулы различные значения , получают соответствующие значения рТ, необходимые для построения кривой титрования.
Логарифмические кривые титрования имеют две пологие ветви, между которыми находится крутая часть кривых, которая называется скачком кривой титрования. Величина скачка увеличивается с увеличением численного значения
lgKравн.
Точкой начала скачка считают точку кривой титрования при  = 0,999 (недотитрован 0,1 % определяемого вещества), а точкой конца скачка – точку при = 1,001 (в избытке добавлено 0,1 % от стехиометрического количества реагента).
= 0,999 (недотитрован 0,1 % определяемого вещества), а точкой конца скачка – точку при = 1,001 (в избытке добавлено 0,1 % от стехиометрического количества реагента).
На рис. 7 видно, что монологарифмическая кривая имеет
величину скачка: погрешность до ± 0,1 % - pT = lgКравн. -6. Когда lgКравн. уменьшается до 6, точка начала и точка конца скачка сливаются, и величина скачка становится равной нулю. Чтобы погрешности, возникающие вследствие несовпадения точки конца титрования с точкой стехиометричности, не превысили ±0,1 %, должно соблюдаться условие:
lg Кравн. 6 или Кравн. 106,
83
поэтому титрование прекращают в пределах скачка кривой титрования. Нахождение скачка и точки эквивалентности осуществляют с помощью индикаторов или с помощью физико-химических методов анализа, позволяющих определить сигнал, свидетельствующий о том, что скачок и точка эквивалентности достигнуты. На достижение скачка указывает изменение цвета раствора, появление осадка, достижение определенного значения окислительновосстановительного потенциала.
Таким образом, ошибки титрования возникают из-за неадекватности изменения физического свойства окраски и способности человеческого глаза наблюдать его, отсюда возникает разность объёмов в точке эквивалентности и конечной точке титрования. Титриметрический анализ дает менее точные результаты (его ошибка составляет ± 0,1 %), чем гравиметрический анализ, но важным его преимуществом является большая скорость выполнения анализа.
Титриметрические методы классифицируют по типу используемых химических реакций. Эти реакции могут быть реакциями обмена протонами, электронами, образования малодиссоциированных (комплексных) частиц или образования малорастворимых электролитов (табл. 10). Соответствующие группы титриметрических методов называют кислотно-основным титрованием (протолитометрией), окислительно-восстановительным титрованием (редоксиметрией), комплексометрическим титрованием (комплексометрией) и осадительным титрованием (седиметрией). Отдельные титриметрические методы называются по реагентам, применяемым в этих методах (табл. 10).
84
Таблица 10 Классификация титриметрических методов
Группы |
Подгру |
Отдельные |
Вещества, |
Определяемое |
|
||
методов |
ппы |
методы |
обычно |
вещество |
|
||
|
методо |
|
применяемы |
прямым |
|
|
|
|
в |
|
е |
для |
методом |
|
|
|
|
|
приготовлен |
|
|
|
|
|
|
|
ия титрантов |
|
|
|
|
Кислотно- |
Ациди- |
- |
HCl, H2SO4, |
Основания |
|
||
основное |
метрия |
|
NaOH |
кислоты |
|
|
|
титровани |
|
|
|
|
|
|
|
е |
Алкали |
|
|
|
|
|
|
|
метрия |
|
|
|
|
|
|
Окислите |
Оксиди |
Перманганато |
|
KMnO4 |
Восстановители |
||
льно- |
метрия |
метрия |
|
|
|
|
|
восстанов |
|
Иодометрия |
|
I2 |
Восстановители |
||
ительное |
|
Дихроматомет |
|
K2Cr2O7 |
Восстановители |
||
титровани |
|
рия |
|
|
Восстановители |
||
е |
|
Бромометрия |
|
KBrO3 |
Восстановители |
||
|
|
Иодатометрия |
|
KIO3 |
Восстановители |
||
|
|
Цериметрия |
|
Ce(SO4)2 |
Восстановители |
||
|
|
Ванадометрия |
|
NH4VO3 |
|
|
|
|
Редуци |
Титанометрия |
|
TiCl3 |
Окислители |
|
|
|
метрия |
Хромометрия |
|
CrCl2 |
Окислители |
|
|
|
|
|
|
|
|
|
|
Комп- |
- |
Меркуриметри |
|
Hg(NO3)2 |
Галогениды |
и |
|
лексо- |
|
я |
|
|
псевдогалогенид |
||
метри- |
- |
Цианидометри |
|
KCN |
ы |
|
|
ческое |
|
я |
|
|
Ионы:Ni2+,Co2+, |
|
|
титрова- |
Хелато- |
Комплексоно- |
Комплексон |
Al3+, |
Zr4+,Th4+ |
||
ние |
метрия |
метрия |
|
III |
Ионы металлов |
|
|
Осадитель |
- |
Аргентометри |
|
AgNO3 |
Галогениды |
и |
|
ное |
|
я |
|
|
псевдогалогенид |
||
титрова- |
|
|
|
|
ы |
|
|
ние |
|
Меркурометри |
|
Hg2(NO3)2 |
Хлориды |
|
|
|
|
|
|
||||
|
|
я |
|
|
|
|
|
85

Лекция № 7 Сущность метода кислотно-основного взаимодействия
Метод кислотно-основного титрования или нейтрализации основан на взаимодействии катионов водорода и гидроксид-анионов с получением малодиссоциируемых молекул воды:
Метод протолитометрии позволяет определять в растворах концентрацию кислот, щелочей, гидролизующихся кислых и щелочных солей типа Na2CO3 , NH4Cl.
Для определения в растворах концентрации щелочей и солей, дающих при гидролизе щелочную реакцию,
используют титрованные растворы кислот HCl и H2SO4: H3O+ + OH- ↔2 H2O.
Определяемое вещество Реагент
Эти определения называют ацидиметрией. Концентрацию кислот или кислых солей определяют с помощью титрованных растворов щелочей: NaOH или КОН.
Эти определения называют алкалиметрией:
ОН- + H3O+ ↔ 2 Н2O
Определяемое Реагент
вещество
Из уравнения диссоциации воды Н2O ↔ Н+ + ОН- видно, что в чистой воде концентрация ионов Н+ и ОН- равны. Так как ионное произведение воды равно:







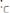





















 .
.
Растворы, в которых концентрация ионов водорода равна 10-7 моль/л, называются нейтральными растворами, для
них 








 . Растворы, в которых концентрация ионов Н+ больше, чем 1∙10-7 моль/л:
. Растворы, в которых концентрация ионов Н+ больше, чем 1∙10-7 моль/л: 



 > 1∙10-7 моль/л, а
> 1∙10-7 моль/л, а 



 < 1∙10-7 моль/л, а
< 1∙10-7 моль/л, а 










 , называют кислыми. Растворы, в
, называют кислыми. Растворы, в
86
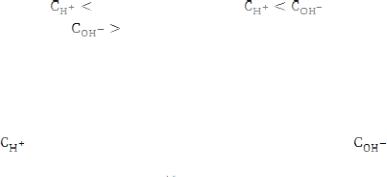
которых концентрация ионов водорода меньше, чем 1∙10-7
моль/л: |
1∙10-7 моль/л, а |
, |
называют |
щелочными |
1∙10-7. |
|
|
Для характеристики степени |
кислотности |
растворов |
|
удобнее применять десятичные логарифмы концентраций водородных и гидроксидных ионов, взятых с обратным знаком. Эти величины названы ионными показателями и обозначены Р, соответственно: водородный показатель – pH =
-lg , |
и гидроксидный показатель – pOH = -lg |
. С |
|||
учетом, |
что |
ионное |
произведение |
воды |
равно |
























 , имеем lg
, имеем lg

 + lg
+ lg



 = -14 или pH + pOH = 14.
= -14 или pH + pOH = 14.
Кислотность растворов можно охарактеризовать количественно через величину рН:
1.Нейтральный раствор рН=7,0.
2.Кислый раствор рН<7,0.
3.Щелочной раствор рН>7,0.
При нейтрализации сильной кислоты сильным основанием и наоборот: HCl + NaOH = NaCl + H2O образуется только один слабый электролит - Н2O. Реакция практически идет до конца. Образующаяся при реакции соль гидролизу не подвергается, и раствор имеет нейтральную реакцию рН = 7,0 в точке эквивалентности.
Если титровать сильной щелочью слабую кислоту:
СН3СООН + NaOH CH3COONa + Н2O в точке эквивалентности присутствует соль, подвергающаяся гидролизу:
CH3COONa + Н2O СН3СООН + NaOH.
Протекающая в данном случае реакция обратима. В точке эквивалентности в растворе присутствуют свободные CH3COOH и NaOH. Слабая СН3СООН будет находиться в растворе в виде недиссоциированных молекул, a NaOH будет полностью диссоциирован. Концентрация ионов ОН-
87
превысит концентрацию ионов Н+ и титрование закончится при рН>7,0.
При титровании слабых оснований сильными кислотами: NH4OH + НСl NH4Cl + Н2O, образующаяся соль подвергается гидролизу. Реакция нейтрализации обратима, и в точке эквивалентности концентрация ионов Н+ превысит концентрацию ионов ОН-. Титрование закончится при рН<7,0.
Основное уравнение процесса нейтрализации –
взаимодействие: |
|
Титранты метода - |
. Эти |
вещества не соответствуют требованиям, предъявляемым к стандартным веществам, поэтому их концентрацию
определяют по первичным стандартам. |
|
|
|
Первичные |
стандартные |
вещества |
должны |
удовлетворять следующим основным требованиям: высокая чистота (Х.Ч. или Ч.Д.А.); устойчивость на воздухе; отсутствие гигроскопической влаги (должны быть негигроскопичны); большая молярная масса эквивалента (что уменьшает ошибку взвешивания); доступность; отсутствие
токсичности. В |
качестве |
таковых |
выступают: бура |
, |
сода |
, |
щавелевая кислота |

















 . Сами титранты – вторичные стандарты. Методы нейтрализации позволяют определять кислоты,
. Сами титранты – вторичные стандарты. Методы нейтрализации позволяют определять кислоты,
гидроксиды, соли, гидролизующиеся по катиону (аниону), и другие вещества, реагирующие в стехиометрических соотношениях с кислотами и гидроксидами, а также различные смеси.
Процесс нейтрализации можно представить графически в виде кривой титрования, изображающей изменение рН титруемого раствора по мере добавления к нему стандартного раствора кислоты или щелочи. На основании кривых
88

титрования проводят выбора индикатора, что является самым важным в методе нейтрализации. Момент эквивалентности устанавливают индикаторным методом по изменению окраски индикатора, 1-2 капли которого добавляют в титруемый раствор. Резкое изменение рН вблизи ТЭ называется скачком
титрования.
Индикаторы метода нейтрализации Индикаторы – это сложные органические кислоты или
гидроксиды, при диссоциации которых происходит изменение структуры их молекул, появление или исчезновение хромофорных групп.
Область значений рН, в которой индикатор изменяет свою окраску, называется интервалом перехода индикатора. Его можно рассчитать по формуле:
Вместо интервала перехода окраски индикатора пользуются также показателем титрования индикатора (рТ).
рТ – это оптимальное значение рН титруемого раствора, при котором наблюдается наиболее резкое изменение окраски индикатора, свидетельствующее об окончании титрования. Значения величины рТ приблизительно совпадают со значениями величин рКинд. Практически индикаторы применяли давно, но первая попытка в объяснении их действия была сделана в 1984 году Оствальдом, создававшим так называемую ионную теорию.
1. Согласно этой теории индикаторы имеют различную
окраску в молекулярном и ионном состояниях: |
|
|||
|
окраска 1 |
окраска 2 |
|
|
При |
изменении |
[H+] |
равновесие |
смещается |
















 .
.
Интервал перехода индикаторов зависит от рК, то чем более сильная кислота HInd, тем в более кислой области находится интервал перехода индикатора (табл. 11).
89

Таблица 11 Интервалы перехода некоторых индикаторов
Инди |
рТ |
Интервал |
Окраска в средах |
|
|
|
катор |
|
перехода |
|
|
|
|
|
нейтрал |
кисла |
щелочн |
|
||
|
|
рН |
|
|||
|
|
|
ьная |
я |
ая |
|
Лакм |
7 |
5,0 - 8,0 |
фиолето |
красн |
синий |
- |
ус |
|
|
вый |
ый |
|
|
Фено |
9 |
8,0 -10,0 |
бесцвет |
бесцве |
малино |
9,2 |
л- |
|
|
ный |
тный |
вый |
|
фтал |
|
|
|
|
|
|
еин |
|
|
|
|
|
|
Мети |
4 |
3,1- 4,4 |
оранжев |
красн |
желтый |
3,7 |
ло- |
|
|
ый |
ый |
|
|
ранж |
|
|
|
|
|
|
Мети |
5 |
4,4 - 6,2 |
красны |
красн |
желтый |
5,1 |
ловы |
|
|
й |
ый |
|
|
й |
|
|
|
|
|
|
красн |
|
|
|
|
|
|
ый |
|
|
|
|
|
|
2. Согласно хромофорной теории (Ганч), изменение окраски индикаторов связано с обратимой перегруппировкой атомов в молекуле органического соединения. Такая обратимая перегруппировка в органической химии называется таутомерией. Если в результате таутомерного изменения строения в молекуле органического соединения появляются особые группировки, называемые хромофорами, то органическое вещество приобретает окраску. Когда таутомерное превращение ведет к изменению строения хромофора – окраска изменяется; если же после группировки
90
