
Учебное пособие 2150
.pdf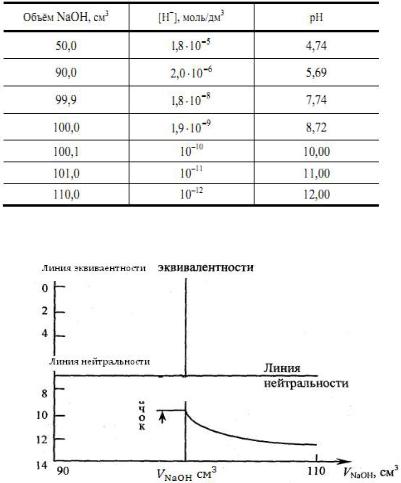
Результаты титрования CH3COOH раствором NaOH представлены в табл. 16.
Таблица 16 Данные для построения кривой титрования CH3COOH
раствором NaOH
На основе этих данных строят кривую титрования
CH3COOH раствором NaOH, рис. 10.
Рис. 10. Общий вид кривых тирования слабой кислоты раствором сильного основания
101

Анализ кривой титрования:
–ТЭ находится в щелочной среде рН = 8,72;
–исходная точка титрования находится в менее кислой
среде, чем при титровании сильной кислоты;
–скачок титрования невелик (7,74 - 10,00); при титровании следует использовать в качестве индикатора фенолфталеин;
–кривая несимметрична по отношению к линии нейтральности.
Величина скачка титрования зависит от концентрации и температуры, а также константы диссоциации кислоты. Если
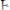
 меньше 10-7, вообще эту кислоту оттитровать раствором щелочи нельзя, так как почти нет скачка титрования.
меньше 10-7, вообще эту кислоту оттитровать раствором щелочи нельзя, так как почти нет скачка титрования.
Ошибки кислотно-основного титрования
Результаты определения содержания какого-либо компонента при проведении количественного анализа всегда отличаются от его истинного значения. Эти ошибки могут быть как случайными, так и систематическими и имеют различную природу.
1. Субъективные ошибки обусловлены несовершенством измерительных приборов и глаза, неточностью взвешивания. Для уменьшения этих ошибок следует пользоваться градуированной измерительной посудой (бюретки, пипетки, мерные колбы). Расход титранта
вбюретке должен быть не менее 15 – 25 см3.
2.Индикаторные ошибки. Иногда индикаторную
ошибку титрования называют просто ошибкой титрования, величина, найденная в конечной точке, за вычетом величины, отвечающей точке эквивалентности. Такое определение универсально и справедливо для всех титриметрических методов. Эти ошибки обусловлены тем, что титрование должно быть закончено при pH = 7, а практически при использовании индикаторов оно заканчивается либо в кислой, либо в щелочной средах.
102
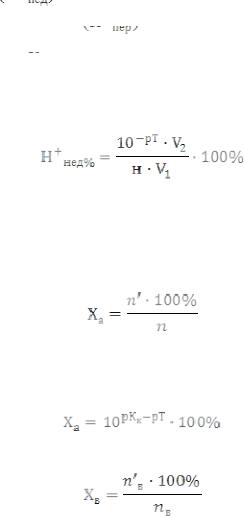
3. Водородная (протонная) ошибка титрования обусловлена недотитрованием сильной кислоты сильной
щёлочью 

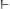






 или перетитрованием сильного основания сильной кислотой
или перетитрованием сильного основания сильной кислотой 






 . Эта ошибка обусловлена
. Эта ошибка обусловлена
присутствием 

 - ионов в конечной точке титрования. При
- ионов в конечной точке титрования. При
титровании сильной кислоты (0,1 Н HCl) сильным основанием (0,1 Н NaOH) с метиловым оранжевым с pT = 4, титрование заканчивается при pH = 4 (в кислой среде). При начальном объёме (V1) и конечном объёме (V2):
Гидроксильная ошибка обусловлена недотитрованием сильного основания сильной кислотой (отрицательная ошибка) или перетитрованием сильной кислоты сильным основанием (положительная ошибка).
Кислотная ошибка обусловлена присутствием в растворе недотитрованной слабой кислоты в КТТ:
где 
 – количество недотитрованной слабой кислоты;
– количество недотитрованной слабой кислоты;  –
–
общее количество кислоты в растворе. В упрощённых расчётах используют формулу:
Основная ошибка – обусловлена присутствием в растворе недотитрованного слабого основания в КТТ:
103

где 

 – количество недотитрованного слабого основания;
– количество недотитрованного слабого основания; 
 – общее количество слабого основания. Приближённая формула для расчёта основной ошибки:
– общее количество слабого основания. Приближённая формула для расчёта основной ошибки:
4. Другие ошибки. Индикатор, являясь амфолитом, реагирует с исследуемым веществом или титрантом, что зависит от его концентрации и pH раствора. Для учёта подобных ошибок проводят контрольный (холостой опыт).
Лекция № 9 Редоксиметрия. Сущность и аналитические возможности
методов. Кривые титрования. Перманганатометрия. Йодометрия. Окислительно-восстановительное (RED-OX) титрование
Методы окислительно-восстановительного (ОВ) титрования или Red-Ox методы – это титриметрические методы, основанные на использовании окислительновосстановительных реакций. Обычно их классифицируют следующим образом.
1.По характеру титранта:
–оксидиметрические – методы определения
восстановителей с применением титранта-окислителя;
–редуктометрические – методы определения окислителя с применением титранта-восстановителя.
2.По природе реагента (титранта), взаимодействующего
сопределённым веществом:
–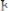





 – перманганатометрия;
– перманганатометрия;
–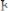





 – броматометрия;
– броматометрия;
–KI, 









 – йодометрия;
– йодометрия;
104

–

 – йодиметрия;
– йодиметрия;
–

 – бромометрия;
– бромометрия;
–










 – цериметрия.
– цериметрия.
Условия проведения окислительно-восстановительного
титрования
Реакция должна протекать практически до конца. ОВ реакция идёт тем полнее, чем больше константа равновесия, которая определяется соотношением:
Если 


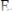
 – стандартные ОВ потенциалы окислителя и восстановителя;
– стандартные ОВ потенциалы окислителя и восстановителя; 
 – число электронов, отдаваемых
– число электронов, отдаваемых
восстановителем окислителю. При значении K >> 108 реакция протекает не менее чем на 99,99 %. Реакция должна протекать быстро. Для ускорения реакции растворы иногда нагревают или проводят титрование в присутствии катализатора. Реакция должна протекать стехиометрически, побочные процессы должны быть исключены. Конечная точка титрования (КТТ) должна определяться точно и однозначно либо с индикаторами, либо без них. В ОВР титровании применяется прямое, обратное и заместительное титрование. Уравнение Нернста для обратимой Red-Ox системы, выражается уравнением:
аOкисл + nē ↔ bВосст
Величина ОВ потенциала (Е) определяется уравнением:
где Е – окислительно-восстановительный потенциал, В; Е0 – стандартный ОВ потенциал, В; R – универсальная газовая
105
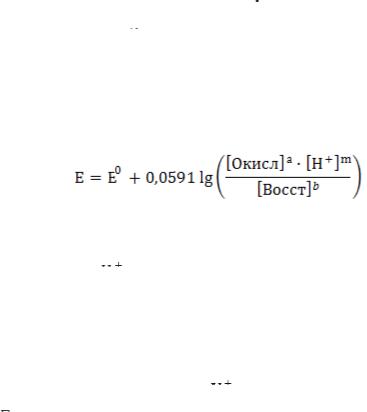
постоянная, равная 8,31 Дж/(моль град); Т – абсолютная температура, К;  – число электронов, участвующих в
– число электронов, участвующих в
реакции; F – число Фарадея, равное 96485 Кл; [Окисл] – концентрация окисленной формы, моль/дм3; [Восст] – концентрация восстановленной формы, моль/дм3.
Если заменить константы их числовыми значениями и перейти от ln к lg, то при Т = 298 К (25 °С) уравнение примет вид:
Таким образом, потенциал ОВ системы зависит от природы реагирующих веществ (E0), температуры, концентрации окисленной и восстановленной форм, а также
концентрации 

 катионов.
катионов.
Значение стандартных ОВ потенциалов приведены в справочных таблицах. В табл. 17 приведены ОВ потенциалы некоторых систем.
Окислитель – вещество с большим значением E0. Меняя соотношение концентраций окисленной и восстановленной
форм, а также концентрацию 

 катионов, можно изменить
катионов, можно изменить
 в широких пределах, а, следовательно, направить реакцию в нужную сторону.
в широких пределах, а, следовательно, направить реакцию в нужную сторону.
Все методы окисления-восстановления основаны на окислительно-восстановительных реакциях между анализируемым веществом и титрантом. Названия частных окислительно-восстановительных методов происходит от наименований используемых титрантов. В перманганатометрии титрантом служит раствор перманганата калия KMnO4.
106
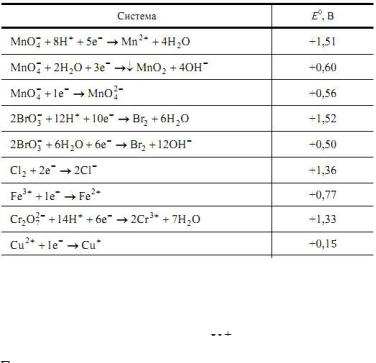
Таблица 17 Значения стандартных окислительно-восстановительных
систем
Окислитель – вещество с большим значением E0. Меняя соотношение концентраций окисленной и восстановленной
форм, а также концентрацию 

 катионов, можно изменить
катионов, можно изменить
 в широких пределах, а, следовательно, направить реакцию в нужную сторону.
в широких пределах, а, следовательно, направить реакцию в нужную сторону.
Все методы окисления-восстановления основаны на окислительно-восстановительных реакциях между анализируемым веществом и титрантом. Названия частных окислительно-восстановительных методов происходит от наименований используемых титрантов. В перманганатометрии титрантом служит раствор перманганата калия KMnO4, играющий в реакциях роль окислителя.
107
Поскольку при окислительно-восстановительных реакциях электроны переходят от одних атомов к другим, вычисляя эквивалентные массы окислителей и восстановителей, исходят из числа электронов, приобретаемых или теряемых в реакции молекулой вещества. При этом учитывают, что атом водорода отдает (Н0 – е → Н+).
При реакции в кислой среде каждая молекула KMnO4 приобретает пять электронов, которые могут быть присоединены пятью ионами Н+. Следовательно, в этой, реакции молярная масса KMnO4 равноценна пяти моль катионов Н+, а эквивалентная масса равна 1/5 молярной массы:










 = (1/5)
= (1/5) 










 = 158,03/5 = 31,61 г/моль.
= 158,03/5 = 31,61 г/моль.
Чтобы найти эквивалентную массу окислителя, нужно его молярную массу разделить на число электронов n, приобретаемых одной молекулой в данной реакции: mэ = M/n.
Эквивалентные массы восстановителей находят делением молярной массы на число электронов (n), теряемых одной молекулой в реакции: mэ = М/n.
При перманганатометрическом титровании анализируемого раствора малино-фиолетовая окраска раствора KMnO4 обесцвечивается. В момент достижения точки эквивалентности, когда в растворе не остается восстановителя от прибавления одной капли KMnO4 титруемая смесь окрашивается в розовый цвет. Индикатором является раствор KMnO4. Окислительные свойства KMnO4 проявляются в кислой, щелочной среде. При титровании кислых растворов перманганат анион MnO4восстанавливается до бесцветных катионов Mn2+:
108
2KMnO4 |
+ 10FeSO4 + 8H2S04 = 5Fe2(SO4)3 + 2MnSO4 |
+ +K2SO4 + 8H2O |
|
2 │ 1 │ |
МnО4- + 8H+ +5e → Mn2++4H2O |
10│ 5 │ Fe2+- e →Fe3+ |
|
При титровании в щелочной или нейтральной среде |
|
анионы |
восстанавливаются только до катионов Мn4+: |
2KMnO4 + Cr2(SO4)3 + 8KOH = 2MnO2 + 2K2CrO4 + 3K2SO4 + +8H2O






 + 2Н20 + 3е →MnO2 + 4OHCr3+ + 8OH- - 3e →
+ 2Н20 + 3е →MnO2 + 4OHCr3+ + 8OH- - 3e →




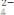 + 4H2O
+ 4H2O
Перманганатометрию чаще всего применяют для анализа солей Fe(II), Са(II), Cu(I), щавелевой кислоты, пероксида водорода.
В основе йодометрии лежат свойства йода и йодид анионов. Элементарный йод ведет себя в реакциях как окислитель: I2 + 2е = 2I-, а йодид-анионы I- отдают свои электроны веществам-окислителям и играют роль восстановителей: 2I- - 2е = I2. Прямое йодометрическое титрование восстановителей основано на их взаимодействии с раствором I2 в присутствии крахмала. Взаимодействие йода с Na2S203 проходит по уравнению:
2Na2S203 + I2 = 2NaI + Na2S406 1 │ 2S2032--2e = S4O62-;
1 │ I2 + 2е = 2I-.
Каждая молекула I2 окисляет два тиосульфат аниона до тетратионат аниона S4062- (тетратионовой кислоты H2S4O6). Сами же атомы I2 восстанавливаются до ионов I-. Точка эквивалентности фиксируется по неисчезающей синей окраске крахмала от одной избыточной капли I2.
С помощью раствора I2 определяют содержание других восстановителей: мышьяковистой, сернистой и сероводородной кислот, их солей, хлорида олова (II).
Определяя окислители, к анализируемому раствору прибавляют избыток йодида калия KI, из которого окислитель выделяет эквивалентное ему количество свободного I2.
109
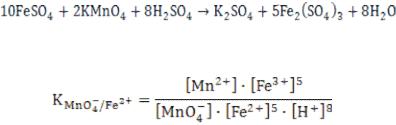
Последний йод оттитровывают раствором восстановителя, например, раствором Na2S203 в присутствии крахмала. Затем вычисляют количество окислителя (раствора КМn04), которое будет эквивалентно количеству Na2S203, пошедшего на титрование I2:
2KMnO4 + 10KI + 8H2SO4 = 5I2 + 2MnS04 + 6K2S04 + 8H2O;
5 |
│ 2 │ MnO4- |
+ 8H+ + 5е = Мn2+ + 4Н20; |
1 |
│10 │ 2I- - 2е = I2. |
|
Этим |
способом |
определяют и другие окислители: |
бихроматы, соли Cu(II), соли Fe(II), свободные галогены. Крахмал, используемый в йодометрии, – специфический
индикатор, образующий с I2 адсорбционное соединение синего цвета. Крахмал прибавляют в самом конце титрования, когда йода становится мало и титруемый бурый раствор становится бледно-желтым. После прибавления крахмала титруют раствор синего цвета до исчезновения окраски.
Кривые окислительно-восстановительного титрования по внешнему виду аналогичны кривым кислотно-основного титрования. Они выражают зависимость степени оттитрованности от потенциала окислительновосстановительной системы; вблизи точки эквивалентности происходит резкий скачок окислительно-восстановительного потенциала.
Константа равновесия окислительно-восстановительных
реакций
Рассмотрим реакцию:
+ 2 MnSO4
Рассчитаем:
110
