
Учебное пособие 2150
.pdf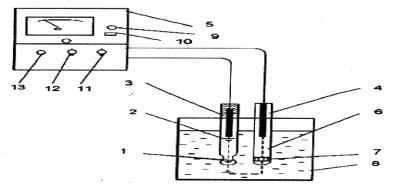
1. Метод градуировочного графика (рис. 25). График пересекается с осью ЭДС как в положительной, так и отицательной области. Точка пересечения соответствует
значению Е0 индикаторного электрода при этих условиях. В зоне очень высоких и очень низких концентраций может наблюдаться отклонение от линейности (в области нелинейности графика работать нельзя).
2.Расчет по уравнению Нернста используют только при стандартных условиях: Т = 293 К, Р = 1 атм, С = 1 моль/дм3.
3.Метод добавок (применяют для увеличения концентрации в сильно разбавленных растворах).
Рис. 25. Схема измерения рН раствора на приборе типа рН-673 М: 1 – полый шарик из электродного стекла; 2 – стеклянный электрод; 3 – внутренний контактный электрод; 4 – вспомогательный электрод; 5 – рН-метр;
6 – электролитический контакт; 7 – пористая перегородка; 8 – ванна для испытуемого раствора; 9 – индикатор;
10 – кнопка включения прибора; 11 – ручка переключателя рода работ; 12 – ручка переключателя диапазона измерения; 13 – ручка потенциометра температурной компенсации
Косвенная потенциометрия (титрование)
161
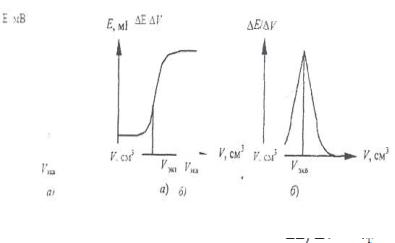
Рис. 26. Кривые потенциометрического титрования: а) зависимость Е от V; б) зависимость от 










Достоинства метода:
–быстрота и простота проведения измерений;
–время установления равновесного потенциала электродов мало, что удобно для изучения кинетики реакций
иавтоматического контроля технологических процессов;
–возможность проводить определения в мутных и
окрашенных растворах, вязких пастах, при этом, исключая операции фильтрации и перегонки;
– измерения относят к группе неразрушающихся способов контроля, и анализируемый раствор может быть использован для дальнейших исследований;
– погрешность определения при прямом потенциометрическом измерении составляет 2 - 10 %, при титровании 0,5 - 1,0 %.
Кондуктометрический метод анализа. Основные законы
и формулы Кондуктометрия – метод анализа, основанный на
измерении электропроводимости анализируемого раствора. Электропроводность – характеристика раствора,
является следствием электролитической диссоциации.
162
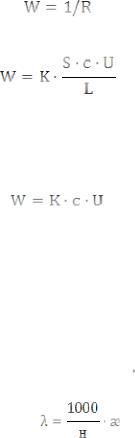
Численное знание электропроводности связано с силой и его концентрацией. Движущиеся ионы в поле электрического тока испытывают тормозящее действие со стороны молекул растворителя – релаксационный эффект и со стороны противоположно заряженных ионов – электрофоретический эффект. В результате этих торможений раствор оказывает сопротивление прохождению электрического тока. Электропроводность (W, См = Ом-1) это величина обратная сопротивлению:
Зависимость электропроводности от концентрации выражается уравнением:
где К – коэффициент пропорциональности; S – площадь электродов; c – концентрация ионов; U – подвижность ионов; L – расстояние между электродами.
Для данной пары электродов при S, L = const , получим:
Различают удельную (æ, каппа) и эквивалентную электропроводность λ.
Удельная электропроводность (æ) – это электро-
проводность 1 см3 раствора, находящегося между электродами площадью 1 см2 каждый, расположенными на расстоянии 1 см друг от друга. Размерность: См/м.
Эквивалентная электропроводность (λ) – это электропроводность 1 Н раствора электролита, измеренная при расстоянии L = 1 см. Размерность: См см2/моль.
Зависимость æ и λ выражается уравнением:
где Н – нормальная концентрация.
163
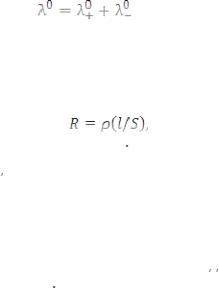
Таким образом, в кондуктометрии аналитическим
сигналом является электропроводность.
Эквивалентная электропроводность (подвижность) уменьшается с повышением концентрации раствора. При повышении концентрации электролита увеличивается ионная сила, а скорость движения ионов уменьшается за счет межионных взаимодействий. При нулевой концентрации (бесконечное разбавление) подвижности ионов становятся постоянными и максимальными и эквивалентная электропроводность раствора электролита λ при бесконечном разбавлении равна сумме подвижностей ионов, отнесенных к единичному заряду:
Растворы электролитов, являясь проводниками II рода, подчиняются закону Ома. По аналогии с сопротивлением проводников I рода, сопротивление раствора прямо пропорционально расстоянию между электродами l и обратно пропорционально площади их поверхности S:
где ρ – удельное сопротивление (Ом см). При 

 см и S = 1 см2 имеем
см и S = 1 см2 имеем 



 , следовательно, удельное сопротивление
, следовательно, удельное сопротивление
равно сопротивлению 1 см3 раствора, находящегося между двумя параллельными пластинами площадью 1 см2, отстоящими друг от друга на 1 см.
Величину, обратную удельному сопротивлению, называют удельной электропроводностью 






 . Удельная
. Удельная
электропроводность (См см-1) численно равна току (в
амперах), проходящему через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1 В на единицу длины.
Электропроводность разбавленных растворов электролитов зависит от числа ионов в растворе (от концентрации), числа элементарных зарядов, переносимых каждым ионом (от заряда иона), и от скорости движения
164
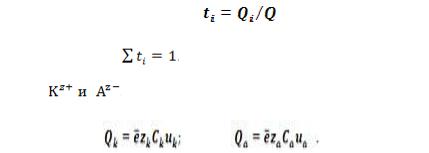
одинаково заряженных ионов к катоду или аноду под действием электрического поля. С учетом всех этих факторов электропроводящие свойства ионов характеризуют эквивалентной ионной электрической проводимостью (подвижностью).
Эквивалентной электрической проводимостью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между
которыми 1 см. Ее единицей измерения является См . см2 .
моль-1.
Удельная и эквивалентная проводимость связаны соотношением:
λ = 1000 λ/c
где с – молярная концентрация эквивалента, моль/л.
Числа переноса ионов
При наложении на раствор электролита электрического поля каждый вид ионов переносит определенное количество электричества, которое зависит от заряда ионов, их концентрации и скорости движения ионов в электрическом ноле. Для оценки доли участия каждого вида ионов в переносе электричества Гитторфом введено понятие о числах
переноса. Число переноса ионов i-го вида представляет собой отношение количества электричества, перенесенного данным видом ионов, к общему количеству электричества Q прошедшего через электролит:
В соответствии с этим сумма чисел переноса всех видов
ионов в растворе |
. |
|
ионы |
Для бинарного электролита КА, диссоциирующего на |
|
|
, количества электричества, переносимые |
|
катионами и анионами:
165
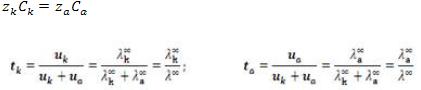
Поскольку раствор в целом электронейтрален и , то с учетом уравнения для величин чисел
переноса получаем:
Из уравнения видно, что число переноса данного вида ионов зависит от электрической подвижности всех видов ионов, содержащихся в электролите, оно различно в растворах разных электролитов.
При протекании электрического тока через электрохимическую систему происходит изменение содержания электролита в растворе около электродов. Это связано с движением ионов в электрическом поле и их участием в электрохимических реакциях. Около каждого электрода можно выделить некоторый объем раствора (анодное и катодное пространство, анолит и католит) и определить изменение содержания электролита в нем путем составления электродного баланса. При этом для каждого конкретного электролита следует учитывать участие переносящих электричество ионов в электродных реакциях. Здесь можно выделить два случая:
1. Ионы, переносящие электричество, участвуют в электродных реакциях, что приводит к разложению электролита;
2. Из ионов, переносящих электричество, только один принимает участие в анодной и в катодной реакции, что не сопровождается разложением электролита.
Методы прямой кондуктометрии основываются на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения дают информацию главным образом лишь об общей концентрации ионов в растворе. Малая селективность
166
кондуктометрического метода существенно ограничивает его применение.
Измерения электрической проводимости растворов широко применяют в титриметрическом анализе для определения точки эквивалентности (кондуктометрическое титрование). В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах λ – V (удельная электропроводность – объем раствора титранта). Практически в этом методе могут быть использованы такие химические реакции, в ходе которых происходит резкое изменение (обычно возрастание) электрической проводимости после точки эквивалентности (реакции кислотно-основного взаимодействия, осаждения).
При построении кривой высокочастотного титрования показания прибора откладывают по оси ординат как функцию объема добавленного титранта. Промышленностью выпускаются стандартные высокочастотные титраторы.
В ячейках высокочастотного титрования электроды не соприкасаются с исследуемым раствором, что является одним из существенных достоинств метода.
Кондуктометрический метод анализа
Различают: прямую кондуктометрию и кондуктометрическое титрование. Кондуктометрия (от англ, conductivity – электропроводность и греч. metreo – измеряю), совокупность электрохимических методов анализа, основанных на измерении электропроводности жидких электролитов, которая пропорциональна их концентрации.
Прямая кондуктометрия – измеряют электро-
проводность исследуемого раствора и по градуировочному графику, построенному в тех же условиях для стандартных растворов, определяют концентрацию исследуемого раствора. Метод нашел ограниченное применение, так как он
167
неселективен, электропроводность – величина аддитивная, обусловленная присутствием всех ионов. Этот метод применим для анализа разбавленных растворов.
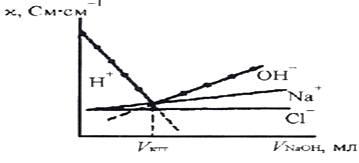
Кондуктометрическое титрование – точку эквива-
лентности определяют по резкому излому кривой зависимости электропроводности от объёма титранта. При этом могут быть использованы все типы реакций (нейтрализации, осаждения, комплексообразования), при которых достаточно резко изменяется электропроводность, рис. 27.
Рис. 27. Кривая кондуктометрического титрования соляной кислоты раствором натрия и вклад отдельных ионов в электропроводимость раствора
При кондуктометрическом титровании положение точки эквивалентности определяется по изменению электропроводности раствора в процессе титрования. Это изменение может происходить при образовании или исчезновении в ходе реакции малодиссоциирующих или труднорастворимых соединений. Точку эквивалентности находят из графика зависимости электропроводности титруемого раствора от количества добавляемого титрующего реагента; этой точке соответствует излом кривой титрования
(рис. 28).
При этом точность определения точки эквивалентности обусловлена наличием резкого излома кривой: тангенсы
168
углов |
и |
наклона |
ветвей титрования |
должны |
значительно отличаться друг от друга. |
|
|||
|
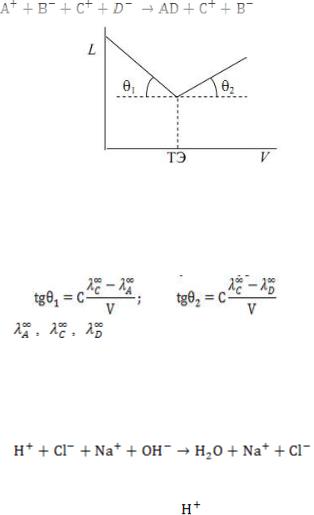
Допустим, что вещество АВ титруется веществом CD и |
|||
при |
этом |
образуется |
малодиссоциирующее |
или |
малорастворимое соединение AD. Реакция титрования:
Рис. 28. Кривая кондуктометрического титрования:
L – электропроводность раствора; V – объем титрующего реагента
Значения тангенсов углов наклона ветвей кривой титрования рассчитываются по следующим уравнениям:
где |
– |
предельные |
молярные |
электропроводности ионов 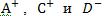 , См •см2/моль-экв; С – концентрация титрующего раствора, моль-экв/л; V - объем титруемого раствора, мл.
, См •см2/моль-экв; С – концентрация титрующего раствора, моль-экв/л; V - объем титруемого раствора, мл.
При титровании сильной кислоты сильным основанием, например по реакции:
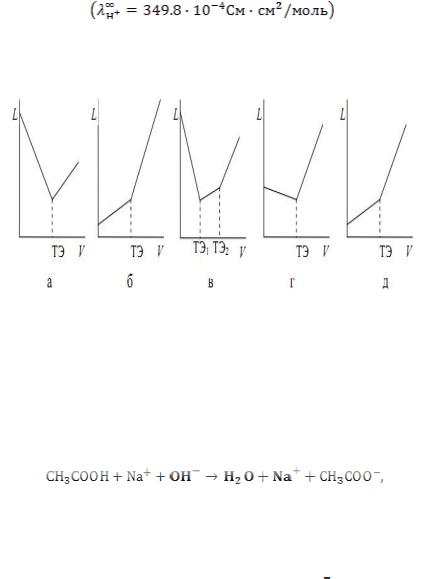
,
электропроводность раствора до точки эквивалентности падает (рис. 35, а), ионы с высокой молярной электрической проводимостью:
169
,
и электропроводность начинает расти. Кривая титрования сильного основания сильной кислотой имеет аналогичный вид, но с обратным соотношением наклона ветвей (рис. 29 б).
Рис. 29. Кривые кондуктометрического титрования: а, б – титрование сильным основанием сильной кислоты;
в – слабой кислоты, смеси сильной и слабой кислот; г, д – титрование нитрата серебра раствором гидроксида натрия и раствором гидроксида калия соответственно
При титровании слабой кислоты, раствор которой обладает малой электрической проводимостью, сильным основанием, например:
электропроводность раствора но мере добавления титранта возрастает, слабодиссоциирующая кислота заменяется ее сильнодиссоциирующей солью. В избытке NaOH электропроводность раствора возрастает более сильно за счет увеличения содержания ионов 

 с высокой
с высокой
электропроводностью (рис.29, в).
При титровании с использованием реакций осаждения изменение электропроводности титруемого раствора связано с
170
