
Учебное пособие 2150
.pdfСигнал возникает вследствие протекания химических реакций, а фактор интенсивности – светопоглощение, электропроводность, то это физико-химические методы. Если сигнал возникает вследствие протекания химических реакций, а фактор интенсивности – светопоглощение, электропроводность, то это физико-химические методы.
3. Физические методы основаны на измерении какихлибо физических характеристик вещества с помощью специальных приборов, например:
●плотность (денситометрия), ●показатель преломления (рефрактометрия), ●вязкость (вискозиметрия),
●изменение температуры кипения или замерзания растворов (эбуллиоскопия и криоскопия),
●поверхностное натяжение (тензометрия), ●вращение плоскости поляризации (поляриметрия), ●электропроводность (кондуктометрия),
●поглощение, испускание или рассеяние электромагнитного излучения (спектральные методы, колориметрия, нефелометрия, турбидиметрия) и другие.
Для аналитических целей используются физические явления (испускание света при высокой температуре, люминесценция, ядерный и парамагнитный резонансы), то методы называют физическими.
Физические методы – основаны на использовании физических характеристик:
1.Изменение окраски раствора (CuSO4 – при его присутствии в смеси раствор приобретает голубой цвет);
2.Появление характерного запаха, присуще веществам,
обладающим способностью испаряться и высокой летучестью: Cl2, H2S, NH3, HBr и других веществ. Однако эти методы являются полуколичественными, что навсегда позволяет решить аналитическую задачу. В этих методах соответствующие приборы регистрируют аналитические сигналы, связанные с индивидуальными свойствами
21
анализируемых веществ: линии спектра, показатель преломления растворов.
4. Биологические методы – в основе лежит анализ биологически активных веществ. Биологические методы анализа, основанные на исследовании отклика живых организмов на изменения в окружающей среде. Пример: антибиотики анализируют по их способности угнетать рост бактерий.
IV. По массе или объему пробы, взятой для анализа.
По количеству вещества, взятого для анализа, различают макро-, полумикро-, микро- и ультрамикрометоды. В макрометодах масса пробы составляет обычно >100 мг, объем
раствора >10 мл; в ультрамикрометодах – соответственно 1 - 10-1 мг и 10-3 – 10-6 мл.
В табл. 1 приведена классификация методов анализа в зависимости от количества компонента. В зависимости от содержания компонентов в анализируемом образце их оценивают как главные или макрокомпоненты (содержание более 1 %), второстепенные (0,01-1 %) или «следы» и микрокомпоненты (менее 0,01 %).
Полумикрометод с элементами микроанализа наиболее распространен и имеет свои достоинства:
1.Экономия времени и реагентов.
2.Достаточная надежность результатов, используются чувствительные и избирательные реакции.
3.Сохранение систематического хода анализа.
Способ проведения анализа в значительной степени определяется количеством аналитического образца, так как от этого зависит выбор аналитических реакций и приборов, принцип, схема и техника анализа.
V. По цели анализа.
1. Методы обнаружения - установления факта присутствия или отсутствия компонентов в анализируемом объекте.
22
2. Методы |
разделения – |
отделение |
ионов |
|
мешающих определению необходимых компонентов |
и |
|||
подготовка объекта к анализу. |
|
Таблица 1 |
||
|
|
|
||
Классификация методов анализа в зависимости от количества компонента
|
Наименование |
|
Количество |
исследуемого |
|
|||
|
|
|
|
вещества |
|
|
|
|
|
Старое |
Новое |
Масса, г |
|
объём, мл |
|
|
|
|
Макроанализ |
|
Грамм- |
1-10 |
|
10-100 |
|
|
|
|
|
метод |
|
|
|
|
|
|
Полумикроан |
|
Санти- |
0,05-0,5 |
1-10 |
|
|
|
|
ализ |
|
грамм- |
|
|
|
|
|
|
|
|
метод |
|
|
|
|
|
|
Микроанализ |
|
Милли- |
10-6 - 10-3 |
10-4 - 10-1 |
|
||
|
|
|
грамм- |
|
|
|
|
|
|
|
|
метод |
|
|
|
|
|
|
Ультрамикро |
|
Микро- |
10-9 - 10-6 |
10-6 - 10-4 |
|
||
|
анализ |
|
грамм- |
|
|
|
|
|
|
|
|
метод |
|
|
|
|
|
|
Субмикро- |
|
Нанограмм- |
10-12 - 10-9 |
10-10 - 10-7 |
|
||
|
анализ |
|
метод |
|
|
|
|
|
|
Субультра- |
|
Пикограмм- |
<10-12 |
|
<10-10 |
|
|
|
микроанализ |
|
метод |
|
|
|
|
|
|
3. Методы |
|
определения – |
установка |
содер- |
|||
жания компонента |
в анализируемом объекте. |
|
|
|||||
Методы разделения и концентрирования
Концентрирование и последующее определение микроэлементов должны проводиться в условиях, по возможности исключающих попадание в анализируемый раствор определяемых элементов из воды, реактивов, посуды, атмосферы. Работая с небольшими концентрациями анализируемых веществ, необходимо учитывать также опасность потерь определяемых элементов. Поэтому ниже
23
приведем сведения о наиболее важных моментах анализа с точки зрения загрязнений и потерь.
Разделение – это операция (процесс), в результате которого компоненты, составляющие исходную смесь, отделяются один от другого.
Концентрирование – операция (процесс), в результате которого повышается отношение концентрации или количества микрокомпонентов в концентрации или количеству макрокомпонентов.
Необходимость разделения и концентрирования может быть обусловлена следующими факторами:
–проба содержит компоненты, мешающие определению;
–концентрация определяемого компонента ниже
предела обнаружения метода;
–определяемые компоненты неравномерно распределены в пробе;
–отсутствуют стандартные образцы для градуировки
приборов;
– проба высокотоксична, радиоактивна или дорога.
Для современных методов аналитической химии характерно широкое использование цифровых измерительных приборов, компьютеров и математических методов обработки результатов измерений.
Требования, предъявляемые к методам анализа
1. Правильность – параметр, характеризующий близость экспериментальных и истинных значений измеряемой величины. Она характеризуется систематической погрешностью, которая зависит от работы прибора, индивидуальных особенностей аналитика, ошибок при расчете и методических погрешностей.
2. Воспроизводимость – параметр, отражающий случайные ошибки измерения и показывающий степень разброса повторных (параллельных) определений. Это мера того, как повторяются результаты при многократном проведении анализа.
24
Воспроизводимость определяет вероятность того, что результаты последующих измерений окажутся в некотором заданном интервале, в центре которого находится среднее значение. Ее можно оценить с помощью любого доступного образца, тогда как для оценки правильности метода необходимо располагать стандартными образцами.
Стандартные образцы – образцы веществ, состав которых типичен для определенного класса анализируемых материалов, определен с высокой точностью и не изменяется при хранении. Непременным условием применения стандартного образца в химическом анализе является максимальная близость состава и свойств стандартного образца и анализируемой пробы. Их применяют для градуировки и проверки аналитических приборов и метода анализа (например: анализ сплавов чугуна и стали).
3.Точность анализа определяется суммой правильности и воспроизводимости.
4.Предел обнаружения (ПО) – это минимальная концентрация вещества, которая может быть определена
данным методом с какой-то допустимой погрешностью: (моль/дм3; мкг/см3; %).
5. Чувствительность – параметр, характеризующий изменение аналитического сигнала, например, оптической плотности или напряжения, с изменением концентрации определяемого компонента, это тангенс угла наклона градуировочного графика.
6.Избирательность, селективность – возможность определения какого-то вещества (иона) в присутствии других.
7.Экспрессность.
8.Простота.
9.Экономичность.
10.Локальность.
11.Автоматизация.
12.Дистанционность.
25
В производственных условиях, где анализы носят массовый характер, выбирают наиболее простые, быстрые методы, если они обеспечивают требуемую точность и достаточно низкий предел обнаружения. Выбор метода в каждом конкретном случае определяется целями и задачами исследования, а также производственными возможностями (наличие химических реактивов и приборов).
Классификация методов разделения
Все методы разделения в зависимости от уровня однородности состава исходной смеси веществ подразделяются на методы разделения гетерогенных (макроскопически неоднородных) и гомогенных (макроскопически однородных) смесей.
Разделение гетерогенных смесей веществ производится в зависимости от агрегатного состояния, фазового или дисперсного состава образующих их компонентов. Эти методы, как правило, основаны на различиях в физических свойствах веществ. Для сплошных средств эти свойства – плотность и вязкость, для дисперсных – масса, размеры и форма частиц. К этой группе методов разделения относятся:
1.Фильтрация – это отделение жидкости или газа от взвешенных в них твердых частиц в процессе пропускания их через пористые материалы.
2.Седиментация – оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или
центробежных сил. Скорость зависит от массы, размера, формы, плотности вещества частицы.
3. Центрифугирование – разделение неоднородных систем (например, жидкость – твердые частицы) на фракции по плотности при помощи центробежных сил. Осуществляется в аппаратах – центрифугах.
4. Флотация – (при переводе с французского языка– это плавание на поверхности воды), разделение мелких частиц и выделение капель дисперсной фазы из эмульсии.
26
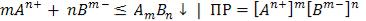
Целью разделения гетерогенных смесей является фракционирование частиц по агрегатному состоянию, фазовому составу и степени дисперсности. Методы разделения гетерогенных смесей веществ, как правило, обеспечивают высокую эффективность разделения на фракции, отличающиеся по агрегатному состоянию.
Методы разделения, основанные на образовании выделяемым веществом новой фазы, в зависимости от агрегатного состояния исходной смеси и выделяемых
веществ.
Осаждение – разделение происходит за счет образования малорастворимых соединений одним или несколькими компонентами раствора при их взаимодействии с вводимыми в раствор или генерируемыми в нем веществами реагентами и последующего отделения осадка от маточного раствора одним из методов разделения гетерогенных смесей: фильтрацией, центрифугированием или седиментацией. Существуют несколько классов малорастворимых химических соединений, образование которых используются для разделения веществ методом осаждения из водных растворов:
гидроксиды металлов и слабые минеральные кислоты;
соли некоторых минеральных кислот, сульфиды, цианоферраты, хлорплатинаты);
соединения с химическими реагентами (хелаты и ионные ассоциаты);
вещества в элементарном состоянии (селен, теллур, благородные металлы).
Коэффициент разделения и степень извлечения целевых компонентов определяются растворимостью образующихся соединений. Важнейшая характеристика – произведение растворимости (ПР). Для реакции:
ПР важнейших растворимых веществ приведены в прил. 1. Метод осаждения имеет две области применения. Во-первых,
27
это первая стадия гравиметрического анализа, во-вторых, это традиционный способ пробоподготовки для устранения мешающего влияния матричных компонентов анализируемых смесей, применяемых в сочетании с различными методами конечного определения микроэлементов.
Экстракция Экстракция – метод, основанный на распределении
растворенного вещества между двумя жидкими несмешивающимися фазами. Обычно в практике применяют системы, в которых одной фазой является раствор, а второй – органический растворитель.
Задача экстракции состоит в том, чтобы полно и селективно перевести компонент из водной фазы в органическую составляющую. Для этого необходимо подобрать условия образования подходящих соединений (например, комплексов металлов), в виде которых компоненты могут находиться в органической фазе.
Основными преимуществами экстракционного метода являются:
1.Высокая избирательность и чистота разделения;
2.Возможность работы как большими, так и самыми
малыми концентрациями;
3.Отсутствие загрязнений продуктов;
4.Легкость технологического и аппаратурного оформления;
5.Возможность осуществления непрерывного процесса, автоматизации и, наконец, высокая производительность. Эти
особенности делают экстракционный метод перспективным для применения.
Условия экстракции вещества
1.Катион металла и другие заряженные частицы перешли в органическую фазу, для этого необходимо нейтрализовать заряд.
2.Экстракция возможна, если растворимость экстрагирующего соединения в органическом растворителе
28

выше, чем в воде; чем больше энергия сольватации и меньше энергия гидратации, тем выше степень извлечения.
3. Для того чтобы соединение было хорошо растворимо в органическом растворителе, необходимо обеспечить его гидрофобность, должны, как правило, отсутствовать гидрофильные группы (-SO3H, -COOH, -OH) и внешняя органическая часть хелата должна быть достаточно объемистой и могла блокировать гидрофильную часть молекулы.
4. С увеличением размера молекул экстрагирующего соединения степень извлечения обычно повышается, поскольку крупные молекулы сильнее нарушают структуру воды.
5. Экстракции способствуют «сольватации» молекулами экстрагента. Например, экстракция катионов кадмия, кобальта и других двухзарядных ионов 8-оксихинолином C9H7NO в хлороформе обеспечивается образованием сольватов состава














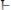




 .
.
6. При экстракции ионных ассоциатов важно учитыать заряд и размер ионов; экстракция ухудшается с увеличением заряда и уменьшением размера ионов. При прочих равных условиях обычно лучше экстрагируются однозарядные ионы, хуже – двух- и особенно трехзарядные.
7. В равных условиях более устойчивые комплексы экстрагируются лучше.
29
Лекция № 3 Химические методы анализа. Аналитические реакции
Способы выполнения аналитических реакций
В химических методах анализа используют аналитические реакции взаимодействия элементов в определённом ионном состоянии с реагентом.
Реагент – это вещество, вызывающее характерные превращения исследуемых веществ. Химические реакции, используемые для обнаружения, разделения и определения называются аналитическими.
Аналитические реакции – это качественные реакции, наблюдающиеся при добавлении к раствору анализируемого вещества других веществ. Химические реакции, применяемые в анализе (аналитические реакции) должны сопровождаться аналитическим сигналом и удовлетворять следующим требованиям:
1.Протекать быстро, экспрессно;
2.Сопровождаться образованием характерного осадка,
газа, цветных соединений;
3.Протекать преимущественно в одном направлении;
4.Отличаться высокой чувствительностью (аналитическим признаком, эффектом);
5.Должны быть чувствительными, селективными (избирательными);
6.Должны протекать количественно, стехиометрично (для реакций разделения и определения);
7.Должны быть устойчивыми к внешнему воздействию
(T0, P).
Основным требованием к реагентам является их чистота. По степени чистоты химические реагенты делят:
Технические – Т более 2 % примесей; Чистые – Ч до 2 % примесей; Чистые для анализа – Ч.Д.А 1 % примесей;
Химически чистые – Х.Ч. 0,1 % примесей; 30
