
Учебное пособие 2150
.pdf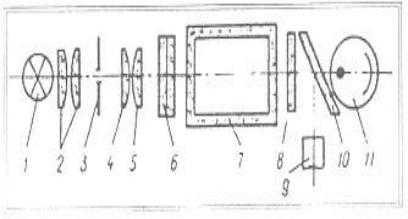
3.Устанавливают постоянную температуру и варьируют
еена более чем 2 градуса.
4.В растворе не должно происходить побочных реакций,
изменяющих структуру частиц (ассоциация, диссоциация, гидролиз). Для этого на практике используют растворы, разбавленные или средней концентрации до 10-2 моль/дм3.
Рис. 23. Принципиальная схема двухлучевого ФЭКа: 1 – источник света; 2 – конденсатор; 3 – диафрагма; 4, 5 – линзы объектива; 6 – светофильтр; 7 – кювета; 8 – защитное стекло; 9 – фотодиод (590-980 нм); 10 – пластинка, делящая
световой поток на два; 11 – фотоэлемент (315-540 нм)
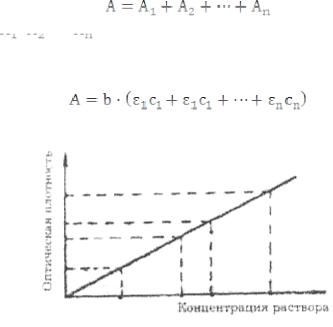
При графическом изображении зависимости оптической плотности от концентрации получается прямая линия. Эта прямая проходит через начало координат при отсутствии поглощения света растворителем и систематических погрешностях (рис. 24).
Закон аддитивности светопоглощения
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает свойством аддитивности,
которое называют свойством аддитивности светопог-
151
лощения. При наличии в растворе нескольких окрашенных веществ каждое из них будет иметь свой аддитивный вклад в экспериментально определяемую оптическую плотность:
где 

 ,
, 


 ,…,
,…, 

 - оптические плотности веществ 1, 2,.., n-го вещества.
- оптические плотности веществ 1, 2,.., n-го вещества.
С учетом уравнения 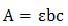 получают:
получают:
Аддитивность следует учитывать при анализе многокомпонентных смесей.
Рис. 24. Зависимость оптической плотности от концентрации раствора
Лекция № 14 Электрохимические методы (ЭХМА). Система электродов.
Индикаторный и стандартный электроды
Классификация методов
Электрохимические методы анализа основаны на измерении и регистрации электрических параметров системы (аналитических сигналов), изменяющихся в результате протекания химических реакций.
Электрохимическая система обычно состоит из электрохимической ячейки, представляющей собой единое
152

конструктивное оформление сосуда с исследуемым раствором и электродами. Принята следующая классификация этих методов:
1. Классификация, учитывающая природу источника электрической энергии в сиcтеме. Различают две группы методов:
– методы без наложения потенциала. Здесь источник электрической энергии – сама электрохимическая система (гальванический элемент). К таким методам относятся потенциометрические методы.
– методы с наложением внешнего потенциала. К ним относятся: кондуктометрия, вольтамперометрия, кулонометрия, электрогравиметрия.
2. Классификация по способу применения. Различают прямые и косвенные методы.
– прямые методы. Измеряют аналитический сигнал как функцию концентрации раствора и по показаниям прибора находят содержание вещества в растворе (Прямая потенциометрия, прямая кондуктометрия).
– косвенные методы – это методы титрования, в которых окончание титрования фиксируют на основании измерения электрических параметров системы (кондуктометрическое, амперометрическое титрование).
Общее для всех ЭХМА – использование двух электродов, один из которых индикаторный (изменяет свой потенциал в зависимости от концентрации ионов в растворе), другой – стандартный (сохраняет постоянное значение потенциала и служит для контроля за процессами, протекающими на индикаторном электроде).
Классификация электродов:
К электродам первого рода относятся электроды,
состоящие из металлической пластинки, погруженной в
раствор соли того же металла (активные металлические электроды). Примером может служить цинковая пластина, погруженная в раствор 



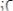

 . При обратимой работе
. При обратимой работе
153
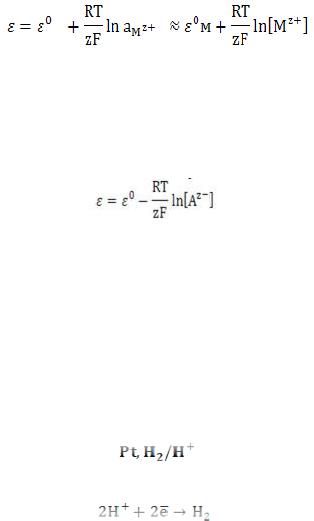
элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
Электродами второго рода являются электроды, в
которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации может быть записана в следующем виде:
Электроды сравнения. Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения. В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий катионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом, схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
154

Потенциал водородного электрода зависит от активности катионов 

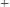 в растворе и давления водорода; потенциал
в растворе и давления водорода; потенциал
стандартного водородного электрода (с активностью ионов 

 1 моль/л и давлением водорода 101,3 кПа) принят равным
1 моль/л и давлением водорода 101,3 кПа) принят равным
нулю. Поэтому для электродного потенциала нестандартного водородного электрода записать:
Каломельный электрод. Работа с водородным электродом довольна, неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала, которая относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор KCl определенной концентрации и насыщенной каломелью 

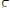







 :
:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него, имеет вид:
Хлорсерябряный электрод. В качестве электрода сравнения используют электрод второго рода – хлорсерябряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещенную в раствор хлорида калия. Хлорсеребряный электрод обратим относительно анионов хлора:
Ag / AgCl, KCl
Величина потенциала хорсеребряного электрода зависит от активности анионов хлора и зависимоть имее следующий вид:
155

В качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного электрода, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных растворах.
Индикаторные электроды – электроды, обратимые относительно катиона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного индикатора может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод, относящийся к классу окислительно-восстановительных электродов, представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона 













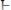





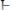



 – соединение хинона
– соединение хинона 


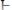





 и
и
гидрохинона 


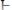





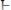



 , способных к взаимопревращению в
, способных к взаимопревращению в
равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является окислительновосстановительным электродом; зависимость его потенциала от активности ионов водорода имеет следующий вид:
156
Ионселективные электроды – это электроды, обратимые по катионам или анионам, сорбируемыми твёрдой или жидкой мембраной. Они делятся на группы:
–стеклянные электроды;
–твёрдые электроды с гомогенной или гетерогенной
мембраной;
–жидкостные электроды (на основе ионных ассоциативов, хелатов металлов или нейтральных лигандов);
–газовые электроды;
–электроды для измерения активности (концентрации) биологических веществ.
Мембранные электроды имеют форму пластинок из ионообменного материала, контактирующих с двумя растворами электролита МХ1(с1)/мембрана/ МХ2(с2). Среди ионселективных электродов наибольшее применение получил стеклянный электрод, предназначенный для измерения рН.
Стеклянный электрод, являющийся наиболее распространенным индикаторным электродом, относится к ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны ее потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны, рис. 30.
Потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле с ионами
157
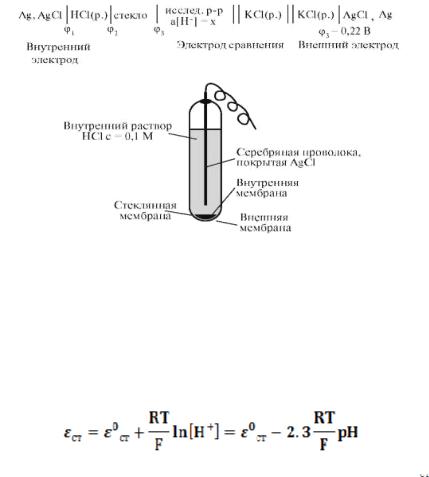
водорода из раствора. Энергетическое состояние ионов в стекле и растворе различно. Это приводит к тому, что ионы водорода так распределяются между стеклом и раствором, что поверхности этих фаз приобретают противоположные заряды; между стеклом и раствором возникает разность потенциалов, значение которой зависит от рН раствора.
Рис. 30. Схема стеклянного электрода
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором HCl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией
(обратимого к катиону 

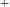 ) выражается уравнением:
) выражается уравнением:
Необходимо отметить, что стандартный потенциал 




для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед
158
каждым измерением рН калибруется по стандартным буферным растворам с точно известным значением рН.
Правила работы с рН-селективным (стеклянным) электродом
1.Хранить электрод на воздухе запрещено, только в
водном растворе соляной кислоты с концентрацией 0,1 моль/дм3, дистиллированной воде или специальном кожухе.
2.Электрод хрупок, требует аккуратного обращения.
3.Электрод запрещено длительное время оставлять на
воздухе без раствора.
4. Градуировку электрода следует проводить от меньшей концентрации ионов в растворе к большей концентрации (например, от 0,001 до 1 моль/дм3), в противном случае произойдет закупорка мембраны, и растворы с небольшой концентрацией веществ будет измерены неправильно.
5. Рабочий диапазон рН от 2-10. При рН >10 происходит защелачивание мембраны, при рН < 2 – изменяется концентрация внутреннего раствора электрода.
Лекция № 15 Потенциометрия. Кондуктометрия. Кондуктометрическое
титрование
Потенциометрический метод анализа – основан на измерении (ЭДС) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин. Величину ЭДС рассчитывают по разности потенциалов стандартного и индикаторного электродов:
где 


 – потенциал индикаторного электрода, В (электрода,
– потенциал индикаторного электрода, В (электрода,
который изменяет свой потенциал при изменении концентрации определяемого компонента в растворе), 
 –
–
159
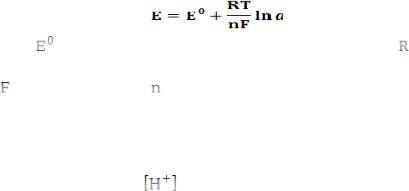
потенциал стандартного электрода, В (не меняет свой потенциал).
Зависимость величины электродного потенциала (ЭП) от активности ионов в растворе выражается уравнением
Нернста: |
|
|
|
|
|
где |
– стандартный электродный потенциал, В; |
– |
|||
универсальная газовая постоянная, Дж/К; Т – |
температура, К; |
||||
– число Фарадея; – число электронов, участвующих в |
|||||
электрохимической реакции. |
|
|
|
||
|
Виды потенциометрического метода анализа |
|
|||
Различают два вида потенциометрических измерений: |
|
||||
1. Прямая потенциометрия |
– определение концентрации |
||||
ионов, |
в частности |
с помощью уравнения Нернста по |
|||
ЭДС гальванического элемента. |
|
|
|||
2. Потенциометрическое |
титрование |
основано |
на |
||
использовании измерений ЭП для нахождения точки эквивалентности в различных реакциях.
Аппаратура для проведения прямой потенциометрии и потенциометрического титрования одна и та же. В схему потенциометрических измерений входят индикаторный электрод, электрод сравнения и потенциало-измеряющий прибор (различные рН-метры). Перед измерением рН проводят настройку приборов по буферным растворам рис. 31.
Потенциометрический анализ широко применяют для непосредственного определения активности ионов, находящихся в растворе (прямая потенциометрия, ионометрия), а также для индикации точки эквивалентности при титровании по изменению потенциала индикаторного электрода в ходе титрования (потенциометрическое титрование).
Методы прямой потенциометрии для нахождения концентрации аналита
160
