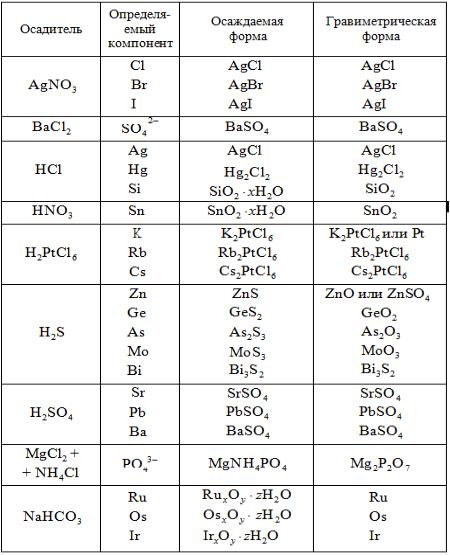
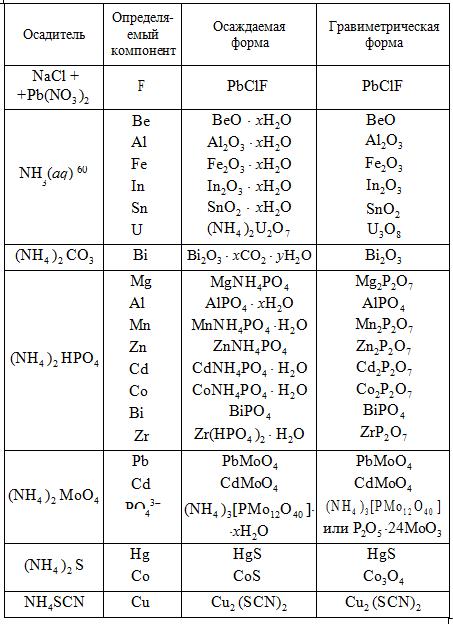
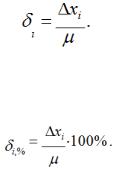ОГЛАВЛЕНИЕ
Введение……………………………………………….…………3
1.Лекция № 1. …………………………………………….….….4
2.Лекция №2…………………………………………….…...…15
3.Лекция № 3……………………….…………………….…....30
4.Лекция № 4………………….…………………………...…...45
5.Лекция № 5………………..……………………………….…53
6.Лекция № 6………………………………………………..…61
7.Лекция № 7.……….................................................................86
8.Лекция № 8…………………………….………………..……92
9.Лекция № 9……………………………………………...….104
10.Лекция № 10………………….............................................117
11.Лекция № 11………………………………………….……127
12.Лекция № 12……….………………………………………137
13.4.Лекция № 13…………......................................................144
14.Лекция № 14…………………………………………….…152
15.Лекция № 15……………………………………………….159
16.Лекция №16………………………………………………..177
17.Лекция № 17…………………………………………….…188
18.Лекция № 18….. ……………………………………….…211
19.Лекция № 19………………………………………………224
20.Лекция № 20…………………………………………..…..236 Заключение……………………………………………………243
Приложение 1……………………………………...…….........244 Приложение 2……………………………….......……….........245 Библиографический список…………………………..……...247