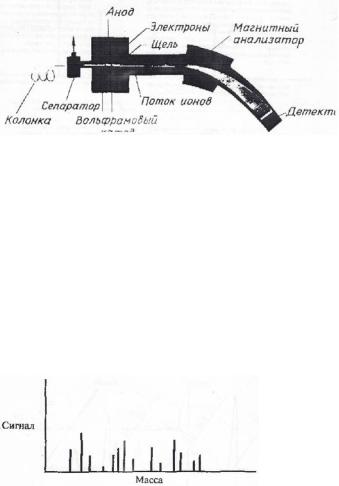
Рис. 52. Принципиальная схема масс-спектрометра в комбинации с газовым хроматографом
Первым шагом при хромато-масс-спектрометрическом анализе является обычно сканирование по всему диапазону масс (рис. 53). Идентификацию проводят с помощью библиотеки спектров, чаще всего заложенной в память ЭВМ, которая одновременно и управляет работой детектора. Изучение характеристических пиков и молекулярных ионов играет важную роль при идентификации соединения. В определенном диапазоне измерены все отношения масса/заряд.
Рис. 53. Спектр полного сканирования
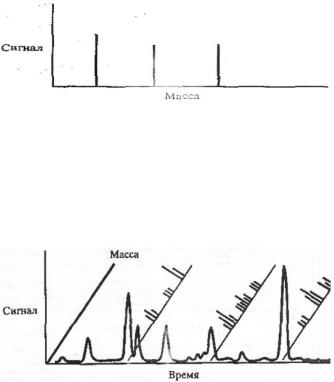
Следующим шагом, представленным на рис. 54, является качественный анализ, для чего используют метод регистрации отдельных ионов (SIM). Для этого применяют фильтр, чтобы исследовать только несколько видов ионов и тем самым повысить чувствительность. Проведена регистрация по отдельным ионам с выбранным отношением
масса/заряд. Время измерения увеличено, что позволило повысить чувствительность.
Рис. 54. Метод регистрации отдельных ионов (SIM)
Наконец, суммируют все осциллограммы по отдельным ионам и наносят на диаграмму с единым масштабом времени (рис. 55), чтобы получить хроматограмму по всем ионам в пробе (TIC).
Рис. 55. Пример хроматограммы по всем ионам
Дальнейшее развитие ГХ/МС-методов и широкое применение компьютерной техники привело к тому, что массспектрометрия стала доступной не только специалистам, но активно используется в качестве стандартного метода детектирования в газовой хроматографии. Компьютер управляет системой в целом, записывает данные, накапливает массовые спектры. Накопление большого количества масс-
спектров за секунду требует большого объема памяти и высокого быстродействия машины.
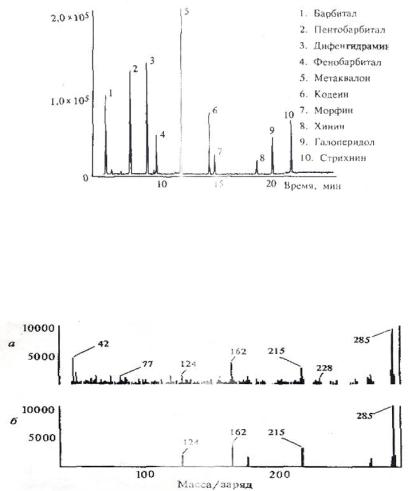
Пример применения хромато-масс-спектрометрии для разделения смеси лекарственных веществ приведен на рис. 56.
Рис. 56. Спектр разделения смеси лекарственных веществ
Сравнение спектра вещества со временем удерживания морфина (рис. 56) и сравнение со спектром морфина, заложенным в банк данных (рис. 57).
Рис. 57. Спектром морфина, заложенным в банк данных
В наши дни масс-спектрометры выпускают только в комплекте с компьютером. Большую помощь при идентификации оказывает банк масс-спектральных данных, который заказчик получает вместе с прибором. По мере выполнения масс-спектрометрических анализов новые результаты непрерывно вводятся в память компьютера, пополняя банк данных. При необходимости воспользоваться банком аналитик посылает в ЭВМ запрос, и компьютер сам находит в памяти спектр, который лучше других соответствует регистрируемому в данный момент спектру. Оба спектра появляются на экране, и теперь остается только сопоставить две спектральные картины. Сравнение спектров, то есть своеобразное опознание по отпечаткам пальцев, значительно проще для идентификации неизвестных веществ, чем реконструкция молекул по отдельным фрагментам. Единственное необходимое условие для такой идентификации
– это наличие в банке данных спектра того самого вещества, которое поступило для анализа.
Хромато-масс-спектрометрия нашла широкое применение в различных областях химии, медицины, фармацевтического производства, экологического мониторинга и технологического контроля в промышленности.
Лекция № 19 Жидкостная хроматография. Ионообменная,
хроматография на плоскости
Жидкостная хроматография – это хроматография, в которой подвижной фазой является жидкость. Жидкостная хроматорафия появилась в конце 1960-х гг.
В настоящее врермя широко используется как классическая, так и высокоэффективная жидкостная хроматография, которые характеризуются следующими параметрами (табл. 25).

Таблица 25 Экспериментальные различия между классической и высокоэффективной жидкостной хроматографией
|
Характеристика |
|
Классическая ЖХ |
Высокоэффектиная ЖК |
|
|
(ВЭЖХ) |
|
|
|
|
|
|
|
|
Давление, атм. |
|
От долей атм. До 2 |
>2атм |
|
|
|
|
атм |
|
|
|
|
|
Скорость |
потока, |
5-50 |
|
600 |
|
|
|
(мм мин-1) |
|
|
|
|
|
Продолжительность |
От нескольких часов |
От |
нескольких минут |
|
разделения |
|
до нескольких уток |
до нескольких часов |
|
|
Оборудование |
|
Колонка |
и |
Хроматограф |
|
|
|
вспомогательное |
|
|
|
|
|
|
|
|
|
|
В |
основном |
В |
основном |
|
Тип разделения |
|
препаративное |
аналитическое |
|
|
|
|
разделение |
|
разделение |
|
|
|
|
Детектирование |
|
|
|
|
Детектирование |
|
отдельных |
фракций |
С помощью детектора |
|
|
аналитическими |
|
|
|
|
|
|
|
|
|
методами |
|
|
|
|
|
Количество |
|
От нескольких мкг до |
От |
нескольких |
|
|
нанокилограммов |
до |
|
исследуемого вещества |
нескольких кг |
|
нескольких мкг |
|
|
|
|
|
|
|
С практической точки зрения можно выделить следующие основные черты совместной ЖХ, отличающие ее от классической ЖХ:
1)применение новых сорбентов в высокой степени однородных по размеру и форме зерен;
2)применение мелкозернистых материалов диаметров 1080 мкм;
3)применение новых усовершенствованных методик заполнения колонок;
4)использование высоких давлений на выходе в колонку
(до 120 атм);
5)уменьшение до минимума мертвых объемов в разделительной системе хроматографа;
6) применение высокочувствительных детекторов с измерительными ячейками очень малого объема.
Схематическое описание жидкостного хроматографа
Жидкостный хроматограф состоит из трех основных функциональных частей. Источник потока подвижной фазы состоит из резервуара, насоса и фильтра. В зависимости от конструкции элементов этого блока в него могут входить устройство для формирования градиентов подвижной фазы; дегазатор и устройство для сглаживания пульсаций давления, если этого требуют конструкции детектора и насоса.
В разделительный блок хроматографа входят устройство для ввода проб, хроматографические колонки, а иногда предварительная колонка для насыщения и термостат.
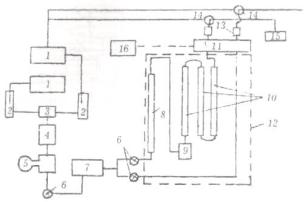
Блок детектирования представляет собой детектор или систему нескольких детекторов. Иногда в этот блок входят сборник фракций и измеритель потока. Схема жидкостного хроматографа показана на рис. 58.
Рис. 58. Жидкостный хроматограф. Обозначения:
1 – резервуар; 2 – дегазатор; 3 – смеситель; 4 – фильтр; 5 – насос; 6 – перекрывающие краны; 7 – устройство для сглаживания пульсаций давления; 8 – предварительная
насыщающая колонка; 9 – устройство для ввода проб; 10 – хроматографические колонки; 11 – детектор; 12 – термостат; 13
– измерители тока; 14 – кран; 15 – сбор фракций; 16 – самописец

Подвижная жидкая фаза находится в резервуаре, и перед подачей в колонку ее обычно пропускают через дегазатор, с тем чтобы уменьшить содержание в ней растворенных газов путем временного нагревания. При работе по методу градиентного элюирования компоненты подвижной фазы проходят через смеситель, а затем через фильтр в насос. При использовании импульсного насоса в систему вводят устройство для сглаживания создаваемых этим насосом пульсаций давления (скорости потока).
В термостатируемом пространстве располагаются предварительная колонка для насыщения (применяется только в системах ЖЖХ), устройство для ввода проб в собственно хроматографические колонки, помещенные в термостат (или без них). С детектором колонка соединяется капилляром, имеющим минимальный мертвый объем. При необходимости детектор помещают в отдельный термостат. Сигнал детектора непрерывно регистрируется самописцем. После детектора могут быть установлены измеритель потока, сборник фракций, а также краны для работы по методу циркуляционной хроматографии.
Нормативные документы
ГОСТ Р МЭК 61674-2006 Медицинское электрооборудование. Дозиметры с иониационными камерами и/или полупроводниковыми детекторами, используемые в рентгеновской диагностике.
ГОСТ Р 50267.9-99 Изделия медицинские электрические. Часть 2. Частичные требования безопсасности к дозиметрам для лучевой терапии, электрически соединенным с детекторами излучения, находящимися в контакте с пациентом.
ГОСТ 29115-91 Блоки и устройства детектирования гамма-излучения спектрометрические на основе полупроводниковых детекторов. Методы измерения основных параметров.
ГОСТ 26222-86 Детекторы ионизирующих излучений полупроводнковые. Методы измерения параметров
ГОСТ 19656.1-74 Диоды полупроводниковые СВЧ смесительные и детекторные. Метод измерения коэффициента стоячей волны по напряжению.
Уравнение Ленгмюра
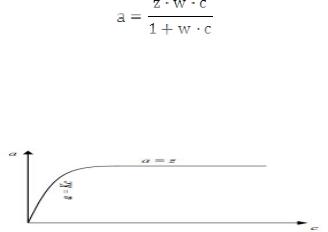
Фактическое количество адсорбированного вещества (газа) твёрдым телом является сложной функцией различных параметров, таких как площадь твёрдой поверхности, число активных центров на единицу площади, прочность связи вещества с твёрдой поверхностью, температура; поэтому количество адсорбированного вещества (х) на один грамм твёрдого адсорбента m характеризует адсорбцию (х / m = a). Эту величину обычно относят к концентрации вещества при помощи эмпирических соотношений, таких как изотерма Ленгмюра. Изотермы адсорбции – это графическая зависимость адсорбции от концентрации при постоянной температуре (уравнение Ленгмюра). Теоретически легче описать адсорбцию паров на твердой поверхности:
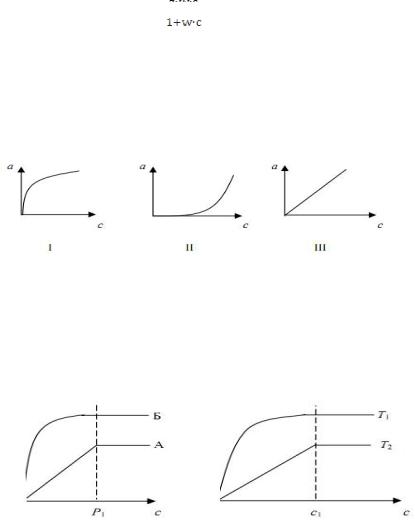
где а – адсорбция; z, w – экспериментальные величины, характеризующие адсорбционную способность поглотителя сорбента по отношению к данному газу; с – концентрация газа. Если с << 1, то a =z w c = K c , т.е. получаем уравнение прямой, выходящей из начала координат (рис. 59).
Рис. 59. Изотерма адсорбции
Если с>>1, то 


 , то получаем уравнение прямой,
, то получаем уравнение прямой,
параллельной оси абсцисс. То есть при малых концентрациях адсорбция прямо пропорциональна концентрации; при больших концентрациях – она является постоянной величиной, так как происходит насыщение поверхности адсорбента. На практике встречаются три типа изотерм адсорбции: выпуклая, вогнутая и линейная (рис. 60).
Рис. 60. Типы изотерм
Каждому адсорбенту присуща своя изотерма, т.е. она является основной характеристикой адсорбционной способности поглотителя. На рис. 61 представлены изотермы сорбентов А и Б, а на рис. 62 – представлена температурная зависимость адсорбции.
Рис. 61. Изотермы различных |
Рис. 62. Зависимость |
сорбентовА и Б |
адсорбции от температуры |
Сорбент А хуже Б, так как при одинаковом давлении он адсорбирует в 2 раза меньше газа. Адсорбция уменьшается с повышением температуры и наоборот. Сравним изотермы для одной системы газ–сорбент, но при различной
температуре, Т2 > Т1. Количество поглощённого газа резко уменьшается с повышением температуры. При поглощении молекул из жидких сред процесс адсорбции усложняется, так как растворитель удерживается на поверхности адсорбента, уменьшает его адсорбируемость и искажает тип изотерм. Поэтому в таких случаях выбирают растворитель с наименьшей сорбционной способностью по отношению к сорбенту.
Ионообменная хроматография
Ионообменная хроматография – сорбционный динамический метод разделения смесей ионов на сорбентах, называемых ионообменниками. При пропускании анализируемого раствора электролита через ионообменник в результате гетерогенной химической реакции происходит обратимый стехиометрический эквивалентный обмен ионов раствора на ионы того же знака, входящие в состав ионообменника.
Ионообменный цикл состоит из стадии поглощения ионов (сорбции) ионообменником НФ и стадии извлечения ионов (десорбции) из ионообменника раствором, который проходит через сорбент (ПФ или элюент). Разделение ионов обусловлено их различным сродством к ионообменнику и происходит за счёт различия скоростей перемещения компонентов по колонке в соответствии с их значениями коэффициентов распределения.
Ионообменники могут быть неорганического и органического происхождения, природными и синтетическими веществами. В настоящее время широкое применение получили синтетические органические ионообменники на основе искусственных смол; эти сорбенты не растворимы в воде и органических растворителях, обладают высокой ионообменной ёмкостью, селективностью, химической, термической и механической прочностью. Ионообменники подразделяются на катионо- и









 , то получаем уравнение прямой,
, то получаем уравнение прямой,