
Учебное пособие 2150
.pdf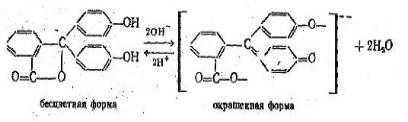
не содержит более хромофора – окраска исчезнет. Группы атомов, которые содержат одну или несколько кратных связей, вызывающие избирательное поглощение электромагнитных колебаний в УФ области называются хромофорами. В роли хромофорных групп могут выступать группировки атомов и связей, как –N = N– , = C = S , –N = O, хиноидные структуры.
3. Согласно ионно-хромофорной теории, изменение окраски индикаторов обусловлено переходом из ионной формы в молекулярную, и наоборот, сопровождающегося изменением структуры индикаторов.
Таким образом, один и тот же индикатор может существовать в двух формах с разным строением молекул, причем эти формы могут переходить одна в другую, и в расчете между ними устанавливается равновесие.
В качестве примера можно рассмотреть структурные изменения в молекуле типичного кислотно-основного индикатора – фенолфталеина под действием растворов щелочей и кислот (при различных значениях рН). Реакция, в результате которой благодаря таутомерной перестройке структуры молекулы фенолфталеина в ней возникает хромофорная группировка, обусловливающая появление окраски, протекает согласно следующему уравнению:
В щелочной среде образуется двунатриевая соль, имеющая хиноидное строение, что вызывает окраску индикатора. Смещение равновесия между таутомерными
91
формами происходит постепенно. Поэтому и цвет индикатора изменяется не сразу, а переходя через смешанную окраску к цвету анионов. Практически, когда частиц окрашенной формы меньше 10 %, их цвет не обнаруживается. Окраска становится наиболее резкой, когда окрашенных частиц более 90 %.
Выбор индикатора
1.Интервал перехода индикатора должен совпадать со скачком титрования или хотя бы частично касаться точки эквивалентности.
2.Индикатора надо добавлять мало, так как, являясь протолитом, он взаимодействует с определяемым веществом
или титрантом.
3.Практически всегда имеет место ошибка, связанная с несовпадением точки эквивалентности с конечной точкой титрования.
4.Индикаторная ошибка титрования должна быть незначительной.
5.Чем меньше скачок титрования, тем труднее выбрать индикатор.
Лекция № 8 Протолитометрия. Кривые тирования
Титрование сильной кислоты сильным основанием
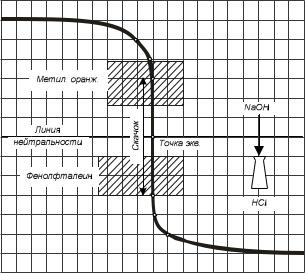
Кривые протолитометрических титрований строят в системе координат, где на оси ординат откладывают pH раствора, а на оси абсцисс – объем израсходованного титранта VR (избыток кислоты или щелочи). На рис. 8 приведена кривая титрования 0,1 Н раствора НСl 0,1 Н раствором NaOH.
Каждая молекула НCl при диссоциации дает один ион Н+, концентрация водородных ионов в 1 л 0,1 Н раствора
кислоты составляет 



 = 0,1, или 10-1 моль. До начала нейтрализации взятый 0,1 Н раствор НСl, имеет рН =1 (рН = -
= 0,1, или 10-1 моль. До начала нейтрализации взятый 0,1 Н раствор НСl, имеет рН =1 (рН = -
lg



 ). Если оттитровать 90 % кислоты (останется 10 % от
). Если оттитровать 90 % кислоты (останется 10 % от
92
первоначального количества), то количество кислоты уменьшится в 10 раз. А при уменьшении общей концентрации кислоты в 10 раз во столько же раз уменьшается концентрация
ионов H+: 



 = 0,01 = 10-2 моль в 1л, рН = 2. При нейтрализации израсходуется 99 % кислоты, общая концентрация кислоты уменьшится в 100 раз по сравнению с
= 0,01 = 10-2 моль в 1л, рН = 2. При нейтрализации израсходуется 99 % кислоты, общая концентрация кислоты уменьшится в 100 раз по сравнению с
первоначальной концентрацией и, следовательно, 



 = 0,001 = 10-3 моль в 1л и рН = 3,0. При нейтрализации 99,9 %
= 0,001 = 10-3 моль в 1л и рН = 3,0. При нейтрализации 99,9 %
кислоты 



 = 0,0001=10-4 и pH=4,0. Когда же будет нейтрализована вся НС1 (100 %) в растворе содержится только соль NaCl, не подвергающаяся гидролизу, концентрация ионов Н+ и ОНбудет одинаковой и рН = 7. Точка эквивалентности совпадает с точкой нейтральности (рН
= 0,0001=10-4 и pH=4,0. Когда же будет нейтрализована вся НС1 (100 %) в растворе содержится только соль NaCl, не подвергающаяся гидролизу, концентрация ионов Н+ и ОНбудет одинаковой и рН = 7. Точка эквивалентности совпадает с точкой нейтральности (рН
= 7).
Если продолжать приливать щелочь к титруемому раствору, то концентрация ионов ОНбудет увеличиваться в таком же порядке, как уменьшалась концентрация ионов H+.
При добавлении 1 % избытка щелочи 



 = 10-3, а
= 10-3, а 



 = 10-11, рН =11,0 и так далее. При добавлении 10 % избытка
= 10-11, рН =11,0 и так далее. При добавлении 10 % избытка
едкого натра 
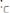


 = 10-2 ,
= 10-2 , 



 = 10-12 и рН = 12. Если добавить 100 % избыток щелочи, то концентрация NaOH в
= 10-12 и рН = 12. Если добавить 100 % избыток щелочи, то концентрация NaOH в
растворе будет 0,1 Н, а концентрация ионов 





 = 10-1;
= 10-1; 



 = 10-13, рН = 13,0 (табл. 12).
= 10-13, рН = 13,0 (табл. 12).
93
|
0 |
|
|
|
|
|
|
|
|
|
|
pH |
|
|
|
|
|
|
|
|
|
|
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ионов |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
концентрации |
6 |
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Показатель |
10 |
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
140 |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
160 |
180 |
200 % |
|
0 |
4 |
8 |
12 |
16 |
20 |
24 |
28 |
32 |
36 |
40 мл |
|
|
|
Количество рабочего раствора NaOH |
|
|
||||||
Рис. 8. Титрование сильной кислоты сильным |
|
||||||||||
|
|
|
основанием (или наоборот) |
|
|
|
|||||
В начале титрования рН раствора изменяется медленно; в конце титрования происходит резкий скачок рН; после эквивалентной точки рН снова изменяется медленно (рис. 8). Таким образом, при нейтрализации 99,9 % кислоты рН изменяется всего на 3 единицы от 0,1 до 0,4, а при переходе от 0,1 % избытка кислоты на 6 единиц от 4,0 до 10,0. В конце титрования прибавление 1-2 капли щелочи понижают концентрацию катионов H+ в растворе от 10-4 до 10-10 моль в литре, в 1000 000 раз.
Резкое изменение рН раствора от последней капли щелочи вызывает и резкое изменение окраски индикатора. Индикатор – это химическое соединение, обладающее способностью изменять свою окраску при изменении
94

концентрации определяемого компонента вблизи точки эквивалентности.
Таблица 12 Изменение pH раствора при титровании 0,1Н раствора
сильной кислоты 0,1Н раствором сильного основания
Прибавлено |
Осталось НС1 |
|
рН |
|||
NaOH |
|
|
|
|
||
|
|
Мл |
% |
Моль/л |
Моль/л |
|
0 |
|
0 |
100 |
0,1 |
10- 1 |
1 |
90 |
|
18 |
10 |
0,01 |
10- 2 |
2 |
99 |
|
19,8 |
1,0 |
0,001 |
10- 3 |
3 |
99,9 |
|
19,98 |
0,1 |
0/101 |
10- 4 |
4 |
100,0 |
|
20,0 |
0 |
0 |
10- 7 |
7 |
|
|
|
|
Избыток NaOH |
|
|
100,1 |
|
20,02 |
0 |
0 |
10- 1 0 |
10 |
101 |
|
20,2 |
0 |
0 |
10- 1 1 |
11 |
110 |
|
22 |
0 |
0 |
10- 1 2 |
12 |
200 |
|
40 |
0 |
0 |
10- 1 3 |
13 |
Для каждого случая титрования пригодны только те индикаторы, показатели титрования (рТ) которых входят в пределы скачка рН на кривой. Скачок титрования сильной кислоты с сильным основанием (и наоборот) находится в области рН от 4,0 до 10,0. Поэтому, при кислотно-основном титровании наиболее употребительны индикаторы: метиловый-оранжевый, метиловый-красный, лакмус и фенолфталеин. Кислотно-основные индикаторы – это слабые органические кислоты или основания, у которых недиссоциированные молекулы и образуемые ими ионы имеют разную окраску. В табл. 13 показана окраска недиссоциированных молекул и анионов при использовании кислотных индикаторов. Окраска молекул индикатора, обладающих кислотными свойствами, проявляется в кислой среде, а окраска анионов в щелочной.
95
Каждый индикатор изменяет окраску только в определенном интервале рН. Интервал значений рН, в пределах которого индикатор изменяет свою окраску, называют областью перехода. Значение рН, до которого титруют раствор с данным индикатором, называют показателем титрования (рТ). Кислотно-основные индикаторы имеют области перехода и показатели титрования, которые
приведены в табл. 14.
Таблица 13 Окраска кислотно-основных индикаторов
Индикатор |
|
|
Окраска |
Окраска анионов |
|
|
|
недиссоцииро- |
|
|
|
||
|
ванных молекул |
|
|
|
||
Метиловый |
|
|
Красная |
|
Желтая |
|
оранжевый |
|
|
|
|
|
|
Метиловый |
|
|
Красная |
|
Желтая |
|
красный |
|
|
|
|
|
|
Лакмус |
|
|
Красная |
|
Синая |
|
Фенолфталеин |
|
Бесцветная |
|
Малиновая |
|
|
|
|
|
|
|
Таблица 14 |
|
Области перехода и показатели титрования |
||||||
|
|
индикаторов |
|
|
|
|
Индикатор |
|
Область |
|
Показатель |
|
|
|
|
|
переходa рН |
|
титрования рТ |
|
|
|
|
|
|
|
|
Метиловый |
|
3,1-4,4 |
|
4.0 |
|
|
оранжевый |
|
|
|
|
|
|
Метиловый красный |
|
4,4-6,2 |
|
5,5 |
|
|
Лакмус |
|
5,0-8,0 |
|
7.0 |
|
|
Фенолфталеин |
|
8,0-10,0 |
|
9.0 |
|
|
Для кислотно-основного титрования наиболее пригоден лакмус, показатель титрования которого рТ = 7,0 входит в пределы скачка и совпадает с точкой эквивалентности. У метилового оранжевого рТ = 4,0, а у
96
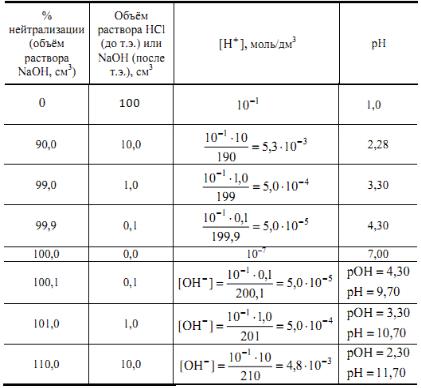
метилового красного рТ =5,5 оба показателя входят в интервал скачка рН на кривой. С этими индикаторами раствор недотитровывают, но на величину, не превышающую 0,1 %. У фенолфталеина рТ = 9 и титрование с ним заканчивают при избытке щелочи, однако раствор перетитровывают на доли капли щелочи (объем капли не превышает 0,03 мл), такой ошибкой можно пренебречь.
Предположим, что для титрования взято 100 см3 0,1 Н раствора HCl, который титруется 0,1 Н раствором NaOH (табл. 15).
Таблица 15 Данные для построения кривой титрования
97
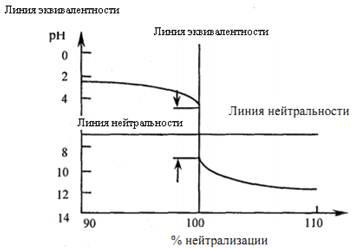
По этим данным строят кривую титрования, рис. 9.
Рис. 9. Общий вид кривых тирования сильной кислоты сильным основанием
Анализ кривой титрования (рис. 9):
– в начале титрования и после точки эквивалентности рН изменяется медленно, а в ТЭ – быстро;
– скачок титрования - (4,3 - 9.7). Следовательно, титрование сильной кислоты раствором сильной щелочи, возможно, проводить в присутствии метилоранжа, метилового красного и фенолфталеина;
– с повышением концентрации титруемого и стандартного растворов увеличивается скачок титрования. Чем выше температура титруемого раствора, тем меньше скачок титрования.
Титрование слабой кислоты слабым основанием
Предположим, что для титрования взято 100 см3 0,1 Н раствора CH3COOH, который титруется 0,1 Н раствором
NaOH.
98
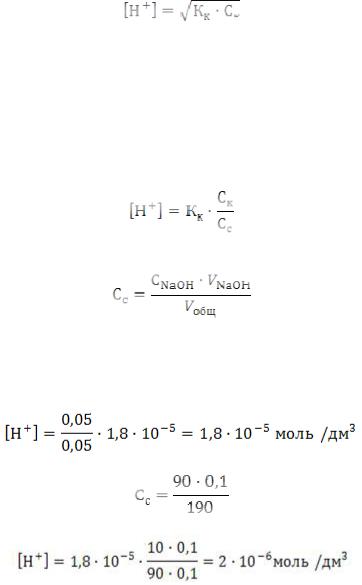
Расчёт [H+] и рН в процессе титрования. До начала титрования:
где Кк = 1,8 •10-5, Cк = 0,1 моль/дм3.
Если прилить к титруемой уксусной кислоте 50; 90; 99,9 см3 0,1 Н раствора NaOH, то наряду со свободной CH3COOH в растворе появится продукт нейтрализации уксусной кислоты
– ацетат натрия. Уксусная кислота с её солью образует буферный раствор.
Во всех промежуточных точках титрования, предшествующих точке эквивалентности, расчет [H+] проводят по формуле:
где Cc – концентрация соли, которую рассчитывают по формуле:
При добавлении 50,0 см3 прореагирует 50 % уксусной кислоты. Следовательно, в растворе останется 0,05 моль/дм3 недиссоциированных молекул кислоты и 0,05 моль/дм3 ацетатионов. Подставив эти значения в расчетную формулу, получим концентрацию ионов водорода в растворе:
При добавлении 90,0 см3 NaOH:
Тогда:
99
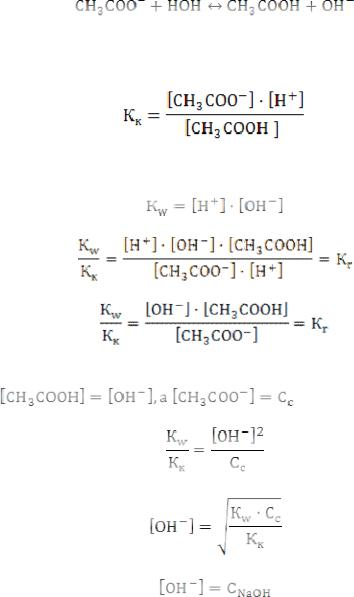
В точке эквивалентности образуется CH3COONa – соль, гидролизующаяся по аниону 



 :
:
Чем слабее кислота, тем больше равновесие смещается в
сторону прямой реакции. Следовательно, [OH-] |
в растворе |
определяется способностью к диссоциации слабой |
кислоты, |
значением её константы диссоциации: |
|
В это выражение не входит интересующая величина [OH-]. Для вывода формулы разделим почленно выражение ионного произведения воды:
на эту величину и получим:
или, сократив [H+] в числителе и знаменателе:
Эта константа характеризует способность соли гидролизоваться. Из уравнения гидролиза следует, что:
Тогда:
Или:
После точки эквивалентности среда щелочная:
100
