
Учебное пособие 2150
.pdf
Эталонно чистые – Э.Ч. 0,01 % примесей; Особо чистые – ОСЧ. 0,00001 примесей;
Вполумикроанализе могут быть использованы «чистые для анализа» или «химически чистые» реагенты.
Воснове аналитических методов - получение измерение аналитического сигнала, любое проявление химических и физических свойств вещества в результате протекания химической реакции. Аналитический сигнал (признак, эффект) – это визуально наблюдаемое или инструментально фиксируемое свойство вещества, вступающее в аналитическую реакцию. К аналитическим признакам визуального наблюдения относятся:
1.Образование (или растворение) осадка с
определенными аналитическими свойствами (цвет, форма кристаллов, растворимость в определенных растворителях). Пример:
Ag+ + Cl– ↔ AgCl↓
белый творожистый осадок (фармакопейная реакция) AgCl↓+ 2NH4OH ↔[Ag(NH3)2] Cl + 2H2O (растворим в концентрированном растворе аммиака)
Ag+ + I- ↔ AgI↓
желтый осадок
AgI↓ + 2NH4OH ≠
не растворим в концентрированном растворе аммиака.
2. Образование растворимого окрашенного продукта. Пример:
Fe3+ + 3SCN– ↔Fe(SCN)3
раствор кроваво-красного цвета 3. Образование газообразного продукта с характерными
свойствами:
NH3


NH4+ + OH– ↔ NH4OH (газ с характерным запахом)
H2O
31
Чувствительность аналитической реакции – это мера способности реагента давать уверенно обнаруживаемый аналитический признак с определяемым объектом. Термин «чувствительность» в настоящее время заменен на термин «предел обнаружения», который выражается целым рядом взаимосвязанных величин: открываемый (обнаруживаемый) минимум (mmin), предельная концентрация (Cmin), предельное разбавление (W), показатель чувствительности.
Количественно чувствительность реакции
характеризуют пределом обнаружения и минимальной концентрацией. Предел обнаружения – это наименьшее количество вещества, которое может быть обнаружено с помощью данной реакции. Его выражают в микрограммах
(1мкг = 10-6 г). Минимальная концентрация показывает, при каком разбавлении раствора данная реакция ещё позволяет однозначно определить искомое вещество.
Открываемый минимум (mmin) – наименьшая масса
(мкг) открываемого компонента, которую можно обнаружить данной реакцией.
Предельная концентрация (Сmin) – наименьшая концентрация обнаруживаемого компонента, при которой его можно открыть данной реакцией в капле раствора:
mmin = Сmin •Vmin •106.
Минимальная концентрация выражается отношением 1:10000, то есть на 1г вещества в растворе приходиться, но более 10000 мл H2O. Величины обнаруживаемого минимума и минимальной концентрации связаны уравнением:










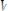






 ,
,
где С – минимальная концентрация; m – обнаруживаемый минимум; V – объем раствора, взятый для выполнения
реакции. Например, Cmin = 2•10-5 г/мл, то искомый ион обнаруживают при условии, что его концентрация выше 2•10-5
г/мл. Чаще используется отрицательный логарифм предела обнаружения (табл. 2): 










 .
.
32

Таблица 2
Пределы обнаружения реакции
Предел обнаружения реакции |
pCmin |
Высокий |
3-4 |
Средний |
5-6 |
Низкий |
7-8 |
Величина, обратная Сmin, называется предельным разбавлением:
1Vmin 106
W = ------- = --------------, (см3/г).
Cmin mmin
Аналитическая реакция тем чувствительней, чем меньше обнаруживаемый минимум и предельная концентрация анализируемого вещества. Чем меньше mmin, Сmin, и чем больше W и pW, тем чувствительнее данная реакция. Обычно качественные реакции имеют предел обнаружения (минимальная концентрация) до 10-8 г/см3 для визуального наблюдения аналитического сигнала и 10-15 г/см3 в инструментальном анализе.
Чувствительность аналитической реакции зависит от условий проведения реакции: температуры, рН среды, концентрации анализируемого вещества и реагента, наличия мешающих ионов, продолжительности реакции, типа аналитической реакции и аналитического признака.
Чувствительность реакции может быть повышена тем или иным способом:
1. Концентрированием определяемого компонента, экстрагирования органическим растворителем, мешающих или определяемых компонентов, соосаждением с коллектором (неорганическим или органическим веществом, которое осаждает анализируемый компонент). Примеры коллекторов: Fe(OH)3, Al(OH)3, метиловый оранжевый.
2. Понижением растворимости осадка за счет добавления органического растворителя:
33

|
C2H5O4 |
|
Ca2+ + H2SO4 ↔ CaSO4↓+ 2H+. |
|
|
3. Маскировки мешающих компонентов. Пример: |
|
|
|
Fe3+ |
|
|
Co2+ + SCN- ↔ [Co(SCN)4]2– |
|
+ NaF |
[FeF6]3– синяя окраска комплексного соединения |
|
|
б/ц |
|
4. Создание необходимого значения рН среды или |
||
температуры: |
|
|
|
Fe3+ + 3SCN– ↔ NH4SCN |
|
|
K+ + H2C4H4O6 ↔ KHC4H4O6 + H+↓. |
|
Аналитические реакции можно проводить «сухим» и |
||
«мокрым» путем. Реакции, проводимые «сухим» |
путем |
|
делят |
на механохимические (или «порошковый анализ») и |
|
пирохимические. «Порошковый анализ» впервые был предложен Ф.М. Флавицким в 1918 г., а позднее разрабатывался П.М. Исаковым. Метод основан на расширении твердого анализируемого вещества с твердым реагентом в фарфоровой ступке. Открываемый ион обнаруживается по цвету или запаху. Пример:
CH3COOK + KHSO4 ↔ K2SO4 + CH3COOH.
|
(специфический запах) |
|
К пирохимическим реакциям |
относят |
реакции |
окрашивания бесцветного пламени горелки при внесении в
него ряда летучих золей (К+ – в фиолетовый, Na+ – в желтый, Ba2+ – в желто-зеленый, Са2+ – в коричнево-красный; Sr2+ –
красный; Tl3+ – зеленый; In3+ – синий и другие) и реакции образования окрашенных перлов, полученных при нагревании вещества с тетраборатом натрия, фосфата натрия в ушке из платиновой проволоки: при сплавлении Na2B4O7 и Co2+ , Na2B4O7 и Ni2+ образуют «перлы» буры различной окраски.
Пример: Соединения Cu3+ окрашивают перл в изум- рудно-зеленый цвет.
Реакции «сухим» путем проводят в основном в предварительных испытаниях. Реакции «мокрым» путем
34
проводят в растворах. Способы выполнения реакций «мокрым» путем: пробирочный и капельный.
Пробирочный способ: в пробирку вносят несколько капель анализируемого раствора, создают необходимые условия (T0, рН) добавляют несколько капель реагента и наблюдают за внешним эффектом. Основоположниками капельного анализа являются русский ученый И.А. Тананаев и австрийский ученый Ф. Файгль. Реакции проводят на стеклянных, фарфоровых пластинках, часовом стекле, используя для реакций 1-2 капли реагентов.
К капельному способу проведения аналитических реакций можно отнести микрокристаллический и хроматографический анализ на фильтровальной бумаге.
Микрокристаллический анализ предложен в 1804 г. академиком Российской академии наук Т.Е. Ловицем. Реакция проводится на предметном стекле, продуктами реакции являются кристаллы, обладающие характерной формой, цветом и размерами. Для рассматривания кристаллов используется микроскоп. Пример:
K+ + ClO4 – ↔ KClO4.
(белые кристаллы в форме усеченных призм).
При выполнении реакции на фильтровальной бумаге используются ее капиллярно-адсорбционные свойства. Жидкость всасывается бумагой, а образовавшееся окрашенное соединение адсорбируется на небольшом участке бумаги. Способ используется как для обнаружения, так и разделения и количественного определения веществ. Причем анализ можно провести в таких растворах, которые нельзя анализировать обычными способами. Чаще всего аналитические реакции проводят в растворах. Анализируемый объект (индивидуальное вещество или смесь веществ) может находиться в любом агрегатном состоянии (твердом, жидком, газообразном). Объект анализа называется образцом, или пробой. Один и тот же элемент в образце может находиться в различных химических формах. Например: S0, S2-, SO42-.
35
В зависимости от цели и задачи анализа после переведения в раствор пробы проходят элементный анализ (определение общего содержания серы в каждой фазе или ее отдельных химических формах). Выполняя ту или иную аналитическую реакцию необходимо строго соблюдать определенные условия ее протекания (температура, рН раствора, концентрация) с тем, чтобы она протекала быстро и имела низкий предел обнаружения.
Классификация аналитических реакций
По числу компонентов, взаимодействующих в данных условиях с реагентом и дающих аналитические сигналы, реакции и реагенты подразделяют на групповые, избирательные и специфические.
I.Групповые реакции: один и тот же реактив реагирует
сгруппой ионов, давая одинаковый сигнал. Групповыми
называют реакции, когда с реагентом в данных условиях взаимодействует целая группа ионов. Применяемый в таких условиях реагент называется групповым. Так, для определения группы ионов (Ag+, Pb2+, [Hg2]2+) используют
реакцию их с 

 - анионами, при этом образуются белые
- анионами, при этом образуются белые
осадки (AgCl, PbCl2 , Hg2Cl2). Например, S2-- анионы при рН = 0,5 осаждают ионы Аg+, Рb2+, Вi2+, Cd2+, Sn2+, Sn4+:
Рb2+ + S2- PbS .
Групповые реакции используются для разделения групп ионов. Групповыми называют реагенты, взаимодействующие с группой ионов с одинаковым аналитическим эффектом, и позволяющие отделить одну группу ионов от другой. Пример:
2М раствор HCl - групповой реагент для ионов Ag+, [Hg2]2+ и
Pb2+:
Ag+ + HCl ↔ AgCl + H+
Pb2+ + 2HCl ↔ PbCl2 + 2H+ [Hg2]2+ + 2HCl ↔ Hg2Cl2 + 2H+.
белые осадки Требования к групповым реагентам:
36
1.Практически полное осаждение ионов, концентрация их после отделения осадков не должна превышать 10–6 моль/дм3.
2.Хорошая растворимость, образовавшегося осадка в кислотах или щелочах, что облегчает дальнейшее проведение
анализа.
3. Избыток его не должен мешать обнаружению других ионов.
4.Селективность.
II. Избирательные (селективные) реакции.
Избирательными называют реакции, в которых с реагентом
взаимодействует и даёт сходный сигнал ограниченное число ионов. Например:
1. Оксалат аммония (NH4)2C2O4 образует осадки с катионами Са2+, Ba2+, Sr2+:
CaCl2 + (NH4)2C2O4 = CaC2O4↓ + 2NH4Cl.
2. Йодокрахмальная реакция (впервые ее описал в 1815 г. Ф. Штромейер).
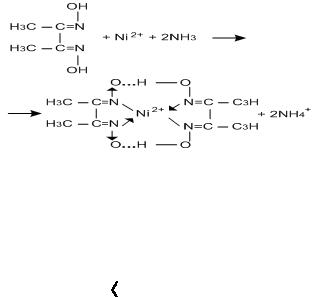
Для этих целей используют органические реагенты. Пример: диметилглиоксим + 




 образование ало-
образование ало-
красного осадка диметилглиоксимата никеля. Изменяя условия протекания аналитической реакции, можно неизбирательные реакции сделать избирательными (например, при нагревании).
Характерные реагенты взаимодействуют с одним (специфические реагенты) или небольшим числом ионов (селективные реагенты).
Селективные реакции:
а) |
Zn2+ |
|
|
Ca2+ |
+ K4[Fe(CN)6] ↔ осадки различного цвета |
|
Cu2+ |
селективный реагент |
|
Fe3+ |
|
б) |
NH4+ |
|
37
K+ + NaHC4H4O6 ↔ белые кристаллические осадки гидротартрат Na или виннокаменная кислота
H2C4H4O6.
Степень селективности реакции тем больше, чем меньше число ионов дает данный аналитический эффект с реагентом. Селективность можно повысить теми же способами, что и чувствительность.
III. Специфические реакции. Аналитическую реакцию называют специфической, если она позволяет обнаружить одни ионы в присутствии других по специфическому изменению цвета, образованию характерного осадка, выделению газа или другому сигналу, присущему только этому виду ионов. Например, с диметилглиоксимом в аммиачной среде только катионы Ni2+ образуют красный осадок - диметилглиоксимат Ni (II), Реакция Л.А. Чугаева:
Специфична реакция обнаружения иона NH4+ действием щёлочи при нагревании, так как в этих условиях аммиак выделяется только из солей аммония (а):
NH4С1 + NaOH → NH3↑ + Н2О + NaCl.
Также специфична реакция на йод I2 с крахмалом (б). Однако специфичных реакций мало.
NH3↑(специфический запах)
H2O
б) I2 + крахмал ↔ комплексное соединение (синяя окраска).
Реакции комплексообразования используются для целей маскирования мешающих ионов.
38
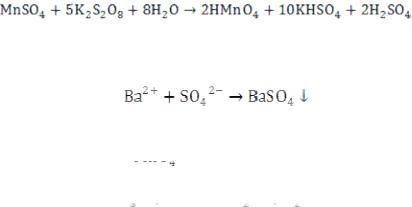
Пример: Для обнаружения катиона Со2+ в присутствии Fe3+ - ионов с помощью KSCN, реакцию проводят в присутствии 
 - ионов. При этом ионы железа не мешают
- ионов. При этом ионы железа не мешают
определению Со2+ - ионов.
Реакции окисления - восстановления:
Реакция комплексообразования:
 .
.
Реакция осаждения:
Появление, изменение, исчезновение окраски раствора (цветные реакции): бесцветный Mn2+, зеленый
Mn6+ , фиолетовый 





 .
.
Выделение газа:


























 .
.
Чтобы иметь возможность проведения групповых реакций для разделения, и характерных для обнаружения нужно знать различие и сходство химико-аналитических свойств анализируемых компонентов. К основным химикоаналитическим свойствам относят: способность образовывать различные типы ионов, их окислительно-восстановительные и кислотно-основные свойства, склонность к комплексообразованию, окраска и растворимость. Согласно
периодическому закону Д.И. Менделеева свойства химических
элементов и их соединений находятся в периодической зависимости от величины заряда ядра атома. С увеличением заряда ядра электронное строение внешнего энергетического уровня периодически повторяется (электронная аналогия), а это приводит к повторяемости свойств (химической аналогии). Наиболее четко это проявляется в образовании различного типа ионов (по зарядности и электронному строению), величине их радиусов, энергии ионизации и как следствие этого проявлению кислотно–основных,
39
окислительно–восстановительных и других аналитических
свойств.
s-элементы, имеющие 1 или 2 валентных (ns1–2)
электрона, легко отдают их, превращаясь в простые катионы
(K+, Na+, Ca2+, Ba2+, Sr2+, Mg2+).
Р-элементы имеют на внешнем энергетическом уровне 2s-электрона и 1-6 p-электронов (ns2np1–6). Отдавая эти
электроны, они могут, образовывать простые катионы (Al3+, Sn2+, Sn4+, Pb2+, Pb4+ и другие) и сложные анионы, где
элементы имеют разные степени окисления (SO32–, SO42–, BiO3–, [SbCl6]3– и другие анионы). Принимая электроны, р- элементы образуют простые анионы: Cl–, S2–, Br–, I– и другие анионы.
d-элементы (n–1)d1–10ns1-2 способны отдавать внешние s- электроны и неспаренные d-электроны с предвнешнего d-
подуровня, образуя при этом простые катионы (Mn2+, Cr3+, Zn2+, Fe2+, Fe3+) и сложные анионы (MnO4–, CrO42– и другие
ионы). Радиусы ионов в пределах одной группы (главной подгруппы) с ростом заряда ядра возрастают, а в периодах - уменьшаются. Радиусы d-элементов меньше, чем s и p- элементов, вследствие d-сжатия. Величина радиуса иона оказывает влияние на кислотно-основные свойства гидроксидов и водородных соединений элементов (табл. 3).
Радиус иона оказывает влияние на его способность к поляризации, смещению электронной плотности относительно ядра вследствие влияния ионов в соединении друг на друга. Мерой поляризующей способности является ионный потенциал:
Ri = Z / r, где Z – заряд иона, r – радиус иона.
Чем больше ионный потенциал катиона, тем больший поляризующий эффект он оказывает. Степень поляризации связана с цветностью соединения и растворимостью: чем больше поляризующее действие катиона на анион, тем прочнее они связаны, тем хуже соединение растворимо в воде и тем вероятнее появление окраски у соединения.
40
