
Учебное пособие 2150
.pdf
По этим константам можно рассчитать соотношение форм H4Y при любом выбранном значении рН. Зависимость
величины α (мольной доли) анионов 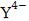 от рН представлена в табл. 19. С ростом pH
от рН представлена в табл. 19. С ростом pH 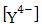 увеличивается. При рН
увеличивается. При рН

 12
12
H4Y присутствует в форме анионов 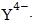
В общем виде реакцию комплексообразования можно записать так:
Таблица 19
Зависимость α от рН
Строение внутрикомплексной соли кальция можно представить следующим образом:
Образующиеся при этом соединения отличаются
достаточно малыми величинами |
(например: для |



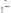










 ,
, 










 ,
, 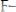












 ).
).
При этом устойчивость комплексонатов щелочных металлов очень мала, а щелочноземельных металлов существенно меньше, чем переходных металлов. Чем выше
121

заряд иона металла, тем более устойчивый образуется комплекс, соли Fe(III) образуют более устойчивые комплексонаты, чем соли Fe(II).
Устойчивость комплексов ЭДТА в растворах зависит от природы раствора, ионной силы, температуры, кислотности раствора и его химического состава.
В качестве титранта используют 0,05; 0,025 Н растворы трилона Б рН, которые регулируют буферными растворами

















 .
.
Прямое комплексонометрическое титрование применяют для определения содержания магния, кальция, цинка, свинца, висмута в лекарственных препаратах, для контроля жёсткости воды, при раздельном определении Ca2+ и Mg2+ в различных природных объектах, а также определения содержания никеля в легированных сплавах. Используя обратное титрование, можно определить не только Men+ - катионы, но и анионы.
Металлоиндикаторы – это органические реагенты, обратимо изменяющие окраску под влиянием Men+ - ионов. Индикаторы комплексонометрии также образуют с ионами нутрикомплексные соли, которые по условиям титрования должны быть менее устойчивы по сравнению с комплексонатами ионов данного металла; причём цвет комплексонов должен отличаться от цвета свободного индикатора. Соотношение устойчивости:
В качестве индикаторов в комплексонометрии применяют красители: мурексид, кислотный хром тёмносиний, кислотный хромоген чёрный специальный (эрихром чёрный Т). Последние два в щелочной среде имеют синюю окраску. Ионы кальция, магния и ряда других металлов образуют с индикаторами внутрикомплексные соединения (MeInd), окрашенные в вишнёво-красный цвет.
122
По ходу титрования образуются более устойчивые
комплексонаты металлов состава  .
.
Вблизи точки эквивалентности, когда оттитрованы все ионы металлов, трилон Б взаимодействует с комплексом Me Ind и разрушает его и раствор приобретает синюю окраску.
1. Кислотный хром тёмно-синий относится к группе азокрасителей. Формула: 2-[(5-хлор-2-оксифенил)азо]-1,8- диоксинафталин-3,6-дисульфокислоты динатриевая соль
C16H13ClN2Na2O11S2. Определяемые катионы Ca2+ (ФС), Mg2+, Zn2+. Изменение окраски при рН=9,5-10 раствора от красной
(комплекс) до сине-фиолетовой (свободный индикатор):
Анион при рН > 9,3 в водном растворе окрашен в синий цвет, а комплексы с Ca2+, Mg2+, Ba2+, Zn2+ окрашены в
красный цвет.
2. Эриохром черный Т (кислотный хром черный специальный) (4Z)-4-[(1-гидроксинафталин-2 илгидра- зинилиден]-7-нитро-3-оксо-Y-нафталин-1-сульфонат натрия
C20H12N3O7SNa. Определяемые катионы Zn2+, Mg2+ (ФС) , Ca2+. Изменение окраски при рН = 9,5-10 раствора от красно-
фиолетовой (комплекс) до синей (свободный индикатор). Применяется в качестве комплексометрического индикатора для определения катионов Mg, Mn, Pb, Zn, Cd, In, Zr, лан таноидов. В интервале рН 9,5-10,0 имеет синюю окраску, а его комплексы с катионами кальция, магнияи цинка в тех же условиях краснофиолетового цвета. Формула:
123
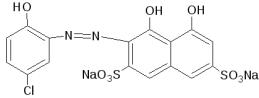
3. Мурексид – органический краситель однозамещённая аммонийная соль пурпурной (5,5′-
нитрилодибарбитуровой) кислоты NH4C8H4N5O6. Цвет раствора индикатора зависит от рН среды: при рН > 10,3 – лиловый (сине-фиолетовый). Комплексы катионов металлов с мурексидом окрашены в различные цвета. Например, катион Ca2+ - красного, катион Ni2+ - жёлтого цвета. Формула:
Кривые комплексометрического титрования. Скачок
титрования
В качестве примера рассмотрим титрование 




 ионов
ионов
раствором ЭДТА при различных значениях рН. Зависимость 



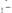











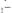


 от объёма титранта представлена на рис.
от объёма титранта представлена на рис.
12. Как видно из кривой титрования 





 раствором ЭДТА
раствором ЭДТА
при рН = 6 скачка практически нет. Скачок титрования увеличивается с ростом рН.
124
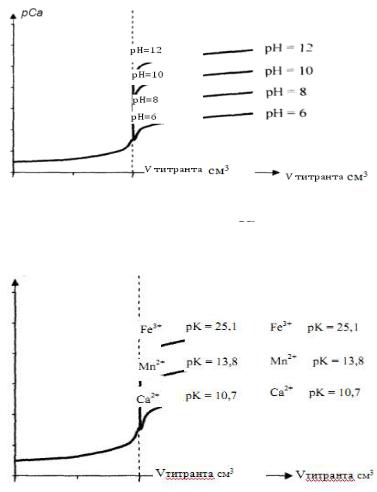
Рис. 12. Кривая тирования катионов 




 раствором ЭДТА
раствором ЭДТА
при различных рН
Рис. 13. Зависимость скачка титрования от комплексоната (рК) и от природы 




 катионов
катионов
125
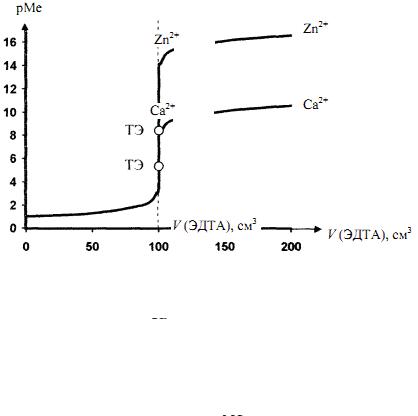
Рис. 14. Кривые тирования 100 см2 0,1 Н растворов, содержащих катионы 




 или Zn2+ 0,1 раствором ЭДТА при
или Zn2+ 0,1 раствором ЭДТА при
рН = 4
Зависимость скачка титрования от константы нестойкости (Кн) комплекса при конкретном значении рН или рК комплексоната и от природы 




 катионов представлена
катионов представлена
на рис. 13 и 14. Чем меньше величина Кн, тем устойчивее комплекс. Чем больше рК, тем прочнее комплексное соединение при конкретном значении рН. Для использования реакции комплексообразования в аналитических целях (полнота протекания 99,9 %) константа нестойкости должна Кн≤10-8.
Анализ кривых комплексонометрического
титрования:
– чем больше скачок титрования, тем увереннее можно фиксировать конечную точку титрования визуальным индикаторным методом;
126

– чем меньше 


 комплексоната металла, тем больше
комплексоната металла, тем больше
скачок титрования; для малоустойчивых комплексонатов щелочных металлов данный метод не применим;
–концентрация реагентов (титруемого катиона металла
ититранта) существенно влияет на величину скачка титрования; он растёт с увеличением концентрации; при
концентрации катионов металла 






 моль/дм3 скачок
моль/дм3 скачок
отсутствует;
– на скачок титрования резко влияет рН титруемого раствора: изменяя рН, можно определять, раздельно смеси катионов различных металлов; например, при рН = 2 комплексонометрически можно определить Fe(III) и Zr(lV) в присутствии других катионов 


 .
.
Лекция № 11 Осадительное титрование. Общая характеристика метода
Метод титриметрического анализа, основанный на применении титрантов, образующих с анализируемым веществом малорастворимые соединения, называется осадительным титрованием. Методы осадителыного титрования основаны на реакциях образования осадков малорастворимых соединений. Образующийся осадок должен быть практически нерастворимым и выпадать быстро, без образования пересыщенных растворов. Эквивалентная точка наступает тогда, когда исследуемое вещество полностью переходит в осадок.
Осадительные методы основаны на реакции:
Ag+ + X- = AgX , где X- анионы Cl-, Вr-, I-, CNS-.
Метод Мора является одним из аргентометрических методов. В основу метода Мора положена реакция взаимодействия катионов Ag+ с анионами С1-, Вr- с образованием малорастворимых галогенидов:
CI- + Ag+ = AgС1 , Br- + Ag+ = AgBr .
127
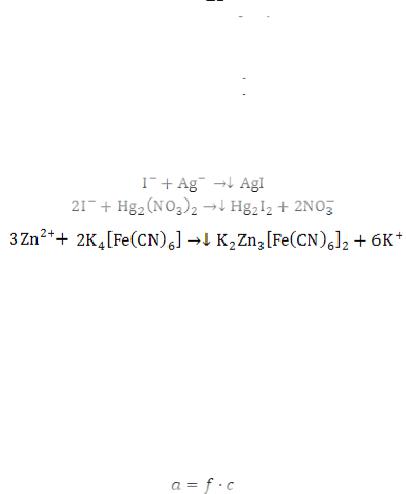
Аргентометрическое определение хлора по методу Мора заключается в прямом титровании анализируемой жидкости раствором AgNО3 с индикатором - раствором хромата калия К2СrО4, дающим с ионами серебра красно-бурый осадок хромата серебра Ag2CrO4. Растворимость AgCl (1,25*10-5 г/л) меньше, чем растворимость Аg2СгО4 (0,65∙10-4 г/л), поэтому
ПРAgCl достигается раньше 











 . Это означает, что вначале происходит образование труднорастворимой соли AgCl. После того как анионы Clполностью выделены в виде AgCl и добавления избытка катионов Ag+ появляется красный
. Это означает, что вначале происходит образование труднорастворимой соли AgCl. После того как анионы Clполностью выделены в виде AgCl и добавления избытка катионов Ag+ появляется красный
осадок Ag2CrO4: 2Ag+ + 





 = Ag2CrO4↓. Окраска титруемой смеси изменяется с белой на красно-бурую и определяется конец титрования. Этот метод применяется для определения хлоридов в воде и различных продуктах. Пример:
= Ag2CrO4↓. Окраска титруемой смеси изменяется с белой на красно-бурую и определяется конец титрования. Этот метод применяется для определения хлоридов в воде и различных продуктах. Пример:
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми, подчиняются закону действия масс и характеризуются константой равновесия, так называемым произведением растворимости
(ПР).
ПР – постоянная величина, равная произведению активностей ионов малорастворимого электролита в его
насыщенном растворе.
Активность (a) – функция состояния вещества, являющаяся количественной характеристикой его реакционной способности в данных условиях:
128
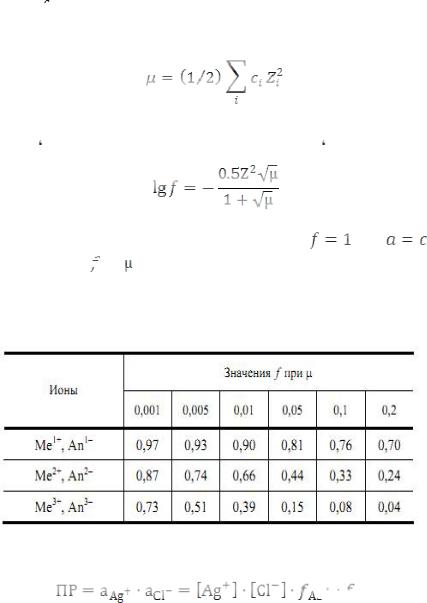
где  – коэффициент активности, который учитывает межионное взаимодействие и зависит от ионной силы раствора (µ):
– коэффициент активности, который учитывает межионное взаимодействие и зависит от ионной силы раствора (µ):
где 

 – концентрация
– концентрация  -го иона в растворе;
-го иона в растворе; 
 - заряд иона.
- заряд иона.
В сильно разбавленных растворах |
и |
. |
Зависимость  от представлена в табл. 20.
от представлена в табл. 20.
Таблица 20 Значение коэффициента активности в зависимости от μ
Для AgCl (насыщенный раствор) имеем:








 ,
,
129

где |
и |
– активности соответствующих ионов; |
и |
– |
равновесные концентрации тех же ионов, |
моль/дм3; 




 и
и 



 – коэффициенты активности ионов.
– коэффициенты активности ионов.
В растворах малорастворимых веществ концентрации ионов малы и мало отличаются от активности ионов, коэффициенты активности близки к единице, следовательно, ПР ( AgCl ) можно записать в виде следующего выражения:
В общем виде для малорастворимого электролита АаBb:
Величины ПР даны в справочных таблицах, прил. 1. Для сравнения растворимости осадков пользуются не величинами ПР, а растворимостью, которая равна равновесной концентрации ионов в растворе над осадком. Для электролитов типа AB растворимость:
Растворимость малорастворимого соединения состава АаBb равна:
Требования, предъявляемые к реакциям осаждения
восадительном титровании:
1.Анализируемое вещество должно хорошо растворяться в воде с образованием бесцветного раствора и
содержать хотя бы один ион, вступающий в реакцию осаждения с титрантом.
130
