
Учебное пособие 2150
.pdfОтдавая s-валентные электроны, они образуют катионы
Кt+ или Кt2+ с устойчивой 8-электронной оболочкой Na+: 1s2 2s2 р6 3s0 и Са2+: 1s2 2s2 р6 3s2 р6 4s0. Большой радиус этих ка-
тионов обусловливает их слабое поляризующее действие. Катионы s-элементов образуют в основном хорошо растворимые бесцветные соединения. Катионы щелочных металлов (IА подгруппа) образуют растворимые в Н2О гидроксиды, причём LiOH, отличающийся наименьшим радиусом иона, менее растворим, чем гидроксиды остальных щелочных металлов. Гидроксиды щелочноземельных металлов (IIА подгруппа) менее растворимы, чем гидроксиды щелочных металлов причём их растворимость понижается от Rа, отличающегося наибольшим радиусом иона, к Ве, обладающему наименьшим радиусом иона.
Растворимость сульфатов элементов IIА группы периодической системы уменьшается в обратном порядке от Ве к Ra, по мере увеличения радиусов ионов. Наиболее
растворим ВеSО4 (rBe2+ = 0,034 нм), а наименее растворимы ВаSО4 и RaSO4 (rBа2+ = 0,143 нм, а rSO42- = 0,295 нм), чем меньше разница между размерами радиусов катионов и
анионов, образующих соединение, тем менее оно растворимо. В связи с этим 1 и 2-ю аналитические группы нельзя выделить из смеси одним реагентом и число аналитических реакций для этих ионов невелико. Исключение катиона Мg2+, находящегося во IIА подгруппе периодической системы, из 2- й аналитической группы, обусловлено удобством анализа. МgCO3, как и карбонаты катионов 2-й группы, малорастворим в Н2О. Однако в отличие от них он растворяется в избытке солей аммония и катион Мg2+ не может быть полностью осаждён действием (NH4)2CO3. Поэтому, разделяя смеси катионов 1 и 2-й групп в присутствии NH4Cl, оставляют катион Мg2+ в растворе с катионами 1-й группы.
Катионы 3-й аналитической группы, осаждаемые в виде гидроксидов, находятся главным образом в IIIА - Аl, IIIВ
51
и IVВ подгруппах, за исключением Ве2+, находящегося в IIА и Сr3+ – в VIВ группах. Катионы этой группы, осаждаемые (NH4)2S из аммиачно-щелочного раствора в виде сульфидов, растворимых в кислотах, находятся в середине 4-го периода
– это d-элементы – и IIIА подгруппы (Ga, In, Тl) – это р- элементы.
Основные катионы 4-й аналитической группы – это р-
элементы IVА (Gе, Sn) и VА (Аs, Sb) подгрупп и d-элементы
6-го периода (Re4+, Ir4+, Рt4+) и VIIIВ (Pd2+) подгрупп,
образующие нерастворимые сульфиды.
В 5-ю аналитическую группу входят р- и d-элементы, осаждаемые в виде нерастворимых хлоридов, не принадлежащие к определённой группе периодической системы.
В главных подгруппах III, IV, V, VI, VII группы периодической системы расположены р-элементы. Они имеют по 2 s-электрона и 1-6 р-электронов. Отдавая p-электроны, эти элементы образуют ионы с (18+2)-электронной оболочкой, а отдавая и р-, и s- электроны, образуют ионы с 18-электронной оболочкой. Такие ионы, особенно с 18-электронной оболочкой, обладают сильным поляризующим действием, поэтому в растворах присутствуют в виде комплексных ионов:
Sn(II) → [SnCl4]2-, [Sn(ОН)4]2-; Sn(IV) → [SnCl6]2-, [Sn(ОН)6]2-.
Поэтому для ионов р-элементов характерны реакции окисления-восстановления (только алюминий имеет одну степень окисления Аl3+) и в некоторой мере реакции комлексообразования. В связи с поляризующим действием ионов многие их соединения окрашены и малорастворимы, что позволяет выделять их из смеси, используя процесс осаждения.
Впобочных подгруппах или между s и р-элементами в 4
и5-ом периодах периодической системы элементов Д.И. Менделеева расположены d-элементы. Они имеют 2 и от 1 до
52
10 d-электронов. Сюда же относятся три элемента с достроенным d-подуровнем: Zn, Сd, Нg. Эти три элемента отдают только s-электроны и образуют катионы со степенью окисления (+2). Остальные элементы могут отдавать различное число электронов, образуя катионы с разной степенью окисления. Катионы d-элементов имеют 18-n или 18 - электронную оболочку. Катионы с недостроенными 18электронными оболочками интенсивно окрашены и вступают в реакцию окисления-восстановления; ионы d-элементов с 18электронными оболочками проявляют свойства комплексообразователей, образуя комплексные соединения, некоторые из которых окрашены и малорастворимы. Элементы этой группы, как и р-элементы, могут быть выделены из сложной системы в виде малорастворимых соединений. Близость свойств некоторых s и р-элементов, особенно их ионов, не даёт возможности чёткого разделения этих элементов на отдельные группы. Иначе говоря, s-, р- и d- элементы и их ионы не относятся строго к трём разным аналитическим группам. Аналитические классификации построены с учётом свойств ионов, обусловленных принадлежностью к s-, р- и d-элементам, но не идентичны распределению элементов по группам периодической системы Д.И. Менделеева.
Лекция № 5 Закон действия масс и его значение в анализе.
Применение ЗДМ на практике
Общие понятия о скорости химической реакции
Каждая химическая реакция протекает в течение некоторого промежутка времени и имеет большую или меньшую скорость. Скорость реакции характеризуется количеством вещества, вступившего в реакцию в единицу времени, или изменением концентрации одного из реагирующих веществ в единицу времени:
53
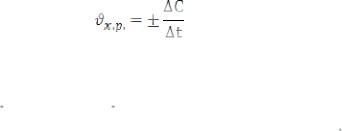
При указании скорости реакции концентрацию принято выражать числом грамм-молекул вещества в 1л, а время – в секундах или минутах. Следовательно, размерность скорости
– моль/сек л или моль/мин л.
Например, если скорость реакции 0,3 моль/мин л,
это значит, что за данную единицу времени концентрация реагирующего вещества в 1л уменьшилась на 0,3 моль. Скорость реакции зависит от природы реагирующих веществ, от условий, при которых она протекает. Важнейшими факторами, влияющими на скорость реакции, являются:
–природа реагирующих веществ,
–концентрация реагирующих веществ,
–присутствие катализатора и условия протекания
реакции (температура, давление, интенсивность перемешивания, воздействие различных видов излучения).
Закон действия масс (применим только для
обратимых реакций)!
Химическая реакция протекает только при столкновении молекул реагирующих веществ. Чем больше молекулярная концентрация участвующих в реакции веществ, и больше число молекул или частиц реагирующих веществ находится в единице объема, тем чаще будут происходить столкновения между молекулами или частицами этих веществ и тем больше вещества успеет вступить в реакцию в единицу времени, тем больше будет скорость реакции.
Зависимость скорости реакции от концентрации выражается законом действия масс, который формулируется следующим образом: скорость химической реакции при
данной температуре прямо пропорциональна произведению концентрации реагирующих веществ. 1865г. Закон Н.Н.
Бекетова.
Например, для реакции:
54
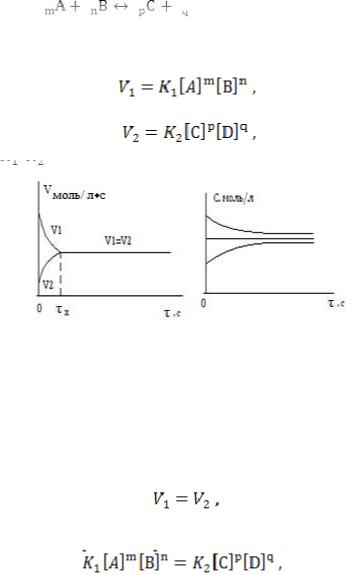


 (реакция обратима)
(реакция обратима)
Графически скорость реакции можно представить в виде, рис. 3. Согласно ЗДМ, скорость прямой реакции определяется по соотношению:
Скорость обратной реакции по уравнению:
где 
 ,
, 

 – константы скоростей прямой и обратной реакции.
– константы скоростей прямой и обратной реакции.
Рис. 3. Изменение концентрации веществ во времени
Значение константы скорости зависит от природы реагирующих веществ и от температуры, но не зависит от концентрации. Для каждой реакции при данной температуре константа скорости есть величина постоянная. При достижении химического равновесия (состояние системы, когда скорость прямой реакции равна скорости обратной) соблюдается равновесие:
Если равны левые части уравнений, следовательно, равны и правые:
55
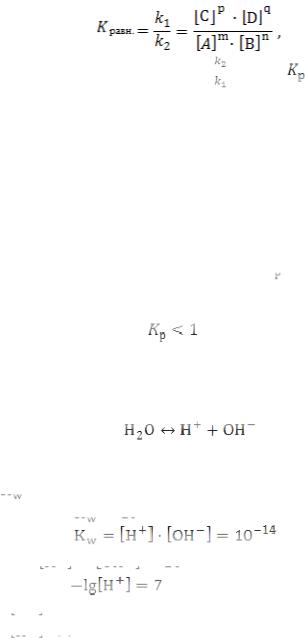
Обозначим соотношение |
|
как |
– константа |
|
химического равновесия. Равновесную концентрацию вещества можно обзначать двумя способами: C или [].
Таким образом, получим следствие из ЗДМ. При установившемся химическом равновесии отношение произведения концентрации продуктов реакции к произведению концентраций исходных веществ есть константа химического равновесия. Выражение (5) является математической записью следствия ЗДМ. Отметим, что равновесие в системах является динамическим,
следовательно, его можно смещать. Если 




 , то в данный момент времени равновесие смещено в сторону прямой
, то в данный момент времени равновесие смещено в сторону прямой
реакции |
и в реакционной смеси |
концентрация продуктов |
|
реакции |
больше, если |
, то равновесие смещено в |
|
сторону |
обратной |
реакции и |
в реакционной смеси |
преобладает концентрация исходных веществ.
Вода – слабый электролит. Вода является слабым электролитом, то справедливо:
Применяем закон действия масс:
[H+] ∙ [OHˉ] / [HOH] = Kp∙ [H+] ∙ [OHˉ] = Kp∙[HOH] / Kw ,
где 

 – константа (ионное произведение воды), при 22
– константа (ионное произведение воды), при 22 
 С.
С.









 ,
,
,









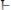










 среда нейтральная
среда нейтральная
если 
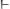

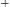



 , то среда кислая если
, то среда кислая если 
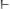

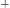




 , то среда щелочная
, то среда щелочная
56

Заменим символ –lg на р, получим рН:










 .
.
Для сильных электролитов (в растворе сильных кислот):
В растворе сильных оснований: |
или |











 .
.
Расчет рН для слабых электролитов 1. Для слабых кислот:
Применим ЗДМ:
2. Соответственно для слабого основания формула примет вид:
Буферные смеси
Растворы, содержащие слабую кислоту (основание) и ее соль и оказывающие буферное действие называются буферными. При умеренном разбавлении и при добавлении к небольших количеств кислот или щелочей буферные растворы сохраняют значение рН. Это свойство называется
57
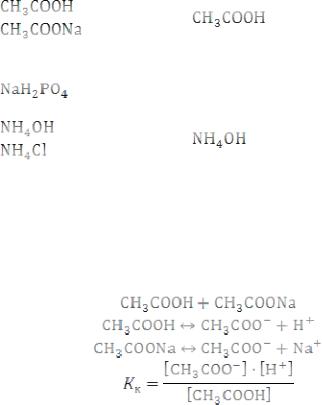
буферным действием. Буферное действие не безгранично и оно зависит от качественного и количественного состава буферного раствора. Наиболее часто применяемые буферные смеси представлены в табл. 6.
|
|
|
Таблица 6 |
|
Состав, кислотность буферных смесей |
||||
Название смеси |
Ее состав |
|
Значение |
|
|
|
|
рН |
|
HCOOH |
HCOOH |
|
3,5 |
|
HCOONa – формиатная |
|
|
||
|
|
|
|
|
– ацетатная |
|
|
4,7 |
|
|
|
|
|
|
|
|
|
|
|
Na2HPO4 |
Состоит |
из |
|
|
солей |
|
7 |
|
|
– фосфатная |
многоосновной |
|
||
|
|
|||
|
кислоты |
|
|
|
- аммонийная |
|
|
9,2 |
|
|
|
|
|
|
|
|
|
|
|
Буферная емкость – это предельное количество кислоты или щелочи определенной концентрации (молярной, нормальной), которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу.
Расчет рН рассмотрим на примере:
так как [CH3COONa] = [CH3COOˉ],
58
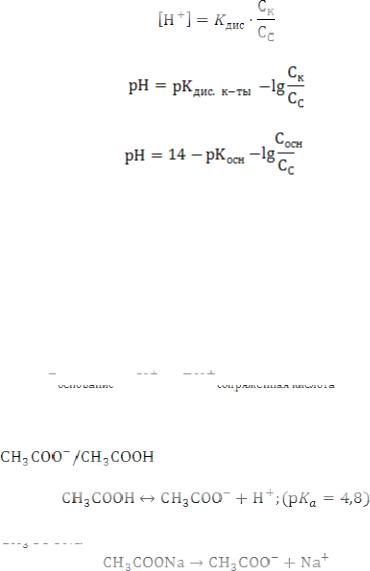
то 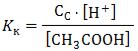
Для кислотного буфера:
Для основного буфера:
Механизм буферного действия
Согласно протонной теории, кислотой называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны отдавать протон, быть донором протонов. Основанием называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, быть акцептором протонов. Буферное действие растворов обусловлено наличием кислотноосновного равновесия общего типа:
1. 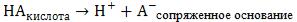
2. 














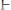













Механизм буферного действия можно понять на
примере |
ацетатной |
буферной |
системы |
|
, в основе |
действия |
которой лежит |
кислотно-основное равновесие:
Главный источник ацетат анионов – сильный электролит


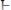












 :
:
59
1. При добавлении сильной кислоты сопряженное
основание |
связывает добавочные ионы |
, |
превращаясь в слабую уксусную кислоту:
(кислотно-основное равновесие смещается влево, по принципу Ле-Шателье). Уменьшение концентрации анионов 







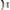


 точно уравновешивается повышение концентрации
точно уравновешивается повышение концентрации
молекул 

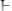










 . В результате происходит небольшое
. В результате происходит небольшое
изменение в соотношении концентраций слабой кислоты и ее соли, а, следовательно, незначительно изменяется рН.
2. При добавлении щелочи протоны уксусной кислоты (резервная кислотность) высвобождаются и нейтрализуются
добавочными гидроксид анионами 



 , связывая их в молекулы:
, связывая их в молекулы:
(кислотно-основное равновесие смещается вправо, по принципу Ле-Шателье).
В этом случае также происходит небольшое изменение в соотношении концентрации слабой кислоты и ее соли, а, следовательно, и незначительное изменение рН. Уменьшение
концентрации |
слабой |
кислоты |
точно |
|
уравновешивает |
повышение |
концентрации |
анионов |
|
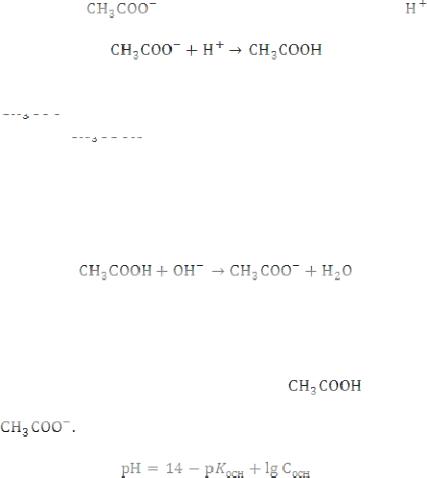
Расчет рН для основной буферной смеси:
60
