
Учебное пособие 2150
.pdf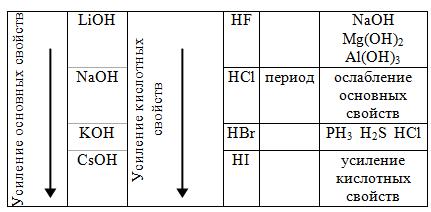
Таблица 3 Изменение кислотно-основных свойств гидроксидов
Величина энергии ионизации (I, эВ) тесно связана с его способностью к окислительно-восстановительным реакциям. В пределах группы энергия ионизации уменьшается, а в пределах периода увеличивается. Это ведет к возрастанию восстановительных свойств ионов по группе и окислительных свойств по периоду.
Большинство соединений s-катионов бесцветны, хорошо растворимы в воде и для них не характерны окислительные свойства, практически не обладают комплексообразующей способностью, а их гидроксиды обладают основными свойствами.
Анионы p-элементов, как правило, образуют малорастворимые, часто окрашенные соединения, являются хорошими комплексообразовательными и могут проявлять как восстановительные (Sn2+, Sb3+, Bi3+), так и окислительные свойства (Pb4+), многие их гидроксиды амфотерны.
Катионы d-элементов образуют хорошо и малорастворимые, окрашенные и неокрашенные соединения, являются хорошими комплексообразователями и участвуют в окислительно-восстановительных реакциях. Гидроксиды, в
41
зависимости от степени окисления атома, могут проявлять как основные, так и амфотерные свойства. Для проведения качественного химического анализа неорганических соединений, их чаще всего переводят в раствор, и задача анализа сводится к обнаружению образующихся при диссоциации ионов.
Аналитическая классификация катионов и анионов
Анализ смеси ионов может быть проведен дробным, систематическим или компромиссным методами.
Дробный анализ основан на обнаружении искомого иона в отдельных порциях исследуемого раствора с применением специфических или селективных реакций в любой последовательности (разработан Н.А. Тананаевым). Он требует удаления или маскировки мешающих ионов. Метод позволяет быстро обнаружить ограниченное число ионов (1- 5), содержащихся в смеси, состав которой приблизительно известен.
Систематический анализ основан на последовательном разделении ионов на группы с помощью групповых реагентов и последующем обнаружении отдельных ионов характерными реакциями.
Компромиссный метод сочетает в себе элементы дробного и систематического анализа. Групповые реагенты могут избирательно осаждать ионы определенных аналитических групп в виде труднорастворимых соединений, либо выделять из смеси труднорастворимых веществ группу растворимых соединений. На основании применения различных групповых реагентов разработаны различные аналитические классификации ионов.
Для катионов существуют две классификации: кислотно-основная и сероводородная. Сероводородная классификация катионов кратко представлена в табл. 4.
42
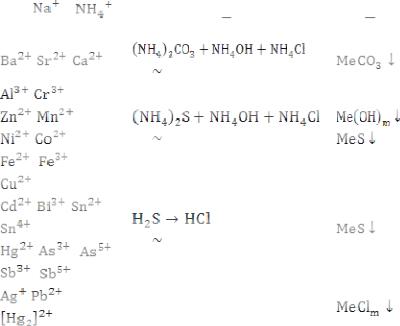
Таблица 4
Сероводородная классификация катионов
А |
|
|
|
|
|
на |
|
|
|
|
|
ли |
|
|
|
|
|
ти |
|
|
|
|
Аналитич |
че |
|
|
|
|
|
Катионы |
|
|
Групповой реагент |
еская |
|
ск |
|
|
|
|
форма |
ая |
|
|
|
|
|
|
|
|
|
|
|
гр |
|
|
|
|
|
уп |
|
|
|
|
|
па |
|
|
|
|
|
I |
K+, |
, |
, |
|
|
Mg2+ |
|
|
|
|
|
|
|
|
|
|
|
II |
, |
, |
|
pH 9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
, |
|
|
|
III |
, |
|
|
|
|
, |
, |
|
pH 9 |
|
|
|
|
|
|||
|
, |
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
I |
, |
, |
, |
|
|
|
|
|
|
|
|
V |
, |
, |
, |
pH 0.5 |
|
|
, |
|
|
|
|
|
|
|
|
|
|
V |
, |
, |
|
HCl |
|
|
|
|
|
||
|
|
|
|
|
|
Все анионы делятся на две группы:
43

1. Групповой |
реагент |
- |
: |
при |
этом |
образуются |
||
растворимые соли бария: Cl-, |
, |
, |
, |
, |
, |
|||
, |
, |
, |
, |
. |
|
|
|
|
2. Анионы образуют малорастворимые соли бария, которые растворимы в уксусной, соляной и азотной кислотах
(за исключением 




 ):
): 
 ,
,  ,
, 




 ,
, 




 ,
, 






 ,
, 





 ,
, 





 ,
, 



 .
.
Схема анализа по идентификации неизвестного вещества:
1. Окраска сухого вещества:
Черная для веществ: 


 ,
, 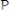


 ,
, 





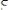
 ,
, 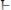




 ,
, 



 ,
, 




 ,
, 




 ,
, 





 и дугих; Оранжевая:
и дугих; Оранжевая: 






 2- и других;
2- и других;
Желтая: 




 ,
, 


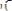
 ,
, 






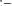 ; Красная: [
; Красная: [








 ]3-,
]3-, 




 ; Синяя:
; Синяя: 


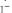

 .
.
2.Окраска пламени.
3.Проверка на наличие кристаллизационной воды.
4.Действие кислот на сухую соль (газ).
5.Подбор растворителя (при комнатной температуре,
при нагревании): 




 ,
, 











 ,
, 



 ,
, 






 .
.
6.Контроль рН раствора (только для растворимых в воде объектов).
7.Предварительные испытания (на катионы 


 ,
, 



 ,
,





 ).
).
8.Обнаружение группы катионов, анионов.
9.Обнаружение катиона.
44
Лекция № 4 Качественный анализ
Качественный анализ заключается в установлении факта наличия определяемого компонента (аналита) в исследуемом образце по аналитическому сигналу. Основной целью качественного анализа является установление молекулярного и элементарного состава данного вещества.
Задачи качественного анализа могут принципиально различаться:
– обнаружение всех химических элементов, входящих
всостав вещества (элементный анализ);
–идентификация молекул в образце (молекулярный
анализ);
–определение простых или сложных веществ в составе смеси (вещественный анализ);
–идентификация отдельных фаз гетерогенной
системы (фазовый анализ).
Аналитические реакции в качественном анализе могут выполняться «сухим» и «мокрым» способами.
«Сухой» способ – взаимодействие сухих реактивов с образцом без добавления воды. Например, это пробы на окрашивание пламени, получение цветных стекол, образование металлических корольков, растирание вещества с сухим реактивом. Сухие способы анализа используют чаще всего в полевых условиях для исследования минералов.
«Мокрый» способ – аналитическая реакция проводится в растворе. При исследовании в лабораторных условиях, как правило, образец сначала растворяют. В этом случае качественный анализ неорганических объектов сводится к обнаружению катионов и анионов, присутствующих в данном растворе.
Основные требования к аналитической реакции в качественном анализе:
45
1.Реакция должна сопровождаться заметным внешним эффектом: выпадением или растворением осадка, изменением окраски раствора, выделением газообразных веществ.
2.Реакция должна протекать достаточно быстро и полно.
3.Должны существовать условия, при которых
аналитическая реакция является достоверной. К таким условиям относятся:
–среда (то есть кислотность или реакция среды);
–температура;
–концентрация аналита и реактива;
–отсутствие мешающих веществ.
Чувствительность аналитической реакции – это возможность получения достоверного аналитического сигнала при низком содержании аналита. Чем меньшее количество компонента обнаруживается с помощью данной реакции, тем она чувствительнее.
Чувствительность чаще всего характеризуют двумя критериями:
–обнаруживаемый (открываемый) минимум –
наименьшая |
масса |
компонента, |
которую |
можно |
обнаружить |
с помощью данной реакции при соблюдении |
|||
всех необходимых условий (измеряется в микрограммах);
– предельное разбавление – максимальный объем раствора, в котором может быть однозначно обнаружен 1 г данного компонента при помощи данной реакции (измеряется
вмл/г или см3/г).
Вкачественном анализе предпочтительны реакции, для
которых обнаруживаемый минимум не превышает 50 мкг.
Селективность (избирательность) реакции
характеризуется числом различных компонентов, дающих сходный результат. Чем меньше это число, тем выше селективность.
Специфической называют высокоселективную реакцию, позволяющую обнаружить конкретный компонент в присутствии многих других.
46
В зависимости от задач качественного анализа его проводят дробным методом или систематическим. В частности, используя селективные и специфические реакции, можно обнаруживать интересующие ионы и вещества в отдельных порциях анализируемого раствора. При этом последовательность обнаружения не имеет значения.
Дробный анализ – это обнаружение определенных компонентов с помощью селективных и специфических реакций в отдельных порциях анализируемого раствора, проводимое в произвольной последовательности.
Дробный анализ обычно применяют, когда исследуют известный объект и требуется установить наличие или отсутствие в нем некоторых компонентов. Если состав анализируемого образца неизвестен или сложен, или для анализируемых компонентов используемые реакции недостаточно селективны, проводят так называемый систематический анализ.
Систематический анализ – это определенная последовательность выполнения аналитических реакций, при которой каждый компонент обнаруживают после того, как будут обнаружены и удалены мешающие компоненты. В систематическом анализе применяют не только реакции обнаружения отдельных компонентов, но и различные способы отделения их друг от друга (разделения). Сложную по составу систему предварительно разделяют с помощью групповых реагентов на группы и подгруппы, а затем в пределах этих подгрупп обнаруживают характерными реакциями индивидуальные ионы, такими реакциями, которые после достаточно полного разделения ионов являются специфическими. Этот метод анализа сравнительно длителен и трудоемок, но универсален. При анализе сложной смеси ионов используют выделение ионов небольшими группами с помощью, так называемых групповых реактивов. В частности, к таким реактивам относятся (NH4)2CO3, (NH4)2S, H2S, Na2S,
47
HCl. После выделения группы ионов становится возможным их обнаружение дробным анализом.
В зависимости от применяемых групповых реактивов используется различная классификация анализируемых ионов на так называемые аналитические группы. Например, традиционная классификация катионов на пять аналитических групп связана с классической сульфидной (сероводородной) схемой систематического анализа. Существуют также кислотно-основная классификация, фосфатная.
Дробным анализом называют обнаружение ионов (компонентов) с помощью специфических реакций в отдельных порциях анализируемого раствора без предварительного отделения мешающих компонентов. Для подавления мешающих сигналов соответствующие компоненты маскируют. Создание условий, в которых реакция с обнаруживаемым ионом становится специфической, – сложная задача, что является недостатком метода. Достоинством дробного анализа является то, что он даёт возможность быстро определить ограниченное число (от одного до пяти) ионов, содержащихся в смеси, состав которой приблизительно известен. Метод дробного анализа был разработан Н.А. Тананаевым. Примером дробного анализа может служить метод обнаружения Рb2+ - ионов из общей пробы. Предварительно Рb2+ ионы осаждают в виде РbSО4
действием разбавленной H2SO4:
Рb2+ + H2SO4 РbSO4↓ + 2Н+.
Вместе с сульфатом свинца в осадок выпадают сульфаты мешающих элементов. Ва2+, Sr2+, Са2+, [Нg2]2+. Сульфаты этих
элементов нерастворимы, а осадок РbSO4 растворяется в растворе ацетата аммония с образованием основного ацетата Рb(II):
2РbSО4 + 2СН3СООNН4 [Pb(СН3COО)2∙РbSО4] + (NH4) 2SO4.
Далее нерастворимые сульфаты выделяют из раствора фильтрованием. К получаемому раствору добавляют хромат
48
калия К2СrО4, и образующийся жёлтый осадок хромата
свинца является доказательством наличия в исследуемом растворе Рb2+ - катионов: Рb2+ + СrО42- РbСrО4 ↓.
В качественном анализе неорганических веществ преимущественно исследуют растворы солей, кислот и основанья, которые в водных растворах находятся в диссоциированном состоянии. Поэтому химический анализ водных растворов электролитов сводится к открытию ионов. Наиболее распространённой и общепринятой является классификация, основанная на принципах, предложенных В.А. Меншуткиным (1871). Согласно этой классификации, катионы подразделяются на пять аналитических групп по растворимости их карбонатов, сульфидов, хлоридов и гидроксидов (табл. 5).
При систематическом анализе последовательность выделения аналитических групп из раствора обратно их нумерации: первыми выделяют катионы четвертой и пятой групп, а катионы первой группы анализируют в последнюю очередь. Эта классификация основана на применении групповых реагентов: HCl, Н2S, (NH4) 2S и (NH4) 2CO3.
Сероводородная классификация катионов, основанная на различной растворимости, органически связана с электронным строением атомов и положением элементов в периодической системе Д.И. Менделеева. Близость химикоаналитических свойств s-, р-, d- и f- элементов позволяет проводить разделение смесей на эти соответствующие группы. Для разделения внутри аналитической группы используются уже не общие свойства, а индивидуальные, обусловленные не только строением электронных оболочек, но и значением энергий валентных электронов. Первая и вторая аналитические группы совпадают с I и II группами периодической системы, исключая Ве2+. Это s-элементы, имеющие соответственно на внешнем энергетическом уровне конфигурацию электронов ns1 и ns2. Например, IА подгруппа - Nа: 1s2 2s2 р6 [3s1] и IIА подгруппа - Са: 1s2 2s2 р6 3s2 р6 [4s2].
49
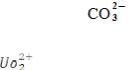
Таблица 5 Аналитические группы катионов (Кt). Сероводородный метод
Груп |
Под- |
Предс- |
|
Групповой реагент |
|
|
|
Раствори-мость |
|||||
па |
группа |
тавители |
|
|
|
|
|
|
|
|
|
солей |
|
|
1. |
NH4+, K+, Rb+, |
Kt+ + Na3[Co(NO2)6]→ |
|
|
Карбонаты |
и |
||||||
|
|
Cs+, Fr+ |
|
Kt2Na[Co(NO2)6] |
|
|
|
сульфиды |
|
||||
|
|
|
|
под действием гекса- |
|
|
растворимы |
в |
|||||
|
|
|
|
нитрокобальта (III) |
образуется |
H2O |
|
||||||
|
|
|
|
желтый |
|
|
кристаллический |
|
|
||||
|
|
|
|
осадок |
гексанитро-кобальтов |
|
|
||||||
|
|
|
|
(III): |
|
|
|
|
|
|
|
|
|
|
|
|
|
Kt+ + NaHC4H4O6→ |
|
|
|
|
|
||||
I |
|
|
|
KtHC4H4O6 |
|
|
|
|
Карбонат |
|
|||
|
|
|
|
под |
действием гидротартрата |
магния MeCO3 |
|||||||
|
|
|
|
натрия |
|
образуется |
белый |
растворяется |
|||||
|
|
Li+, Na+, |
|
кристаллический осадок |
|
только |
в |
||||||
|
2. |
|
Нет |
|
|
|
|
|
|
|
присутствии |
||
|
|
Mg2+ |
|
|
|
|
|
|
|
|
|
солей аммония. |
|
|
|
Ca2+, Sr2+, |
|
Осаждают в нейтральной или |
Сульфиды |
KtS |
|||||||
|
|
Ba2+, Ra2+ |
|
щелочной |
среде |
карбонатом |
растворимы |
в |
|||||
|
|
|
|
аммония |
|
(NH4)2CO3 |
в |
H2O |
|
||||
|
|
|
|
присутствии |
NH4OH |
|
или |
|
|
||||
II |
|
|
|
NH4Cl в виде нерастворимых в |
|
|
|||||||
|
|
|
|
H2O карбонатов KtCO3 |
|
|
|
|
|||||
|
|
|
|
Kt2++ |
|
|
|
KtCO3↓ |
|
|
|
||
|
1. |
Be2+, Al3+, |
|
Осаждают |
в |
нейтральной и |
Сульфиды |
|
|||||
|
|
Cr3+, Ti4+, |
|
щелочной средах рН = 7-9 |
растворимы |
в |
|||||||
|
|
Th4+, |
|
сульфидом аммония (NH4)2S в |
H2O |
с |
|||||||
|
|
|
виде |
нерастворимых |
в |
воде |
получением |
|
|||||
III |
|
Y3+, Ce3+ |
|
гидроксидов |
Kt(OH)n |
. |
нерастворимых |
||||||
2. |
Mn2+, Fe2+, |
|
Осаждают (NH4)2S при |
|
|
гидроксидов |
|||||||
|
|
рН = 7-9 в виде KtnSm |
|
|
|
|
|||||||
|
|
Fe3+, Co2+, |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni2+, Ga3+, |
|
|
|
|
|
|
|
|
|
|
|
|
|
In3+, Tl3+ |
|
|
|
|
|
|
|
|
|
|
|
IV |
1. |
Hg2+, Cu2+, Bi2+, |
Осаждают |
в |
виде |
сульфидов |
|
|
|||||
|
|
Cd2+, Pd2+ |
|
действием H2S в присутствии |
Сульфиды |
|
|||||||
|
|
|
|
0,3H HCl. Сульфиды KtnSm |
нерастворимы |
||||||||
|
|
|
|
нерастворимы в полисульфиде |
в разбавленных |
||||||||
|
|
|
|
аммония и щелочах. Осаждают |
кислотах |
|
|||||||
|
|
Sn2+, Sn4+, As3+, |
H2S (в растворе 0,3H HCl). |
|
|
||||||||
|
|
Сульфиды KtnSm растворимы в |
|
|
|||||||||
|
2. |
As5+, Sb3+, Sb5+, |
полисульфиде |
|
аммония |
|
|
||||||
|
|
Au3+, |
Ge4+, |
(NH4)2S2 |
|
|
|
|
|
|
|
||
|
|
Re4+, Ir4+, Pt4+, |
|
|
|
|
|
|
|
|
|
|
|
|
|
V5+,W6+,Mo6+ |
|
|
|
|
|
|
|
|
|
|
|
V |
|
Ag+, |
Pb2+, |
Осаждают |
|
в |
|
|
виде |
Сульфиды |
|
||
|
|
[Hg2]2+, |
Cu+, |
нерастворимых |
хлоридов |
нерастворимы |
|||||||
|
|
Au+, Ti+, Pt2+ |
KtnClm |
действием HCl |
|
|
в разбавленных |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
кислотах |
|
50
