
Учебное пособие 2150
.pdf













 ,
,
где А – определяемый компонент; mA – масса полученного из навески осадка (г); G – масса навески анализируемого вещества (г).
Для вычислений в гравиметрии часто используют факторы пересчёта (аналитические факторы). Фактор пересчёта – это отношение относительной атомной (Аr) или молекулярной (Mr) массы определяемого вещества к относительной молекулярной массе взвешиваемого вещества, находящегося в осадке:


























 ,
,
где a и b – небольшие целые числа, на которые нужно умножить молекулярные массы, чтобы число моль в числителе и знаменателе были химически эквивалентны.
Фактор пересчета показывает, сколько граммов определяемого вещества содержит один грамм осадка (табл. 9). Например, при определении бария путем взвешивания в виде сульфата фактор пересчёта равен:




















 .
.
С учетом фактора пересчета для содержания элемента в сложном веществе используют формулу:














 ,
,
где m – масса осадка (г); Ф - фактор пересчёта; G – навеска анализируемого вещества (г).
Пример. Определить содержание в образце химически чистого хлорида бария ВаСl2•2Н2О навеска чистого ВаС12• 2Н2О равна 0,4872 г. Масса осадка сульфата бария после прокаливания 0,4644 г.
Решение.
Вычисляют массу бария (относительная атомная масса 137,40), содержащуюся в полученном осадке сульфата бария:
в 233,40 г ВаSО4 содержится 137,40 г Ва,
71

в 0,4644 г ВаSО4 содержится X г Ва;
X = 0,4644•137,40 / 233,40 = 0,2733 г.
Эта же масса бария входила до реакции в состав навески ВаСl2•2Н2О, поэтому можно составить пропорцию:
0,4872 г ВаСl2•2Н2О составляют 100 %, 0,2733 г Ва составляют X %; X = 0,2733•100 /0,4872 = 56, 09 %.
Следовательно, ВаСl2•2Н2О содержит массовую долю бария
56,09 %.
Пример: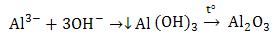
Основные операции: расчет навески, взвешивание образца, растворение пробы, осаждение, созревание осадка, фильтрование и промывание осадка, высушивание, прокаливание, взвешивание гравиметрической формы, расчеты.
Таблица 9 Примеры осаждаемой и гравиметрической форм некоторых
веществ
Осаждаемая форма |
Гравиметрическая форма |
|
|
Гравиметрический метод считают самым надежным и используют для оценки надежности других методов.
Объемные (титриметрические) методы анализа. Основные
понятия
Титриметрический анализ основан на точном измерении объема реактива известной концентрации, затраченного на реакцию с определяемым компонентом. Раствор реагента с точно известной концентрацией, применяемый для титрования, называют титрантом или титрованным
72
раствором. Титр – это масса вещества, содержащегося в одном кубическом сантиметре (или и одном миллилитре) раствора. Например, если титр раствора НСl равен 0,002302, то каждый миллилитр его содержит 0,002302 г HCl. Единица измерения титра г/см3 или г/мл:
Т = m/V,
где m – масса навески, г; V – объем раствора, мл или см3. Если навеску Nа2СО3 в 0,5312 г растворить в мерной
колбе емкостью 100 мл, то титр равен: Т = 0,5312/100 г/мл. Титрование – это процесс постепенного приливания
титранта к исследуемому раствору до окончания реакции. После добавления каждой порции в титруемом растворе протекает химическая реакция между определяемым веществом и введенным в раствор реагентом. Эту реакцию называют реакцией титрования; уравнение ее в общем виде можно записать следующим образом:
аTТ + аRR+...→ а1S1 + а2S2+...,
где T – определяемое (титруемое) вещество, R – реагент; S1 и S2 – продукты реакций; буквой, а с соответствующими индексами обозначены коэффициенты. После добавления очередной порции раствора устанавливается равновесие:
аTТ + аRR+...→ а1S1 + а2S2 +...
При этом равновесная концентрация определяемого вещества с каждой новой порцией титранта уменьшается, а равновесные концентрации реагента и продуктов реакции увеличиваются. Титрование продолжают до тех пор, пока не
достигнуты стехиометрические отношения между количествами определяемого вещества и реагента:
V1/V2 = N1/N2 или V1 •N2= V2 •N1,
где V1 – объем определяемого вещества; N1 – нормальная концентрация анализируемого раствора; V2 – объем
титранта; N2 – нормальная концентрация титранта.
При титровании прибавляют не избыток титранта, а количество, эквивалентное количеству определяемого вещества, точно соответствующее уравнению реакции. Это
73
положение лежит в основе титриметрического определения. Для того чтобы определить концентрацию одного из растворов, надо знать точно объемы реагирующих растворов, точную концентрацию другого раствора и момент, когда два вещества прореагируют в эквивалентных количествах.
Под нормальной концентрацией понимают число эквивалентных масс растворенного вещества, содержащихся в 1 л раствора.
Химический эквивалент – это количество элемента, соединяющееся с 1 моль атомов водорода или замещающее их в реакциях. Эквивалентная масса вещества – это количество его, равноценное (эквивалентное) 1 моль атомов водорода в данной реакции, размерность г/моль. Чтобы перейти к нормальной концентрации (N), достаточно титр раствора умножить на 1000 и разделить на эквивалентную массу растворённого вещества mэ:
N = (T •1000)/ mэ
Например, нормальность раствора Nа2СО3 навеской в
0,5312 г равна:
N = (0,005312•1000)/53 = 0,1092, mэ(Nа2СО3)= М(Nа2СО3)/(n•к)= (2•23+12+3•16)/1•2 =53 г/моль,
где М – молекулярная масса; n – валентность металла,образующего соль; к – число атомов этого металла.
Эквивалентную массу вещества всегда находят исходя из типа реакции, лежащей в основе анализа. Момент титрования, когда титрант добавлен в количестве, эквивалентном содержанию определяемого компонента, соответствует окончанию реакции, называется точкой эквивалентности. Достигнув точки эквивалентности, титрование прекращают, по объему титранта и его концентрации вычисляют результаты анализа.
При титриметрических (объемных) методах количество исследуемого вещества определяют по объему (массе) раствора реактива, израсходованного в реакции с данным соединением, измерение массы (взвешивание) заменяют
74

измерением объема. При этом к раствору исследуемого вещества или части раствора (аликвоте) постепенно прибавляют раствор точно известной концентрации до тех пор, пока вещества не прореагируют полностью. Этот процесс называют титрованием. Момент полного связывания исследуемого соединения – точку эквивалентности (ТЭ) – находят, например, по изменению окраски раствора, или по каким-либо другим признакам.
Титрант – раствор, которым титруют и который имеет определенную концентрацию, – называется стандартным (титрованным). Концентрацию его обычно выражают в
единицах эквивалентности (Н) или Т, г/см3, а также ТА/В, г/см3.
Аликвотная доля (аликвота) – это точно известная часть анализируемого раствора, взятая для анализа (
 , см3),
, см3),
которую отбирают пипеткой.
Конечная точка титрования (КТТ) – момент или точка титрования, в которой некоторое свойство раствора (например, окраска) претерпевает заметное изменение. КТТ более или менее соответствует ТЭ, но чаще всего не совпадает с ней.
Стандартизация – процесс нахождения концентрации титранта (чаще всего при титровании им первичного стандарта).
Основными преимуществами методов титриметрии перед гравиметрическим методом являются экспрессность, простота, доступность и возможность автоматизации. Однако по точности титриметрические методы уступают гравиметрическому методу анализа.
Раствор с приготовленным титром (стандартные растворы) – растворы, которые не изменяют свою концентрацию с течением времени (янтарная, щавелевая кислоты).
75
Способы приготовления таких растворов:
–из фиксанала;
–по методу точной навески (с использованием
аналитических весов);
– методом разбавления более концентрированных растворов.
Раствор с установленным титром (рабочие растворы)
– растворы, которые изменяют свою концентрацию с те-
чением времени (соляная, серная кислоты, гидроксид натрия, калия).
Способы приготовления таких растворов:
–из фиксанала;
–по методу неточной навески (с использованием
технических весов);
– методом разбавления более концентрированных растворов.
Требования, предъявляемые к реакциям в титриметрическом анализе:
1.Реакция должна протекать по строго стехиометрическому уравнению. Побочные реакции должны быть исключены.
2.Реакция должна протекать количественно, практически до конца (99,9 %), необратимо.
3.Реакция должна протекать быстро. Иногда для ее ускорения растворы нагревают.
4.Реакция должна позволять точно и удобно определять (КТТ) вблизи точки эквивалентности (ТЭ).
Пробоотбор и пробоподготовка
Перед исследованием вещество предварительно подготавливают к анализу. Отбор средней пробы является одной из важнейших подготовительных операций. Его цель - получить относительно небольшое количество исходного вещества, в котором количественное содержание всех компонентов должно быть равно количественному содержанию их во всей массе анализируемого вещества. Если
76
средняя проба анализируемого вещества не соответствует составу всей партии, то теряет смысл даже самый тщательный анализ этого вещества.
Методы отбора пробы различных материалов сильно отличаются друг от друга. При отборе проб руководствуются правилами, подробно описанными в ГОСТах, посвященных анализу этих материалов. Отбор проб может осуществляться систематически через определенные промежутки времени по заранее заданной программе, по распоряжению вышестоящих организаций, а также инициативно в случае возникновения непредвиденных опасных ситуаций и проявления внешних признаков загрязнения окружающей среды (ОС). При систематическом проведении отбора проб различных объектов ОС рекомендуется соблюдать следующую периодичность. Отбор проб атмосферного воздуха ежедневно с интервалом в 6 ч, обычно в 2, 8, 14 и 20 часов. Периодичность отбора проб питьевой воды дифференцируется по численности населения, пользующегося данным источником водоснабжения. В небольших населенных пунктах (до 10 тыс. человек) достаточно проводить двухразовый отбор проб воды в месяц, а в крупных городах анализ проб воды должен осуществляться ежедневно.
Отбор проб почвы и снега осуществляют не реже одного раза в два месяца. Частота наблюдений за состоянием ОС может быть изменена в зависимости от ситуации, складывающейся в контролируемом районе. При отборе проб почвы выделяется пробная площадка, размеры которой зависят от типа и однородности почвенного покрова, а также рельефа местности. При однородном составе почвы одну объединенную пробу отирают с площади 3-5 га, что является особенно характерным для лесостепных и степных районов. В лесной зоне, а также в других районах с волнистым рельефом местности и неоднородным почвенным покровом, одна объединенная проба отбирается с площади 1-3 га. В горных районах, где велика комплексность почвы, объединенная
77
проба отбирается с площади 0,5-1 га. Для составления объединенной пробы почву отбирают с помощью совка или лопаты по диагонали 30 выемок площадью 10

 10 см и
10 см и
глубиной на 5 см. Все это перемешивают и методом квартования отбирают среднюю пробу (1 кг).
Отбор проб атмосферного воздуха. В основу метода отбора проб воздуха положен комбинированный аспирационный способ одновременного пробоотбора аэрозолей и паров этих соединений с помощью коллекторного устройства, состоящего из фильтра и поглотительного патрона, заполненного соответствующим адсорбентом. Установка для отбора проб состоит из воздуходувки (насоса, пылесоса «Вихрь»), измерителя расхода воздуха (ротаметра), фильтродержателя с фильтром и кассеты для твердых сорбентов. Отбор пробы воздуха осуществляется в течение 30 мин при скорости пробоотбора 125 дм3/мин.
Отбор проб воды. Приборы и установка для отбора проб воды подразделяются на автоматические, полуавтоматические и ручные. В настоящее время используют в основном ручные пробоотборники и батометры, различных конструкций, позволяющие отобрать пробы с различной глубины. Из поверхностного источника централизованного водоснабжения (реки, озера, водохранилища) отбор проб осуществляют на расстоянии 1 км выше по течению от места водозабора, а на непроточных водоемах и водохранилищах на расстоянии 1 км в обе стороны от водозабора. Отбор проб проводят не менее чем с двух горизонтов: у поверхности и у дна (0,5 м от дна). Из кранов – после 10 мин открытого крана. Общий объем пробы
не менее 1 дм3. Из каждого исследуемого источника водоснабжения должно быть отобрано для анализа не менее 2- 3 проб. При необходимости проводят консервацию проб.
Отбор проб продуктов питания. По физическим свойствам продукты питания делятся на две основные группы: жидкие и твердые. Последние по глубине проникновения ТХВ могут быть подразделены на плотные
78
(хлеб, мясо, рыба и тому подобное), сыпучие (зерно, соль, сахар и прочие) и пористые (макароны, сухари). Объем
жидкой пробы не менее 1 дм3; масса твердой пробы – 2 кг, в том числе овощи и фрукты.
Для надежного определения ТХВ отобранные пробы
должны быть проанализированы в течение суток!
При подготовке пищевых продуктов для анализа отбирают только съедобные части. Пробы жидких продуктов перемешивают в бутылях путем их переворачивания не менее
10-20 раз.
Извлечение вещества, например, жиров, осуществляют соответствующим органическим растворителем (экстракция), выбор которого чаще всего проводится эмпирическим путем. Для этой цели либо определяют коэффициент распределения исследуемого вещества в ряде растворителей, либо используют справочные данные. Для выделения вещества из органического растворителя после экстракции проводят:
1.Перевод вещества повторной экстракцией в другой растворитель.
2.Упаривание растворителя.
3.Адсорбцию на подходящем адсорбенте.
Различают следующие способы титрования:
1.Прямое титрование, когда при титровании происходит реакция между титруемым веществом и рабочим раствором.
2.Обратное, когда к определяемому раствору добавляют
заведомый избыток (точно отмеренное количество) раствора известной концентрации и избыток этого реактива оттитровывают рабочим раствором.
3. Титрование заместителя, когда рабочим раствором титрируют продукт реакции определяемого вещества с какимлибо реактивом.
Химическую реакцию можно использовать в прямом
титровании, если она удовлетворяет требованиям:
1. Взаимодействие титруемого вещества с реагентом в условиях проведения анализа должно быть специфичным, с
79
применяемым реагентом не должны взаимодействовать находящиеся в растворе посторонние вещества.
2.Реакция должна протекать стехиометрически по уравнению.
3.Реакция должна протекать быстро, состояние
равновесия после добавления очередной порции титранта должно достигаться мгновенно.
4. Необходимы индикаторы или химико-физические методы, позволяющие найти скачок кривой титрования.
5. Константа равновесия должна быть высокой, чтобы погрешности, возникающие от неполного протекания реакции, не превысили допустимые величины: если lgKравн. ≥ 6 или Kравн. ≥106 , то погрешность определения не превышает ±0,1 %.
В ходе титрования меняются равновесные концентрации определяемого вещества, реагентов и продуктов реакции. Графические изображения изменений этих концентраций называют кривыми титрования.
При этом на оси ординат откладывают либо равновесную концентрацию одного из веществ, участвующих в реакции титрования, либо логарифм этой концентрации. На оси абсцисс можно откладывать объем добавленного титранта (раствора реагента) VR или отношение этого объема к объему титранта, содержащему стехиометрическое количество
реагента 

 :
:
τ =VR/ VR, sten = nR/nR,sten= nT/nT,sten,
где nR – добавленное количество реагента; nT – прореагировавшее количество титруемого вещества; nR,Stenколичество реагента, необходимое для достижения точки стехиометричности; nT,Sten – количество определяемого вещества, содержащееся в титруемом растворе.
Отношение τ называют степенью оттитрованности. До точки стехиометричности τ < 1 (<100 %), в точке стехиометричности τ =1 (= 100 %) и после точки стехиометричности τ >1 (>100 %).
80
