
- •Федеральное агентство по образованию
- •Санитария и гигиена отрасли
- •Санитария и гигиена отрасли
- •Правила работы с культурами микроорганизмов Правила и техника безопасности при работе в микробиологической лаборатории
- •Правила работы с культурами микроорганизмов
- •Лабораторная работа № 1 питательные среды и методы их стерилизации. Условия культивирования микроорганизмов
- •Классификация питательных сред
- •Методы стерилизации питательных сред
- •Стерилизация стеклянной посуды и инструментов
- •Условия культивирования микроорганизмов
- •Культивирование аэробных микроорганизмов
- •Культивирование анаэробных микроорганизмов
- •Лабораторная работа № 2 Методы определения количества клеток микроорганизмов
- •Метод подсчета клеток дрожжей в камере Горяева
- •Метод высева на агаризованные питательные среды (метод Коха)
- •Нефелометрическое определение количества клеток микроорганизмов или их биомассы
- •Лабораторная работа № 3 санитарно-бактериологическое исследование воздуха закрытых помещений
- •Санитарно-бактериологическое исследование воздуха
- •Критерий для оценки воздуха жилых помещений (число микроорганизмов в 1 м3 воздуха, по а.И. Шарифу)
- •Оценка эффективности ультрафиолетового бактерицидного излучения
- •Лабораторная работа № 4 Санитарно-бактериологическое иСследование воды
- •Определение общего микробного числа воды
- •Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод)
- •Определение общих и термотолерантных колиформных бактерий титрационным методом
- •Микробиологические и паразитологические показатели безопасности питьевой воды
- •Лабораторная работа № 5 Санитарно-бактериологическое исследование смывов с рук, инструментов и предметов производства
- •Лабораторная работа № 6 Микрофлора ячменя и солода. Изучение степени микробной обсемененности образца
- •Представители эпифитной микрофлоры ячменя
- •Грибы хранения
- •Лабораторная работа № 7 Микробиологический контроль товарных хлебопекарных дрожжей и производства
- •Определение посторонних микроорганизмов в бродящей жидкости дрожжерастительных аппаратов, дрожжевом молоке и прессованных дрожжах
- •Питательные среды для выявления основных групп микроорганизмов
- •Нормы содержания посторонних микроорганизмов в 1 г различных образцов дрожжей
- •Микробиологический контроль мелассы и мелассного сусла
- •Лабораторная работа № 8 Оценка эффективности и смываемости моющих и дезинфицирующих средств
- •Оценка смываемости дезинфицирующих средств
- •Приготовление рабочего раствора средства «ф 262 Ипасепт»
- •Установление эффективности (действующих концентраций) дезинфицирующих веществ
- •Список литературы
- •Содержание
- •Иванченко Ольга Борисовна санитария и гигиена отрасли
Представители эпифитной микрофлоры ячменя

Рис. 6. Мицелий гриба р. Alternaria и конидии под микроскопом

Рис. 7. Мицелий гриба. р.Cladosporium. На концах воздушного мицелия расположены овальные споры в виде гроздей
Грибы хранения

Рис. 8. Грибы р. Rhizopus
.
Рис. 9. Грибы p. Aspergillus
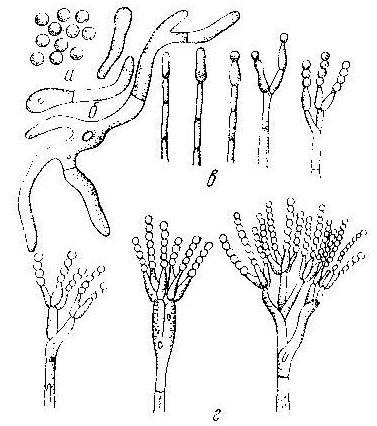
Рис. 10. Представители p. Penicillium

Рис. 11. Представители р. Mucor
Количественный учет микроорганизмов, присутствующих на зерне, осуществляют путем высева проб на чашки Петри с картофельно-глюкозным агаром (КГА). Для анализа поверхностной микрофлоры ячменя навеску зерна, предварительно очищенного от сорных примесей, массой 5 г помещают в колбу с 50 мл стерильной водопроводной воды. Колбу взбалтывают круговыми движениями в течение 10 мин. Из полученного смыва готовят необходимые разведения. Из каждого разведения отбирают по 1 мл суспензии и делают глубинный посев на КГА, который предварительно охладили до 40 С.
Количество микроорганизмов в исходном разведении определяют по формуле
Х
=
![]() ,
,
где A – число колоний в чашке Петри, шт.; N – разведение суспензии;
V – объем суспензии, пошедшей на посев, мл.
Для выявления внутренней микрофлоры поверхность зерна предварительно дезинфицируют путем погружения семян в 96 %-й этиловый спирт на 30 с, затем промывают стерильной водопроводной водой и раскладывают стерильным пинцетом на поверхность 2 %-го КГА в чашки Петри.
Чашки инкубируют при комнатной температуре. Предварительный подсчет колоний микроорганизмов проводят через трое суток инкубации, окончательный – через семь. Подсчитывают число аэробных, анаэробных и факультативно-анаэробных форм бактерий, микроскопических плесневых грибов. Полученные результаты пересчитывают на 1 г зерновой массы.
Используемые питательные среды и растворы:
1. Картофельно-глюкозный агар (КГА): 200 г вымытого и очищенного картофеля нарезают ломтиками, заливают 1 л воды и кипятят 40 мин. После этого раствор фильтруют, фильтрат доводят до 1 л водой, вносят 20 г агар-агара и 20 г глюкозы. Разливают по колбам и стерилизуют 20 мин при давлении 0,5 атм.
2. 2 %-е сусло-агар: 100 мл неохмеленного сусла с 5 % СВ, 2 г агара стерилизуют автоклавированием 20 мин при давлении 0,5 атм.
3. Стерильная водопроводная вода.
4. 70 %-й раствор спирта или 5 %-й раствор гипохлорита нат-рия.
Задание
1. Провести анализ поверхностной и внутренней микрофлоры различных сортов ячменя.
2. Оценить качество зерна с микробиологической точки зрения.
Контрольные вопросы
1. Микрофлора растений.
2. Какая микрофлора является эпифитной и фитопатогенной?
3. Какие микроорганизмы относятся к грибам хранения и почему их так называют?
4. Как грибы хранения влияют на качество ячменя и готового продукта?
5. Методы микробиологического контроля ячменя и солода.
6. Требования, предъявляемые к сырью по показателям микробиологической обсемененности.
Лабораторная работа № 7 Микробиологический контроль товарных хлебопекарных дрожжей и производства
К основным задачам микробиологического контроля производства хлебопекарных дрожжей относятся:
– систематическая проверка состояния культуры дрожжей на всех этапах их производства;
– определение численности и состава посторонних микроорганизмов в сырье, вспомогательных материалах, на промежуточных этапах производства, а также в дрожжах (чистой культуры (ЧК), естественно чистой культуры (ЕЧК) и товарных дрожжах (Т));
– выявление источников микробной инфекции на производстве;
– санитарный контроль состояния воздуха, емкостей, оборудования, качества мойки и дезинфекции.
Наиболее трудоемкой и важной задачей является выявление инфицирующей микрофлоры в сырье и готовом продукте.
В 1 г прессованных дрожжей содержится 10 млрд клеток. Даже при высокой инфицированности их посторонней, вредной микрофлорой, равной 50 млн клеток на 1 г, одна бактериальная клетка приходится на 2000 дрожжей, т. е. обнаружить ее прямым микроскопированием трудно. Поэтому для определения посторонней микрофлоры при контроле производства хлебопекарных дрожжей делают посевы на элективные и дифференциально-диагностические питательные среды, которые создают условия преимущественного развития нужных видов микроорганизмов, либо дают возможность выявить искомые бактерии за счет образования ими характерных колоний или специфических изменений среды.
Наиболее существенную роль играют микроорганизмы, которые условно делят на следующие физиологические группы:
– молочнокислые бактерии (лейконосток и лактобациллы);
– гнилостные бактерии (споровые и неспоровые палочки);
– нитритобразующие микроорганизмы;
– посторонние дрожжи (рис. 12).
Для определения количества посторонних, «диких» дрожжей используют синтетическую питательную среду с лизином, на которой не развиваются культурные дрожжи.
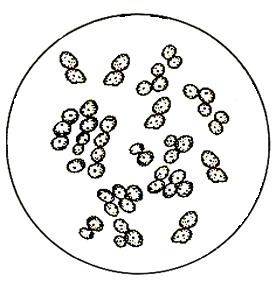
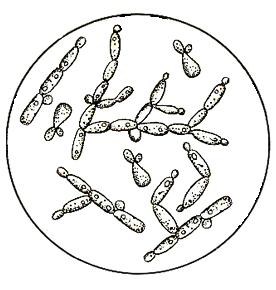
р. Torulopsis р. Candida
Рис. 12. Загрязнители дрожжевого производства
С целью выявления бактериальной микрофлоры используются питательные среды, содержащие антибиотик нистатин, специфически подавляющий развитие дрожжей.
Для обнаружения всех молочнокислых бактерий используют их способность образовывать зоны просветления вокруг колоний на среде с мелом. Для обнаружения основного вредителя дрожжевого производства – лейконостока – используют среду, содержащую сахарозу, на которой эта бактерия образует характерные каплевидные прозрачные колонии за счет полимеризации сахарозы в веществе капсулы.
Гнилостные бактерии можно определить на молочном агаре благодаря зонам протеолиза белков молока.
Количество нитритобразующих бактерий анализируют методом определения титра. Для этого делают десятикратные разведения исследуемой пробы и вносят их в синтетическую среду с нитратом. Пробы инкубируют 24 ч при 30 С и определяют наличие нитритов с помощью горячего реактива Грисса. Присутствие нитритов только в первом и втором разведениях свидетельствует об относительно небольшой обсемененности материала бактериями.
