
- •Предисловие
- •Глава 1. Показатели качества и виды форм лекарственных средств, правила отбора проб
- •1.1 Показатели качества фармацевтической субстанции
- •1.2 Показатели качества твердых лекарственных форм
- •1.3 Показатели качества мягких лекарственных форм
- •1.4 Показатели качества жидких лекарственных форм
- •1.5 Показатели качества газообразных лекарственных форм
- •1.6 Общие правила отбора проб для анализа лекарственных средств и фармацевтических субстанций
- •1.7 Отбор проб из нерасфасованной продукции
- •1.8 Отбор проб готовых лекарственных средств
- •1.9 Отбор проб лекарственного растительного сырья «ангро»
- •Рекомендуемый объем выборки в зависимости от количества единиц продукции в партии лрс «ангро»
- •Рекомендуемая масса пробы для анализа различного вида лрс «ангро»
- •Рекомендуемая масса пробы для анализа радионуклидов в лрс «ангро»
- •1.10 Отбор проб фасованного лекарственного растительного сырья
- •Рекомендуемый объем выборки для анализа фасованного лрс в зависимости от объема серии
- •Рекомендуемый объем выборки пробы для анализа радионуклидов в фасованном лрс в зависимости от объема серии
- •Допустимые отклонения массы содержимого упаковки лрс
- •Лабораторная работа №1 определение прочности таблеток без оболочки на истирание
- •Лабораторная работа №2 определение прочности таблеток на сжатие
- •1 − Испытуемая таблетка; 2 – вставка; 3 – конусовидный поршень.
- •Нормированные значения допустимого отклонения от средней массы для единицы дозированного лекарственного средства
- •Лабораторная работа № 5 определение распадаемости таблеток и капсул
- •Лабораторная работа № 6 определение степени растворения таблеток ацетилсалициловой кислоты
- •Критерии приемлемости результатов испытаний «Растворение» твердой лекарственной формы со стандартным высвобождением
- •Лабораторная работа № 7 определение времени деформации липофильных суппозиториев
- •Лабораторная работа № 8 определение содержания этилового спирта в настойке
- •Соотношение между плотностью и содержанием этанола в водно-спиртовых растворах
- •Лабораторная работа № 10 Определение водородного показателя (рН) изотоноического раствора глюкозы для инфузий
- •2 1 Режим Вкл. Выкл. РН Ручн. Темп Буфер 12 11 10 9 8 7 6 5 4 3
- •Лабораторная работа №11 определение потери массы активированного угля при высушивании
- •Лабораторная работа №13 определение показателя преломления раствора глицерина
- •Лабораторная работа № 14 определение коэффициента набухания семян Linum usitatissimum l.
- •Лабораторная работа № 15 определение подлинности корневища сабельника болотного методом тонкослойной хроматографии
- •Глава 2. Валидация методов испытаний
- •Валидационные характеристики для различных типов ми
- •2.1 Порядок проведения и оформление документов по валидации методик испытания
- •2.2 Особенности валидации методов, используемых в фармакопейном анализе [3]
- •2.2.1 Абсорбционная спектрофотометрия в ультрафиолетовой и видимой областях спектра.
- •2.2.2 Методы испытания на чистоту и допустимые пределы содержания примесей.
- •2.2.3 Атомно-абсорбционная спектроскопия.
- •2.2.4 Хроматографические методы.
- •2.3 Определение валидационных характеристик и критериев приемлемости
- •Примеры валидационных критериев для разных допусков
- •Требования к неопределенности измерений
- •1. Общие сведения.
- •2. Порядок проведения испытаний.
- •Критерии валидации
- •Расход раствора хлористоводородной кислоты, пошедшего на титрование раствора плацебо и лс
- •Результаты определения натрия уксуснокислого в модельных растворах
- •Результаты и статистические характеристики определения правильности
- •Результаты и статистические характеристики определения повторяемости
- •Результаты и статистические характеристики определения промежуточной прецизионности
- •Приложение Значения функции стандартного нормального распределения
- •Значения квантилей распределения Стьюдента при числе результатов измерений n
- •Список использованной литературы
- •Оглавление
- •Глава 1. Показатели качества и виды форм лекарственных средств, правила отбора проб 5
- •Глава 2. Валидация методов испытаний 102
- •Организация и технология испытаний. Лабораторный практикум
Лабораторная работа №2 определение прочности таблеток на сжатие
Цель работы: освоить методы определения прочности таблеток на сжатие; определить прочность таблеток на сжатие.
Средства испытаний: прибор для определения прочности таблеток на сжатие типа 1, 2.
Общие сведения.
Объектом исследования являются таблетки без оболочки.
Определение механической прочности таблеток включает помимо проведения испытаний на истирание также установление их прочности на сжатие (раскол). Объективную оценку механических свойств таблеток можно получить, проводя определение их прочности по обоим параметрам. Это объясняется тем, что ряд таблетированных препаратов, удовлетворяя требованиям на сжатие, имеют легко истираемые края и по этой причине оказываются недоброкачественными.
Испытание позволяет определить прочность таблеток на сжатие при определенных условиях путем измерения силы, необходимой для разрушения таблеток.
Механическую прочность таблеток на сжатие можно определять также на автоматизированных приборах (типа 1): ХНИХФИ, ТВТ фирмы «Еrweka» (Германия), ПИТ-20 (Мариупольского завода технологического оборудования, Украина) и др. Все они работают по принципу пружинного динамометра. Необходимо отметить, что методы с применением вышеперечисленных автоматизированных приборов не являются фармакопейными.
Прибор ХНИХФИ (рис. 1.4) состоит из цилиндрического корпуса, в котором расположен плунжер, винтовая пружина, нажимной винт и гайка. К гайке прикреплена линейка со шкалой, градуированной в килограммах. На линейке помещается ползунок, служащий для фиксации показаний, на который воздействует стрелка, связанная с плунжером. В стенке корпуса сделан прорез, в который входят гайки и плунжера, препятствующие их проворачиванию.

Рис. 1.4. Прибор ХНИХФИ для определения прочности таблеток на сжатие
Проведение испытаний.
Испытуемая таблетка сжимается между плунжером и неподвижным упором на корпусе. Винт вращается при помощи маховика. Шкала градуирована на 15 кг. Таблетку, поставленную на ребро, сжимают до разрушения. Ползунок на линейке динамометра фиксирует нагрузку, вызвавшую разрушение таблетки. Необходимо определить прочность не менее 3-х таблеток и вычислить среднее арифметическое этих измерений.
Обработка результатов.
Показатель прочности таблеток рассчитывается по формуле 1.5
 ,
(1.5)
,
(1.5)
где К – показатель прочности, МПа; Р – разрушающая нагрузка, H; d – диаметр таблетки по центру, мм; h – высота таблетки по центру, мм.
Показатель прочности должен быть 0,45–1,2 МПа.
В приборе модели ТВТ фирмы «Еrweka» (рис. 1.5) нагрузка передается на таблетку рычажно-весовым способом, обеспечивающим минимальную погрешность измерений. Прибор работает полуавтоматически.

1 − Испытуемая таблетка; 2 – вставка; 3 – конусовидный поршень.
Рис. 1.5. Прибор модели ТВТ фирмы «Еrweka» для определения прочности таблеток на сжатие
Проведение испытаний.
Испытуемую таблетку (1) помещают в специальную вставку (2) на наковальне, регулируемой по высоте, и подводят к конусовидному поршню (3), который оказывает давление на таблетку до ее разрушения. Величина давления, вызвавшая разрушение таблетки, фиксируется на шкале прибора с делениями от 0 до 15 кг.
Механическая прочность таблетки рассчитывается по формуле 1.6
 ,
(1.6)
,
(1.6)
где qm – механическая прочность таблетки на радиальное сжатие, МПа; P – разрушающие усилие, H; Kf – коэффициент формы; h – высота таблетки, мм; d – диаметр таблетки, мм.
Для определения таблеток на сжатие в соответствии с фармакопейным анализом используют метод основанный на использовании прибора типа 2, представляющего собой два расположенные друг против друга зажима, один из которых может перемещаться по направлению к другому. Плоскости поверхностей зажимов перпендикулярны направлению движения. Сдавливающие поверхности зажимов должны быть плоскими и превосходить по размеру зону контакта с таблеткой. Прибор калибруют с использованием системы, обеспечивающей точность 1 Н [3].
Проведение испытаний.
Таблетку помещают между зажимами, принимая во внимание ее форму, а также разделительную линию и надпись, если они есть. Для всех измерений таблетка должна быть ориентирована одинаково по отношению к направлению прилагаемой силе. Измерения проводят для 10 таблеток. Перед каждым измерением тщательно удаляют все фрагменты предыдущей таблетки. Эта процедура не применима при использовании полностью автоматизированного прибора.
Обработка результатов.
Необходимо указывать среднее, минимальное и максимальное значения измеренной силы в Н. Также указывают тип использованного прибора и, если необходимо, ориентацию таблеток. Для таблеток, предназначенных для измельчения или разжевывания, в частной статье указывают верхний предел прочности на сжатие. Таблетки должны иметь прочность на сжатие не ниже значений, указанных в табл. 1.8, если нет других указаний в частной статье.
Таблица 1.8
Нормированные значения прочности на сжатие таблеток в зависимости от их диаметра
-
Диаметр, мм
Прочность на сжатие, Н
6
10
7
20
8
25
9
30
10
30
11
40
12
50
13
50
Лабораторная работа № 3
ОПРЕДЕЛЕНИЕ ОДНОРОДНОСТИ СОДЕРЖАНИЯ
ДЕЙСТВУЮЩЕГО ВЕЩЕСТВА В ТАБЛЕТКАХ
РИБОФЛАВИНА
Цель работы: освоить методы определения однородности содержания действующего вещества в единице дозированного лекарственного средства; определить однородность содержания рибофлавина в таблетках.
Средства испытаний: аналитические весы марки AS 220/C/2 («Radwag», Польша) с точностью взвешивания 0,1 мг (1 класс точности), спектрофотометр с диапазоном измерения от 200 до 1100 нм или фотоэлектроколориметр, ледяная уксусная кислота, ацетат натрия, вода дистиллированная, мерная посуда.
Общие сведения
Объектом испытания являются таблетки рибофлавина (витамина В2) 0,002, 0,005 или 0,01 г.
Состав на одну таблетку:
– рибофлавина (витамина В2) – 0,002, 0,005 или 0,01 г;
– сахара – 0,153, 0,234, или 0,386 г;
– вспомогательных веществ – до получения таблетки массой 0,2, 0,3 или 0,5 г.
Действующим веществом в анализируемом лекарственном средстве является рибофлавин (Riboflavinum, Riboflavin), соединение со структурной формулой С17H20N4O6 (рис. 1.6) и молекулярной массой Mr=376, 4 г/моль [8].

Рис. 1.6. Структурная формула рибофлавина
Рибофлавин является одним из водорастворимых витаминов. Входит в состав коферментов флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД), которые участвуют в процессах переноса электронов и водорода при различных биохимических окислительно-восстановительных реакциях в организме. Рибофлавин часто называют «витамином роста», его недостаток у человека вызывает поражение слизистых оболочек, вызывает себорейный дерматит, в ряде случаев развиваются изменения со стороны органов зрения, в тяжелых случаях может развиться анемия. Рекомендуемой нормой потребления данного витамина в сутки для взрослого человека составляет 1,5−2,4 мг. Таблетки рибофлавина с содержанием 0,002 г применяются в профилактических целях; таблетки по 0,005 и 0,01 г в лечебных целях при авитаминозах и гиповитаминозах.
Испытание на однородность содержания действующего вещества в единице дозированного лекарственного средства основывается на количественном определении содержания в индивидуальных однодозовых единицах лекарственного средства с целью выяснения, находится ли это содержание внутри пределов, установленных по отношению к среднему содержанию в испытуемом образце.
Данное испытание не проводится для поливитаминных лекарственных средств и для лекарственных средств, содержащих микроэлементы, если нет других указаний в частных статьях.
Проведение испытаний.
Приготовление растворов.
Натрия ацетата раствор. Взвешивают 0,6805 г натрия ацетата и переносят в мерную колбу на 50 мл, растворяют в воде и доводят до метки.
Вода, подкисленная ледяной уксусной кислотой. В колбу, вместимостью 500 мл приливают 2,5 мл уксусной ледяной кислоты и доводят объем водой до метки.
Используя аналитическую методику, указанную в частной статье, определяют содержание действующего вещества в каждой из 10 дозированных единиц лекарственного средства, отобранных по статистически обоснованной схеме.
Одну таблетку, растертую в порошок, количественно переносят водой, подкисленной уксусной ледяной кислотой в мерные колбы вместимостью 50, 100, и 250 мл соответственно дозировкам 0,002, 0,005 и 0,01 г и растворяют в течение 10 мин.
После охлаждения объем раствора доводят водой до метки, перемешивают и фильтруют. 10 мл фильтрата переносят в мерную колбу вместимостью 50 мл, прибавляют 1,8 мл 0,1 М раствора натрия ацетата, доводят объем раствора водой до метки и перемешивают.
Измеряют оптическую плотность полученного раствора на спектрофотометре при длине волны 444 нм в кювете с толщиной слоя 1 см.
Обработка результатов.
Содержание рибофлавина в 1 таблетке вычисляют по формуле 1.7
 ,
(1.7)
,
(1.7)
где Х – содержание рибофлавина, г D – оптическая плотность испытуемого раствора; V – объем первого разведения, мл; V10 – объем фильтрата, взятый для анализа, мл; V50 – объем второго разведения, мл; l – толщина поглощающего слоя (кюветы); 323 – удельный показатель поглощения чистого рибофлавина при длине волны 444 нм, представляет собой оптическую плотность 1% (1 г в 100 мл воды) раствора рибофлавина при толщине поглощающего слоя 1 см. Аналогичные испытания и расчеты проводят еще для 9 таблеток.
Для таблеток применяют критерии А-теста [3]. Лекарственное средство выдерживает испытание, если содержание в каждой его однодозовой единице находится в пределах 85–115 % от среднего содержания. Таким образом, содержание C7H20N4O6 (рибофлавина) должно быть в одной таблетке от 0,0017 до 0,0023 г, от 0,00425 до 0,00575 г и от 0,0085 до 0,0115 г соответственно.
Лекарственное средство не выдерживает испытание, если содержание более чем в одной единице выходит за вышеуказанные пределы или если содержание хотя бы в одной единице выходит за пределы 75–125 % от среднего содержания.
Если содержание в одной единице лекарственного средства выходит за пределы 85–115 %, но находится в пределах 75–125 %, определяют содержание в каждой из 20 дополнительных однодозовых единиц лекарственного средства, отобранных по статистически обоснованной схеме. Лекарственное средство выдерживает испытание, если содержание не более чем в одной из проанализированных 30 единиц выходит за пределы 85–115 % и ни в одной единице не выходит за пределы 75–125 % от среднего содержания [3].
Лабораторная работа № 4
ОПРЕДЕЛЕНИЕ ОДНОРОДНОСТИ МАССЫ
ЕДИНИЦЫ ДОЗИРОВАННОГО ЛЕКАРСТВЕННОГО
СРЕДСТВА
Цель работы: освоить методы определения однородности массы единицы дозированного лекарственного средства; определить однородность массы таблеток, капсул, суппозиторий, порошков.
Средства испытаний: аналитические весы марки AS 220/C/2 («Radwag», Польша) с точностью взвешивания 0,1 мг (1 класс точности).
Общие сведения.
Объектом испытания являются таблетки, капсулы, суппозитории, порошки. Данное испытание не проводится для поливитаминных лекарственных средств и для лекарственных средств, содержащих микроэлементы, если нет других указаний в частной статье. Испытание не применяют в случае, если для всех действующих веществ лекарственной формы проводят испытание на однородность дозирования. Испытание основано на расчетно-весовом методе для 20 единиц препарата.
Проведение испытаний.
20 единиц дозированного лекарственного средства или содержимое каждого из 20 контейнеров, в случае однодозовых лекарственных средств в индивидуальных контейнерах, отбирают по статистически обоснованной схеме, взвешивают каждую в отдельности и рассчитывают среднюю массу.
Для капсул испытание проводят следующим образом. Взвешивают невскрытую капсулу. Затем вскрывают капсулу таким образом, чтобы не была потеряна какая-либо часть оболочки, и удаляют как можно полнее ее содержимое. В случае капсул с мягкой оболочкой промывают оболочку растворителем, указанным в частной статье, и оставляют на воздухе до удаления запаха растворителя. Затем взвешивают оболочку. По разности взвешиваний рассчитывают массу содержимого капсулы. Повторяют процедуру с другими 19 капсулами.
Порошки для приготовления лекарственных средств для парентерального применения испытание анализируют следующим образом. Удаляют бумажную этикетку с поверхности контейнера. Контейнер моют и сушат. Затем контейнер вскрывают и тотчас взвешивают. Осторожно постукиванием освобождают как можно полнее, контейнер от содержимого, ополаскивают его, если необходимо, водой и затем 96 % спиртом и сушат при температуре от 100 ºС до 105 ºС в течение 1 ч или, если природа контейнера не позволяет использовать нагревание при этой температуре, сушат при более низкой температуре до постоянной массы. Затем охлаждают в эксикаторе и взвешивают. По разности взвешиваний рассчитывают массу содержимого контейнера. Повторяют процедуру с другими 19 контейнерами.
Обработка результатов.
Рассчитывают отклонение массы единицы дозированного лекарственного средства от среднего значения mw, %.
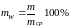 ,
(1.8)
,
(1.8)
где mi – масса каждой единицы дозированного лекарственного средства, мг; mср – средняя масса анализируемых единиц лекарственного средства, мг.
Лекарственное средство считают выдержавшим испытание, если не более двух индивидуальных масс отклоняются от средней массы на величину, превышающую значение, указанное в табл. 1.9. При этом ни одна индивидуальная масса не должна отклоняться от средней массы на величину в 2 раза превышающую нормированное значение.
Таблица 1.9
