
- •1.5.1.Фундаментальное уравнение термодинамики равновесных процессов для неоднородных многокомпонентных систем. Определение химического потенциала.
- •1.5.2.Зависимость химического потенциала
- •1.5.3.Химический потенциал компонента
- •1.5.4.Термодинамическое равновесие неоднородных многокомпонентных систем в изобарно-изотермических условиях.
- •1.6. Фазовые равновесия.
- •1.6.1.Условия фазового равновесия.
- •1.6.2.Термодинамическая вариантность многокомпонентных многофазных систем.
- •1.6.3.Правило фаз Гиббса.
- •1.7.1.Особенности изменения состава системы при химических превращениях.
- •2.1.5.Уравнение Навье-Стокса
- •2.1.1. Термическое распыление графита
- •2.1.2. Лазерное распыление графита
- •4.2 Уравнение баланса массы примесного компонента
- •1 Массовый поток примесного компонента
- •2 Уравнение конвективной диффузии
- •2. Плотность теплового потока. Закон Фурье
- •3. Уравнение энергии
- •2.4. Система уравнений переноса
- •1. Сплавы простой металл - простой металл
- •2. Переходный металл - металлоид
- •3. Сплавы переходный металл — переходный металл
- •4 Спонтанная поляризация Векторная сумма всех электронных и атомных дипольных моментов элементарной ячейки дипольного кристалла составляет ее электрический момент
- •Условие существования спонтанной поляризации
- •Применение нанотрубок
- •1. Варианты применения, основанные на размерах и механических свойствах нт
- •1.1. Острие (иглы) для стм
- •1.2. Производство нанотрубных щипчиков
- •1.3. Использование зависимости электрических свойств нт от механической нагрузки
- •1.4. Электрохимический преобразователь электрической энергии в механическую
- •Фоторезисты
- •Совмещение и экспонирование
- •9.2. Модель Дила-Гроува термического окисления кремния. Получение основного уравнения
- •.5. Классификация сегнетоэлектриков
- •Кристаллы, родственные сегнетоэлектрикам
- •7 Диэлектрическая проницаемость и структура сегнетоэлектриков
- •8 Диэлектрическая нелинейность в электрическом поле
- •Эффективная нелинейность
- •5.3.1. Распределение нелетучей примеси в кристалле,
- •5.3.2. Многократная зонная перекристаллизация
- •Инжекция неосновных носителей тока
- •Эффективность светодиодов
- •Характеристики и параметры сид
- •5.4.1 Механизмы переноса примеси в жидкой фазе
- •5.4.2. Уравнение Бартона – Прима – Слихтера для расчета
- •14.2 Стадии и режимы протекания процессов химического осаждения из газовой фазы
- •4.1.1 Общие сведения о процессах ХимГфо в технологии материалов и структур твёрдотельной электроники
- •4.1.2 Стадии протекания процесса
- •4.1.3. Режимы протекания процессов
- •4.2.2. Компонентный состав и базисные реакции в системе
- •4.2.3. Система уравнений химического равновесия
- •4.2.4. Массовая производительность реактора
- •1 Билет16
- •Вопрос 5.Оптические резонаторы. Свойства плоского резонатора. Потери в оптических резонаторах.
- •Основные технологические методы получения
- •Структура нанокомпозитов
- •Выбор компонент для получения композиционных материалов.
Билет 1
Билет 1.1 Методы получения фуллеренов в плазме электрической дуги, при распылении графита лазерным лучом, при химических реакциях разложения углеводородов.
Методы получения фуллеренов
Принято считать, что образование фуллеренов из паров графита протекает по схеме, представленной на рис. 2.1 [1-9].
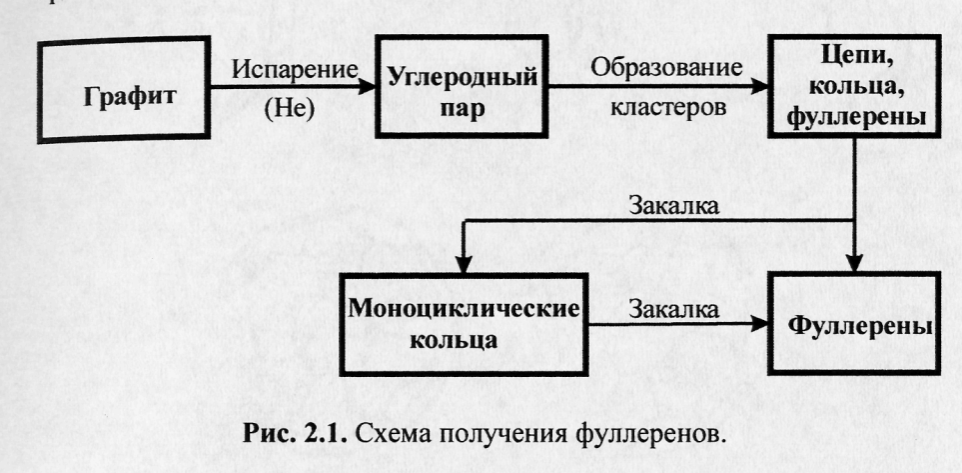
Лазерный метод синтеза фуллеренов
В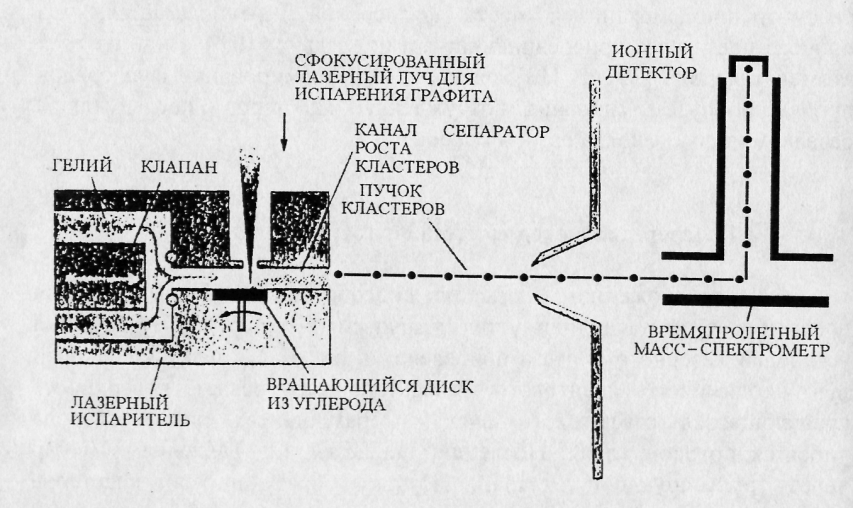 предложенном Р. Смолли способе синтеза
фуллеренов для испарения графита
используется импульсный лазер [1, 14].
Схема установки лазерного синтеза
приведена на рис. 2.3. Сфокусированный
луч неодимового квантового генератора
разогревает поверхность вращающегося
графитового диска. Образующиеся пары
углерода уносятся потоком гелия.
Последний подается под давлением 10 бар
через пульсирующий клапан. Пучок
образующихся кластеров осаждается на
стенках вакуумной камеры. Анализ
получаемых продуктов проводится
масс-спектрометром.
предложенном Р. Смолли способе синтеза
фуллеренов для испарения графита
используется импульсный лазер [1, 14].
Схема установки лазерного синтеза
приведена на рис. 2.3. Сфокусированный
луч неодимового квантового генератора
разогревает поверхность вращающегося
графитового диска. Образующиеся пары
углерода уносятся потоком гелия.
Последний подается под давлением 10 бар
через пульсирующий клапан. Пучок
образующихся кластеров осаждается на
стенках вакуумной камеры. Анализ
получаемых продуктов проводится
масс-спектрометром.
2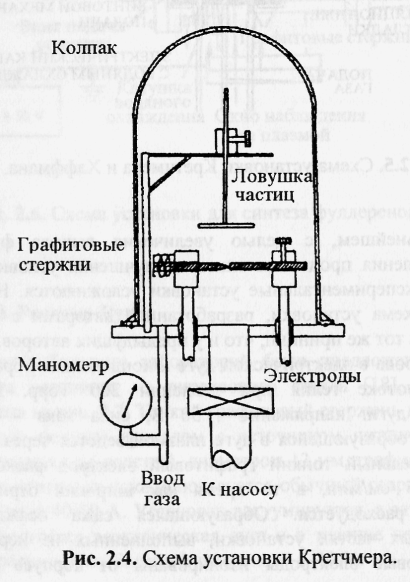 .2.
Электродуговой метод синтеза фуллеренов
Кретчмера
.2.
Электродуговой метод синтеза фуллеренов
Кретчмера
Впервые Кретчмер в [15] получил фуллерены в макроскопических количествах на установке, схема которой приведена на рис. 2.4.
Установка состоит из вакуумного колпака на плоской плите. Под колпаком находятся два графитовых стержня, соединенных с медными электродами, проходящими через плиту. Один графитовый стержень заострен, у второго - конец плоский. Для производства сажи установка предварительно вакуумируется и затем заполняется гелием до давления 0,14 бар. При подаче тока между электродами возникает электрическая дуга. Температура дуги - 2500-3000 °С. Выход фуллеренов, осаждающихся на холодных частях колпака и ловушки, -10-15 %.
Давление – обычно 80 мм.рт.ст на постоянном токе и несколько меньшее ( 35 мм.рт.ст.) на переменном.
В своем простейшем воплощении метод чрезвычайно прост, однако процент выхода фуллеренов низок, а кроме того низко и само количество получаемой фуллереносодержащей сажи.
Можно сформулировать несколько положений (моментов), которые позволяют увеличивать как процент содержания фуллерена в саже, так и увеличивать количество фуллереносодержащей сажи.
1. Для поддержания постоянных режимов горения дуги один из электродов (анод) делают подвижным и испаряемым , второй (катод) – неподвижным и неиспаряемым, причем он имеет больший диаметр, чем анод. Например, 6 мм и 12-16 мм, соответственно.
2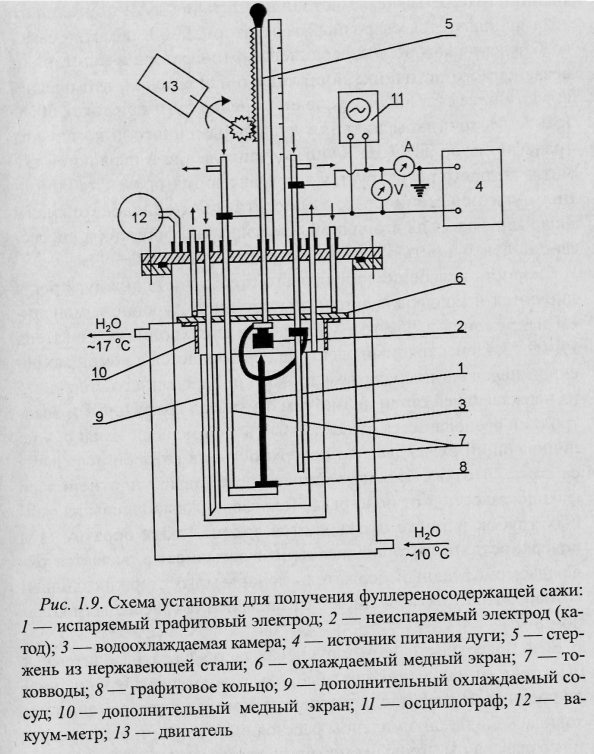 .
маловероятно, что фуллерены образуются
в плазме дуги, в центре которой по осевой
линии температура превышает 104
К [19]. При таких температурах углерод
может существовать только в атомарном
или ионном состоянии. Отсюда следует,
что фуллерены могут сформироваться или
на периферийных областях дуги, или на
поверхности камеры, где собирается
сажа. Эта поверхность обязательно должна
быть охлаждаемой.
.
маловероятно, что фуллерены образуются
в плазме дуги, в центре которой по осевой
линии температура превышает 104
К [19]. При таких температурах углерод
может существовать только в атомарном
или ионном состоянии. Отсюда следует,
что фуллерены могут сформироваться или
на периферийных областях дуги, или на
поверхности камеры, где собирается
сажа. Эта поверхность обязательно должна
быть охлаждаемой.
Экспериментально установлено, что температура охлаждающей поверхности оказывает большое влияние на выход фуллеренов из сажи. Вместо воды камера 3 охлаждалась жидким азотом, что позволило увеличить выход фуллеренов в 1,4 раза. При этом параметры дуги оставались такими же, как и при охлаждении водой. Следует отметить, что охлаждение поверхности жидким азотом значительно удорожает производство фуллеренов. Этот же эксперимент показал, что выход фуллеренов можно значительно увеличить, если понизить температуру верхних слоев сажи, которые в наибольшей степени подвергаются нагреву за счет излучения дуги. Температура поверхности сажи зависит от температуры охлаждающей подложки, теплопроводности сажи, толщины слоя и от количества теплоты, которое получает поверхность за счет излучения дуги.
3.
Улучшить охлаждение поверхности сажевого
слоя можно за счет более равномерного
его распределения по поверхности камеры,
что достигается горизонтальным
расположением э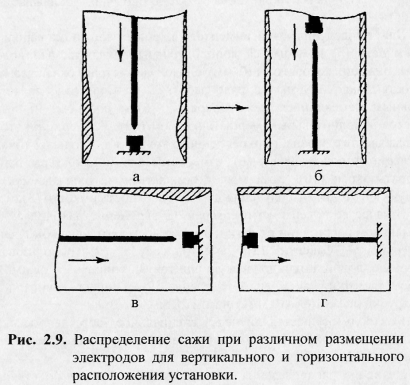 лектродов
в камере. В этом случае большая часть
сажи (до 90 %) за счет конвективных потоков
осаждается над дугой. Перемещение катода
также способствует образованию более
равномерного слоя сажи. Содержание
фуллеренов в саже, равномерно распределенной
по поверхности, на 3 — 4 % выше, чем при
неравномерном распределении. В работе
[17] экспериментально показано, что при
обычных условиях осаждения сажи, когда
толщина слоя составляет 1 — 2 мм и она
интенсивно облучается дугой, температура
поверхности сажи может подняться до
500 °С и выше, т.е. достичь значений, при
которых С^ сублимируется или вообще не
образуется вследствие высокой температуры.
лектродов
в камере. В этом случае большая часть
сажи (до 90 %) за счет конвективных потоков
осаждается над дугой. Перемещение катода
также способствует образованию более
равномерного слоя сажи. Содержание
фуллеренов в саже, равномерно распределенной
по поверхности, на 3 — 4 % выше, чем при
неравномерном распределении. В работе
[17] экспериментально показано, что при
обычных условиях осаждения сажи, когда
толщина слоя составляет 1 — 2 мм и она
интенсивно облучается дугой, температура
поверхности сажи может подняться до
500 °С и выше, т.е. достичь значений, при
которых С^ сублимируется или вообще не
образуется вследствие высокой температуры.
4. Если поверхность, на которую осаждается сажа, находится как бы в тени от излучения плазмы дуги, то выход фуллеренов увеличивается. В качестве поверхности, которая одновременно находилась бы на оптимальном расстоянии от дуги и в то же время создавала бы "тень" на поверхности камеры для сбора сажи, использовалась охлаждаемая водой цилиндрическая винтовая спираль диаметром 110 мм. Спираль навивалась из медной трубки диаметром 10 мм с шагом ~ 20 мм. Сама спираль обеспечивает частичное затенение поверхности камеры 3, которая находится на расстоянии 90 мм от дуги. Общий выход фуллеренов С60 и С70 в установке с охлаждаемой медной спиралью достигает 25 %.
3. Сжигание углеводородов
Фуллерены можно также получать и другими методами, а не только испарением углерода при воздействии лазера, электрической искры или солнца. Однако эти методы не позволяют существенно увеличить выход фуллеренов.
 Предложены
методы синтеза фуллеренов путем неполного
сжигания углеводородов. Например, из
пламени при горении смеси бензол/кислород
или этилен(ацетилен)/кислород.
Предложены
методы синтеза фуллеренов путем неполного
сжигания углеводородов. Например, из
пламени при горении смеси бензол/кислород
или этилен(ацетилен)/кислород.
Оптимальные условия синтеза [21] следующие: давление газов 69 Торр, отношение С/О равно 0,989, разбавление горючей смеси гелием, взятого в объеме 25 %. Установка для синтеза фуллеренов методом сжигания углеводородов приведена на рис. 2.11. Она состоит из камеры низкого давления, смотровых окон для визуального наблюдения и оптической диагностики, устройства электрического поджига смеси, устройства для взятия проб. Сгорание происходит на горизонтальной медной плите (диаметром 100 мм и толщиной 12 мм), имеющей отверстия, через которые подаются органическое горючее и кислород. Выход смеси фуллеренов С60/С70 - около 8 %.
Фуллерены можно получать также сжиганием бензола в пламени при 1400-3000 К. Выход фуллеренов зависит от соотношения С/О, давления, температуры, времени выдержки [33]. Фуллерены образуются при пиролизе ароматических углеводородов при температуре 500-3000 °С в атмосфере инертного газа [34]. Пиролиз происходит легче, если ацетилен или этилен разлагается в контейнере в присутствии переходного металла (кроме Си и Ag) или редкоземельного металла в атмосфере инертного газа [35]. Существуют и другие подходы по получению фуллеренов, описанные, в патентах [36-40] и обзорах [1-9].
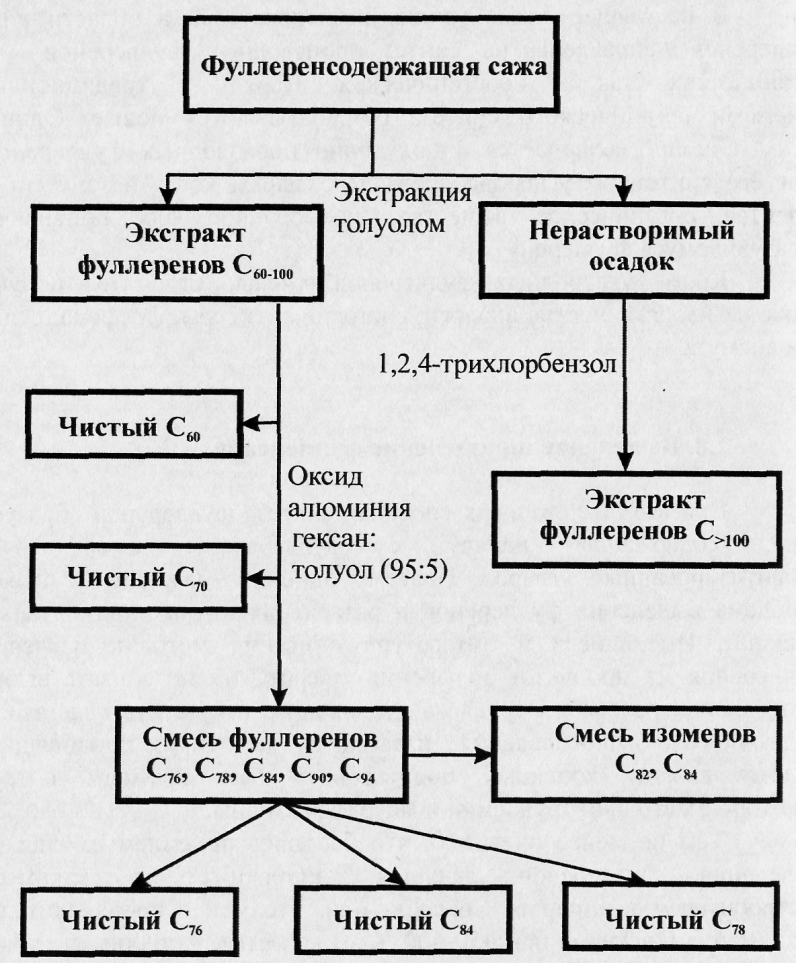
Выделение и разделение фуллеренов
При всех изложенных способах синтеза фуллеренов образуется сажа, содержащая наряду с фуллеренами аморфный и графитизированный углерод. Поэтому одной из важнейших является проблема выделения фуллеренов и разделения их на индивидуальные фракции. Имеющиеся в литературе описания методик извлечения фуллеренов из продуктов испарения графита не позволяют выбрать оптимальные режимы. Нередко в публикациях отсутствуют данные для их точного воспроизведения, излагаются методики, приводящие к малому выходу конечных продуктов и безвозвратным потерям, некоторые методики трудоемки и малоэффективны.
Методы очистки и разделения фуллеренов основаны на особенностях их растворения в различных жидкостях.
Р астворимость
фуллеренов в жидкостях используется
для очистки и разделения. Возможность
выделения фуллеренов из сажи основано
на достаточно высокой растворимости
фуллеренов в жидкостях. А процесс
сепарации различных фуллеренов (например,
С60
и С70)
основан на различной растворимости
фуллеренов в одной и той жидкости. Ряд
растворителей используется для вымывания
молекул С60
и С70
из
различных сорбентов.
астворимость
фуллеренов в жидкостях используется
для очистки и разделения. Возможность
выделения фуллеренов из сажи основано
на достаточно высокой растворимости
фуллеренов в жидкостях. А процесс
сепарации различных фуллеренов (например,
С60
и С70)
основан на различной растворимости
фуллеренов в одной и той жидкости. Ряд
растворителей используется для вымывания
молекул С60
и С70
из
различных сорбентов.
Фуллерены С60 практически не растворимы в полярных растворителях типа спиртов, в ацетоне, тетрагидрофуране и т. п.
Они слабо растворимы в парафиновых углеводородах типа пентан, гексан и декан, причем с ростом числа атомов углерода растворимость возрастает.
Фуллерены хорошо растворяются в неполярных растворителях толуол, бензол и другие, причем растворимость С60 и С70 различная.
Поэтому возможность выделения фуллеренов из сажи основана на растворении последних в толуоле и т.п.
Сажу "растворяют" в экстрагирующей жидкости и помещают в экстрактор Сокслета. В качестве экстрагирующей жидкости используются толуол, бензол и другие неполярные растворители. Приведем пример: на 4 г сажи берется 1,3 л толуола, который при этом окрашивается в темно-вишневый цвет. Затем растворитель отгоняется на роторном испарителе и экстракт промывается диэтиловым эфиром и сушится в вакууме в течение 1 часа при 80 °С.
Разделение С60 и С7о осуществляется с помощью жидкостной хроматографии.
процесс сепарации различных фуллеренов (например, С60 и С70) основан на различной растворимости фуллеренов в одной и той жидкости. Смеси фуллеренов принято разделять хроматографическим методом, изменяя состав наполнителя, тип элюента, способ введения смеси. В качестве наполнителей часто применяют оксид алюминия, графитовые или угольные порошки.
Взаимная растворимость жидкостей - вот где впору запутаться и заблудиться, до того она может быть разной. Единственное, что может здесь спасти - старое, еще алхимическое, правило: "подобное растворяется в подобном". Это означает, что жидкости с неполярными молекулами хорошо растворимы в неполярных растворителях (например, растительное масло в бензине или тетрахлориде углерода), но плохо - в воде.
Если же у обоих веществ (и у растворителя, и у растворяемой "добавки") полярные молекулы, то они тоже хорошо растворимы друг в друге. Хорошие примеры - вода и этиловый спирт или вода и ацетон: они смешиваются друг с другом в любых соотношениях и в неограниченном количестве. Вот почему, например, нельзя отмыть пятно от мазута на куртке или джинсах чистой водой: полярные молекулы воды бессильны перед неполярными частицами углеводородов, смесь которых - это и есть мазут. Зато бензин или тетрахлорид углерода неприятное пятно смоют без труда.
Э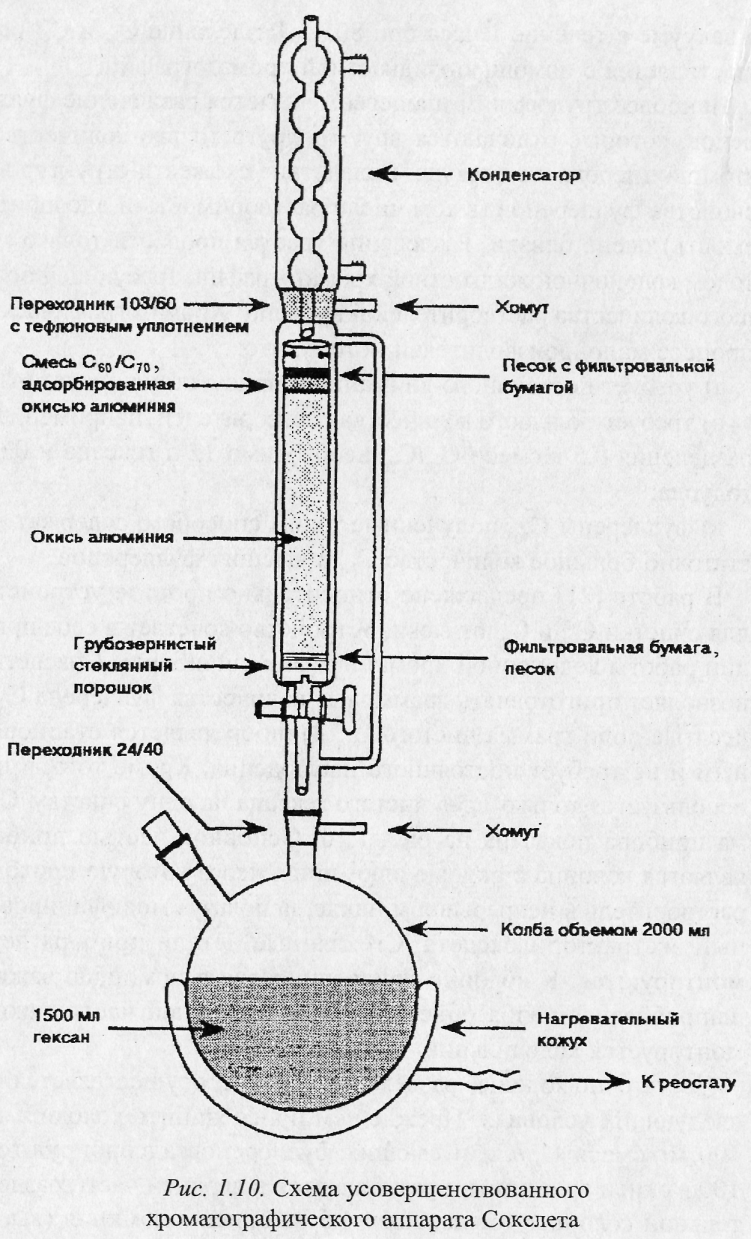 КСТРАГИРОВАНИЕ
(выщелачивание),
извлечение одного или неск. компонентов
из тв. тел с помощью избират. р-ри-телей
(экстрагентов). Подчиняется законам
массообмена. Движущая сила процесса —
разность между концентрациями
растворенного в-ва в жидкости, находящейся
в порах тв. тела и в осн. массе экстрагента.
Механизм Э. в общем случае включает
след. стадии: 1) проникновение экстрагента
в поры тв. материала, 2) растворение
целевого компонента, 3) перенос
экстрагируемого в-ва из глубины тв.
частицы к пов-сти раздела фаз (молекулярная
диффузия), 4) перенос в-ва от пов-сти
раздела фаз в объем экстрагента
(конвективная диффузия).
КСТРАГИРОВАНИЕ
(выщелачивание),
извлечение одного или неск. компонентов
из тв. тел с помощью избират. р-ри-телей
(экстрагентов). Подчиняется законам
массообмена. Движущая сила процесса —
разность между концентрациями
растворенного в-ва в жидкости, находящейся
в порах тв. тела и в осн. массе экстрагента.
Механизм Э. в общем случае включает
след. стадии: 1) проникновение экстрагента
в поры тв. материала, 2) растворение
целевого компонента, 3) перенос
экстрагируемого в-ва из глубины тв.
частицы к пов-сти раздела фаз (молекулярная
диффузия), 4) перенос в-ва от пов-сти
раздела фаз в объем экстрагента
(конвективная диффузия).

1.2 Химический потенциал.
1.5.1.Фундаментальное уравнение термодинамики равновесных процессов для неоднородных многокомпонентных систем. Определение химического потенциала.
В термодинамических системах, в которых возможно перераспределение массы вещества вследствие химических реакций или фазовых превращений, можно выделить три взаимодействия, определяющие изменение внутренней энергии системы:
1) термическое;
2) механическое;
3) химическое;
Далее будем полагать, что все указанные взаимодействия протекают равновесно.
Координатой термического взаимодействия является энтропия. Интенсивной величиной, характеризующей термическое взаимодействие, является температура. Различие температур (бесконечно малое в случае равновесного процесса), приводит к обмену энергией в форме тепла. Чем больше различие температур тел, тем интенсивнее идёт теплообмен. Величины, перепад которых определяет интенсивность энергообмена в той или иной форме, в термодинамике иногда называют потенциалами. Потенциалом термического взаимодействия является температура. Элементарное количество энергии, полученное системой в форме тепла в ходе бесконечно малого равновесного процесса, определяется формулой (?):
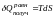 (1.5.1)
(1.5.1)
При обмене энергией в форме работы расширения координатой механического взаимодействия системы с окружающей средой является объём, а потенциалом – давление. Различие давлений (бесконечно малое в случае равновесного процесса) приводит к обмену энергией в форме работы расширения-сжатия. Элементарное количество энергии, получаемое системой в форме работы всестороннего сжатия в ходе бесконечно малого равновесного процесса, выражается формулой (L = -L = -PdV ):
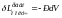 (1.5.2)
(1.5.2)
В процессах перераспределения массы между системой и окружающей средой или между подсистемами (фазами или химически различными веществами, образующими систему) в роли координат процесса выступают количества вещества независимых компонентов, определяющих состав системы. В качестве меры количества вещества могут быть выбраны либо массы, либо количества молекул, либо количества молей отдельных компонентов. Чаще всего в качестве координат, характеризующих химический состав системы, удобно выбрать количество молей компонентов {n1, n2, …, nk}, где k – число компонентов, т.е. число независимых составляющих системы. Выражение для элементарной работы химических сил в процессах химических и фазовых превращений может быть записано в виде:
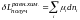 ,
(1.5.3)
,
(1.5.3)
где
интенсивные величины {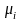 }
получили название химических потенциалов
компонентов системы. Суммирование в
(1.5.3) выполняется как по всем компонентам,
так и по всем подсистемам, если система
в целом неоднородна. Как и прочие
интенсивные параметры взаимодействия
(температура Т, давление Р), химические
потенциалы являются функциями состояния
системы, а их значения определяются
параметрами состояния, выбранными в
качестве независимых. Для многокомпонентных
систем набор независимых параметров
состояния обязательно включает параметры
состава – например, количества молей
независимых составляющих системы {n
i}.
}
получили название химических потенциалов
компонентов системы. Суммирование в
(1.5.3) выполняется как по всем компонентам,
так и по всем подсистемам, если система
в целом неоднородна. Как и прочие
интенсивные параметры взаимодействия
(температура Т, давление Р), химические
потенциалы являются функциями состояния
системы, а их значения определяются
параметрами состояния, выбранными в
качестве независимых. Для многокомпонентных
систем набор независимых параметров
состояния обязательно включает параметры
состава – например, количества молей
независимых составляющих системы {n
i}.
Как было впервые показано Гиббсом, именно неоднородность химического потенциала вызывает процессы перераспределения массы в системе. Закон сохранения энергии применимо к многокомпонентным системам с фазовыми и химическими превращениями можно записать в виде:
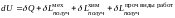 (1.5.4)
(1.5.4)
Далее для простоты последний энергетический вклад в правой части (1.5.4) учитывать не будем. С учетом выражений для тепловой, механической и химической энергий, получаемых системой в ходе бесконечно малого равновесного процесса, уравнение (1.5.4) принимает вид:
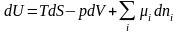 (1.5.5)
(1.5.5)
Это основное уравнение термодинамики для неоднородных многокомпонентных систем – систем состоящих из тел различного химического состава и находящихся
в различных фазовых состояниях. Используя определения
Энтальпия H=U+PV; (1.2.2)
Свободная энергия Гельмгольца F=U-TS; (1.2.3)
Свободная энергия Гиббса G=H-TS=U+PV-TS. (1.2.4)
, можно записать основное уравнение термодинамики для неоднородных многокомпонентных систем через основные характеристические функции:
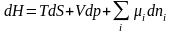 (1.5.6)
(1.5.6)
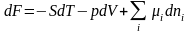 (1.5.7)
(1.5.7)
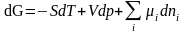 (1.5.8)
(1.5.8)
В соответствии со свойствами полных дифференциалов из (1.5.5) – (1.5.8) следует, что химический потенциал i-го компонента системы может быть найден по формулам
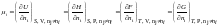 (1.5.9)
(1.5.9)
Таким образом, химический потенциал i-го компонента смеси численно равен изменению соответствующей характеристической функции при увеличении содержания этого компонента на один моль в системе
столь большой по массе, что её состав может считаться практически неизменным;
находящейся в условиях, обеспечивающих постоянство соответствующих характеристических переменных.
