
- •Глава 1
- •Глава 2
- •20 0 20 Широта, °
- •СИзссШез
- •Глава 3
- •Глава 4
- •0,1О/е,11,5щ1уЩлщо Концентрация Водорослей, мг/л
- •Глава 5
- •Глава 6
- •Глава 7
- •10 20 30 Ы) Возраст, сутки
- •Возраст, сутки а
- •5. М&рьйа
- •Глава 8
- •Глава 9
- •Глава 10
- •Глава 11
- •Неживая органика
- •Фитоппанк-
- •Относительная Величина хемосинтеза, %
- •Глава 12
- •Глава 13
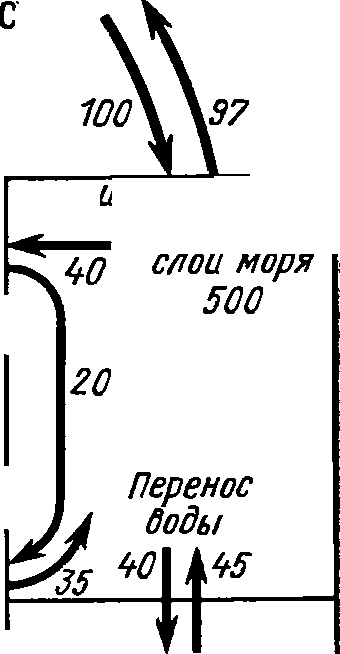
3800000
Атмосфера
700
в-у
III
ьо
§
<5
Ч
=3
I
51
5:
Биологи-
ческая
фиксация
10
РастеЛЖиВот
ния
-1
ные
О,
Растворен-
ный
азот
к
20000
Г
о,г
0,8
I 0,17
I
\
300
Г
Неорганичес
-
кий
азот
100
Г
Речной
сток
тон-~
5
\20
Зоопланктон
рыбы
<5
Ассими-
Поверх-
ляция
ностные
3
20
Неживая
органика
3000
<1
-1
Глубинные
'
Воды моря
34500
Осадочные
породы
Ь-101
2-10'
Рис.
57. Схема круговорота азота и углерода
(все величины — в
млрд.
т) (по Болину, 1972, и Дельвичу, 1972)
нос
с суши. В связи с применением удобрений
резко возросло его
количество,
поступающее в водоемы, что усиливает
их эвтрофика-
цию,
ухудшая качество воды. В связи с этим
работа микроорганиз-
мов-денитрификаторов
может рассматриваться полезной и
даже
заслуживающей
искусственной стимуляции. Однако
перспективнее
заботиться
не об уничтожении соединений азота
(«а их производ-
ство
затрачиваются огромные средства), а
находить формы хозяй-
ствования
на водоемах, при которых эвтрофикация
будет предуп-
реждаться
изъятием полезной биологической
продукции с аккуму-
лированным
в .ней азотом.
Круговорот
фосфора. В природных водах фосфор в
основном
встречается
в трех формах: растворенной фосфатной,
растворенной
органической
и нерастворенной органической (во
взвешенных час-
тицах)
. Их сумма обозначается как общий
фосфор.
Среднее содер-
жание
фосфора в речных водах земного шара
составляет около
70
мг/м3,
в озерах — 30—40 мг/м3,
в поверхностном слое Мирового
океана
его несколько меньше.
Естественный
круговорот фосфора в биосфере вследствие
неле-
тучести
его соединений не сбалансирован.
Основные его запасы со-
держат
горные породы, которые постепенно
передают водораство-
334Неживая органика
Фитоппанк-
римые
фосфаты наземным экосистемам. Вынос
фосфатов из на-
земных
экосистем в континентальные водоемы
обогащает их фос-
фором.
Реки ежегодно выносят в Мировой океан
около 2 млн. т
фосфора.
Обратное движение фосфора из Мирового
океана на сушу
и
в наземные водоемы ограничено (вылов
рыбы и других организ-
мов
человеком, птицами); оно не компенсирует
вынос фосфора с
суши.
Круговорот
фосфора заметно изменился в связи с
интенсифика-
цией
сельского хозяйства. Все возрастающее
использование удоб-
рений,
сопровождающееся повышением содержания
фосфора в кон-
тинентальных
водоемах, обусловливает их звтрофикацию.
В
пределах водоема круговорот фосфора
сводится к тому, что
его
концентрация в зоне фотосинтеза
непрерывно понижается за
счет
перемещения вглубь вместе с отмирающими
водорослями и
другими
организмами. Обогащение поверхностного
горизонта про-
исходит
в результате подъема глубинных вод.
В
подвижной форме фосфор находится в
восстановительной, но
не
сильнощелочной среде. Поскольку там,
где он имеется, почти
всегда
есть избыток восстановленного железа,
при окислении они
вместе
выпадают в практически нерастворимый
осадок. В анаэроб-
ных
условиях происходит обратный процесс.
Сходную роль играет
связывание
в определенных условиях фосфора в
фосфат марганца.
В
какой-то степени фосфор восстанавливается
в результате жизне-
деятельности
фосфоредуцирующих бактерий, использующих
кисло-
родный
анион в качестве акцептора электронов
в анаэробных усло-
виях.
Большую
роль в седиментации фосфора и извлечении
его из
грунта
играют гидробионты. С помощью корневой
системы донные
макрофиты
извлекают фосфор из слоев грунта,
удаленных от его
поверхности
до метра и более. Важную роль в
седиментации фос-
фора
играют фильтраторы. Например, популяция
литорального
моллюска
МойШиз
йетьззиз
осаждает фосфора на грунт вместе
с
.псевдофекалиями
5,5 мг/м2
в сутки, в то время как суммарное
ко-
личество
фосфора во взвешенных частицах в
исследованном райо-
не
(юго-восточное побережье США) достигало
14 мг/м2
(общий
Р
—39 мг, в фосфатах — 19 мг, в растворенных
органических соеди-
нениях—
6 мг/м2).
Содержание фосфора в грунте равнялось
37
мг/м2,
следовательно, за сутки оно восполнялось
за счет мол-
люсков
на 15%. Эти величины дают представление
о скорости кру-
говорота
фосфора на морской литорали. Примерно
такая же она и
в
континентальных водоемах. Как показали
Е. Е. Успенский и
А.
В. Францев, способность водных макрофитов
к энергичному изъ-
ятию
фосфора и других биогенов может с
успехом использоваться
при
создании экосистем, улучшающих питьевые
качества воды.
Круговорот
серы. Сера присутствует в воде в составе
сульфат-
ного,
сульфитного и сульфидного ионов, в
свободном состоянии, в
форме
Н23
и
др.
В водоемы сера в том или ином виде
попадает из
атмосферы,
с осадками, при растворении горных
пород. Выход ее
из
гидросферы в основном связан с выделением
Нг5, связыванием
335
в
осадках и биотическим путем (изъятие
организмов человеком,
птицами
и др.) - В пределах водоема круговорот
серы сводится к ее
восстановлению
до Н25
в анаэробных условиях и окислению
там,
где
есть свободный кислород. Оба процесса
в основном связаны с
жизнедеятельностью
организмов.
В
пресных водах Н23
обычно образуется в результате
анаэроб-
'ного
распада органических веществ в грунте
и .придонных горизон-
тах
воды. Другой путь образования Н23
— восстановление сульфа-
тов
в процессе диссимиляторной сульфатредукции,
которая в огром-
ном
масштабе протекает в морях. Восстановление
сульфатов идет
с
участием сульфатредуцирующих бактерий,
в частности пресновод-
ной
ОезиЦоюьЬгю
<1ези1ркиг1сап8
и
морской О.
аезЫаги.
Сульфатредуцирующие
бактерии, будучи анаэробами и
гетеро-
трофами,
используют сульфаты как акцепторы
водорода при мета-
болическом
окислении («сульфатное дыхание»),
подобно тому как
нитрат-
и нитритредуцирующие бактерии отдают
электроны анио-
нам,
содержащим кислород, при отсутствии
свободного Ог. В ка-
честве
окисляемых субстратов используются
некоторые органичес-
кие
кислоты и водород. Деятельностью
сульфатредуцирующих бак-
терий
объясняется, например, .насыщение
сероводородом водной
толщи
Черного моря, придонных горизонтов
Каспийского моря,
многих
норвежских фиордов. НгЗ образуется
там, где достаточно
сульфатов
и вследствие застойности воды создаются
анаэробные
условия.
В
озерах Н25
выделяется в слоях воды, лишенной
кислорода и
имеющей
низкий окислительно-восстановительный
потенциал.
В
донных осадках анаэробной зоны скорость
образования Н23
на
2—4
порядка выше, чем в водной толще,
составляя 2—30 мг Н2&
на
1 кг грунта в сутки (для слоя ила 0—2
см). Численность суль-
фатвосстанавливающих
бактерий в иле достигает 104—108
кл/мл.
В
воде олиготрофных озер их количество
обычно менее 10 кл/мл, в
мезотрофных
повышается до 104—10®
кл/мл и в эвтрофных — до
Ю7
кл/мл. Значительное количество Н23
фиксируется в виде суль-
фида
двухвалентного железа, но в кислых
илах это соединение пе-
реходит
в раствор. В меромиктических озерах,
богатых сульфатами,
значительную
роль в продукции Н25
играют фототрофные бакте-
рии
(обычно зеленые серобактерии); на их
долю приходится 13—-
75%
первичной продукции стратифицированных
водоемов (Гор-
ленко,
1981). В реках образующийся в небольших
количествах Н23.
быстро
окисляется и в воде, как правило, не
обнаруживается.
В
морских и континентальных водоемах
Н23
окисляется в при-
сутствии
кислорода отчасти химически, в основном
же — в резуль-
тате
жизнедеятельности различных бактерий.
Бесцветные микро-
аэрофильные
серобактерии, в частности нитчатые
Вец&1а1оау.
ТкШкпх
и др., окисляют Н23
до элементарной серы, которая осаж-
дается
внутри клеток. Последующее окисление
ее происходит, ког-
да
Н25
во
внешней
среде исчерпывается. Высвобождающаяся
энер-
гия
используется на восстановление С02
(хемосинтез). Второй путь-
биологического
окисления Н23
связан с жизнедеятельностью ряда.
336
фотосинтезирующих
зеленых и пурпурных бактерий,
использующих
сероводород
в качестве донатора водорода. Пурпурные
бактерии
могут
редуцировать тиосульфат, окисляя его,
как и Н23,
до суль-
фата,
а зеленые окисляют сероводород до
элементарной серы. В не-
большом
количестве Н25
используется на биосинтез метанобразую-
щими
бактериями. Существенное значение в
биотическом кругово-
роте
серы имеют тионовые бактерии, в частности
виды р. ТМоЪасИ-
1из,
окисляющие тиосульфаты до серы, которая
образуется внекле-
точно.
Совокупная деятельность бесцветных,
пурпурных, зеленых и
тионовых
бактерий обеспечивает восстановление
запаса сульфатов,
уменьшающегося
в результате деятельности
еульфатредуцирующих
бактерий.
Вовлечение сульфатов в круговорот в
основном происхо-
дит
при биосинтезе автотрофами серосодержащих
аминокислот, т. е.
является
результатом сульфатредукции. При
окислении летучих ор-
ганических
соединений серы, высвобождаемых
морскими организ-
мами,
образуется ЗСЬ; например, в Перуанском
апвеллинге кон-
центрация
этого газа достигает 40—50 мг/м3.
Его количество, об-
разуемое
морскими организмами, оценивается в
60-10® т в год.
Круговорот
углерода. Основной путь биотической
циркуляции
углерода
— выделение его в форме ССЬ животными
и поглощение
фотосинтезирующими
организмами. Фитопланктон Мирового
океа-
на
в год потребляет около 40 млрд. т углерода.
Некоторой способ-
ностью
использовать минеральный углерод
обладают гетеротрофы.
Небольшая
часть фитопланктонтов и других
организмов опускается
на
дно, и заключенный в них углерод выходит
из биотического кру-
говорота.
Биологический круговорот углерода —
очень небольшая
составляющая
всего цикла его превращений. Большая
часть запаса
углерода
гидросферы вовлекается в круговорот,
протекающий без
участия
организмов. Сюда относятся обмен С02
газа между водой
и
атмосферой, процессы накопления и
растворения карбонатов, вы-
нос
последних с речным стоком в море,
образование горючих иско-
паемых.
Ежегодно около 100 млрд. т атмосферной
двуокиси углеро-
да
(77 его количества в атмосфере) растворяется
в Мировом океа-
не
и замещается примерно равным количеством
С02,
выделяющего-
ся
из океана. Приближенная количественная
характеристика звень-
ев
цикла углерода приведена на рис. 57.
Круговорот
железа и марганца. Оба элемента, близкие
по своим
свойствам,
встречаются в водоемах совместно, и
круговорот их .име-
ет
много общего. Железо и марганец обычно
поступают в водоемы
в
виде растворенных закисных солей,
гуматов или в окисленном со-
стоянии
в форме взвеси. Окисленные нерастворимые
соединения
либо
оседают на дно, либо восстанавливаются
до растворимых за-
кисных
форм, преимущественно гидрокарбонатов.
Если на дне кис-
лорода
нет, осевшие окислы восстанавливаются
до подвижных за-
кисных
форм, диффундирующих в водную толщу.
Так как в поверх-
ностном
слое воды кислорода больше, железа и
марганца здесь
меньше,
а при энергичном фотосинтезе может не
быть вообще. Это-
му
способствует и подщелачивание воды.
При перемешивании вод,
.например,
в озерах во время весенней и осенней
циркуляции желе-
337
зо
и марганец, растворенные в придонном
слое, поступают в более
верхние
горизонты, где, окисляясь, переходят
во взвесь, и цикл пов-
торяется.
Круговорот
железа тесно сопряжен с циклами фосфора
и серы.
На
дно оно выпадает в виде РеРО^, Ре(ОН)3
и РеС03.
Образую-
щийся
в результате сульфатредукции Н25
восстанавливает железо
либо
до нерастворимых сульфидов Ре5 и Ре25,
которые захороня-
ются
в грунт, либо до переходящих в раствор
Ре3(Р04)2
и
Ре(НС03)2.
Ведущая
роль в круговороте железа и марганца
принадлежит
гидробионтам.
К ним прежде всего относятся
железобактерии,
спо-
собные
использовать энергию окисления закисных
форм железа н
марганца
для хемосинтеза, — многие виды р.
ТМоЬасШиз,
Ьер1о-
Игг1х,
МеШ1о§етит, ОсНгоЬШт
и др. Ко второй группе принадле-
жат
бактерии, покрытые слизистой оболочкой,
на которой отлага-
ются
окислы железа или марганца, — виды р.
С1айо1Нпх,
Ьуп@Ыа.
Отложение
железа бывает настолько обильным, что
затрудняет
жизнь
бактерий, и они выходят из своего
железистого покрытия.
Через
некоторое время их слизистая оболочка
вновь покрывается
железистыми
отложениями. Окисление закисей железа
и марган-
ца
у этих бактерий —способ их защиты от
метаболически образую-
щейся
токсической перекиси водорода. У многих
бактерий процесс
редукции
Н202
ускоряется выделением фермента
каталазы; иногда
она
продуцируется симбионтами бактерий.
Под
тяжестью осевших на тело окислов
бактерии опускаются
в
гиполимнион или на дно. Если там
преобладают восстановитель-
ные
процессы, окислы, покрывающие оболочки,
растворяются и
бактерии,
имея газовые включения, снова всплывают
в поверхност-
ный
слой. Цикл повторяется и, таким образом,
круговорот железа
и
марганца ускоряется. Одновременно
создается своеобразный «хи-
мический»
подток кислорода в придонные слои из
-поверхностных
горизонтов
(поступление окислов, выход закисей).
Особая
группа железобактерий представлена
формами, способ-
ными
использовать органику гуматов железа;
освобождающееся
железо
оседает на поверхность тела (ЗШегосарва
и др.). Известное
значение
в круговороте железа и марганца имеют
макрофиты и во-
доросли,
использующие при интенсивном фотосинтезе
С02
бикар-
бонаты
обоих элементов. Это вызывает сильное
подщелачивание
воды,
что ускоряет выпадение железа и марганца
в виде гидратов
окиси.
, Новообразование
органического вещества
и
энергобаланс экосистем
Новообразование
органического вещества, или первичное
про-
дуцирование,
представляет собой одно из фундаментальных
свойств
экосистем.
Благодаря жизнедеятельности автотрофных
организмов
в
водоемах создается первопища, благодаря
которой в конечном
счете
существуют все гетеротрофы. Количество
создаваемой авто-
338
трофами
первопищи определяет ход всех
внутриводоемных процес-
сов,
всю энергетику экосистем.
Новообразование
органического вещества в основном
осущест-
вляется
фототрофами, т. е. за счет утилизации
солнечной энергии,
В
неизмеримо меньшем количестве оно
синтезируется хемосинтети-
ками
с использованием энергии экзотермических
процессов окисле-
ния
некоторых восстановленных соединений.
Важно отметить, что
вещества,
окисляемые хемосинтетиками, в большинстве
случаев
представляют
собой продукты анаэробного раопада
органических
соединений,
создаваемых фотосинтезирующими
растениями. Следо-
вательно,
роль хемосинтетиков заключается не
столько в создании
первопищи,
сколько в трансформации энергии,
аккумулированной
фотосинтетиками,
мобилизации той части ее, которая не
вовлека-
ется
в круговорот другими организмами.
Среди
фототрофов различают фотогетеро-
и фотоавтотрофов.
К
первым относятся организмы, превращающие
с помощью свето-
вой
энергии менее энергоемкие органические
вещества в более
энергоемкие
(большинство несерных пурпурных и
коричневых бак-
терий,
некоторые пурпурные серные бактерии).
Фотоавтотрофные
организмы
делятся на фотосинтезирующие
(восстановление С02
с
выделением
Ог) и фоторедуцирующие
(восстановление СОг без вы-
деления
02).
Фоторедукция характерна для ряда
бактерий, в част-
ности
зеленых и серных. Цианобактерии в
аэробных условиях —
фотосинтетики,
в анаэробных — фоторедукторы. Водоросли
и более
высокоорганизованные
растения — фототрофы относятся к
фото-
синтетикам.
В
1973 г. Д. Остерхольт и У. Стокениус открыли
новую форму
автотрофии
у галофильных бактерий р. На1оЪас1епит,
не имеющих
хлорофилла
и преобразующих солнечную энергию в
химическую.
Поглощение
света и генерация протонного потенциала
осуществля-
ется
у них пурпурным белком бактериородопсином,
названным так
за
химическое сходство с родопсином,
содержащемся в сетчатке
глаз
животных. Бактериородопсин, структура
которого была пол-
ностью
расшифрована Ю. А. Овчинниковым (1978),
представляет
собой
простейший биологический преобразователь
солнечной энер-
гии
в химическую; его молекулярная масса
(27 килодальтон) во мно-
го
раз меньше, чем у хлорофилла. Автотрофия,
осуществляемая за
счет
бактериородопсина, — простейшая и,
по-видимому, древней-
шая
форма фотосинтеза. Галофильные бактерии
— массовые обита-
тели
сильно осолоненных тепловых вод,
малопригодных для обита-
ния
других фототрофов. Например, в
поверхностных водах Мерт-
вого
моря, где концентрация водорослей не
превышает 10 экз./л.,
галофильные
бактерии встречаются в количестве 3—5
млн./мл
(Огеп,
1983).
Энергетическое
обеспечение фотосинтеза. На границе
атмосфе-
ры
интенсивность солнечной радиации
равна 8,2 Дж/см2-мин.
До
поверхности
Земли в ясный полдень в низких широтах
доходит око-
ло
5,8 кДж. За год на 1 см2
поверхности водоемов в высоких ши-
ротах
поступает 170—210 кДж, в средних —330—420
и в низких —
339
580—670
кДж. Некоторая часть этой энергии
(5—10%) отражает-
ся
от поверхности воды, остальная проникает
в воду. Световой по-
ток
постепенно ослабевает с продвижением
в глубину. П|ри этом из-
меняется
спектральный состав исходной радиации
с уменьшением
относительного
значения той части, которая может
утилизировать-
ся
растениями. Эта часть потока, называемая
фотосинтеттески
ак-
тивной
радиацией
(ФАР), в 'основном соответствует полосе
види-
мого
света и составляет около 50% от суммарной
энергии солнеч-
ного
излучения. В связи с быстрым поглощением
в воде солнечной
радиации
и изменением ее спектрального состава
у гидрофитов вы-
работался
широкий круг световых адаптаций. С
одной стороны, это
приспособления
к максимальной утилизации энергии
лучей разной
длины,
с другой — адаптации к оптимизации
фотосинтеза в усло-
виях
колебания силы света.
У
гидрофитов пигментный аппарат (разные
виды или даже один
вид)
состоит из различных комбинаций
хлорофиллов (а,
Ь, с, А),
фикобилинов
(фикоцианин, фикоэритрин и др.) и
каротиноидов.
Первая
группа пигментов представлена
бактериохлорофиллами а,
Ь,
с, (1
у бактерий и хлорофиллами а,
Ъ, с
и д.
у всех других фото-
синтетиков.
Последние всегда содержат хлорофиллы
а
и Ъ
(у крас-
ных
водорослей нет), реже с
(бурые, хризофитовые, динофлагел-
ляты)
и й
(красные). Пигменты несколько отличаются
друг от дру-
та
по своему строению и спектру поглощения.
При
агрегации мономерных молекул хлорофилла
и взаимодей-
ствии
последних с белками положение максимумов
поглощения мо-
жет
заметно смещаться, обеспечивая
дополнительные возможности
хроматической
адаптации при изменении спектрального
состава ра-
диации.
В
процессе фотосинтеза большинство
молекул пигментов игра-
ет
роль «сборщиков» квантов света,
передающих поглощенную _
энергию
на реакционные центры, где и происходят
фотохимические
реакции
восстановления СОг. Такими центрами
являются длинно-
волновые
формы хлорофилла а
и бактериохлорофилла а.
Миграция
энергии
со «сборщиков» квантов на реакционные
центры происхо-
дит
почти без ее рассеивания.
Фикобилины,
встречающиеся у синезеленых (фикоцианы)
и не-
которых
красных водорослей (фикоэритрины),
имеют один макси-
мум
поглощения в области 500—600 нм. Они
передают поглощен-
ную
энергию на хлорофилл, расширяя
энергетическую базу фото-
синтеза.
Несколько десятков каротиноидов,
мобилизующих на фо-
тосинтез
лучи разных участков спектра, играют
ведущую роль в
адаптации
гидрофитов к условиям освещения.
Например, в тропи-
ческой
части Тихого океана на глубинах порядка
50 м доля сол-
нечной
энергии, поглощаемой каротиноидами,
достигает 90% и
лишь
10%) приходится на долю хлорофилла
(Кобленц-Мишке и др.,
1975).
Помимо передачи энергии хлорофиллам
каротиноиды защи-
щают
их от фоторазрушения и несут другие
функции.
Различия
в пигментном аппарате в значительной
мере опреде-
ляют
вертикальное распределение водорослей,
адаптированных к
340
особенностям
спектрального состава света на разных
глубинах.
Обычно
на мелководье преобладают зеленые
водоросли, на дне бо-
лее
глубоких участков чаще встречаются
бурые и еще глубже —
красные.
Одни и те же водоросли могут иметь
разную окраску в
зависимости
от того, в каких условиях освещения
находятся. На-
пример,
красная водоросль ОгасИапа
ьеггисоза
.на ярком свету ут-
рачивает
фикоэритрин и становится зеленой, а в
условиях слабой
освещенности
снова восстанавливает красный пигмент.
Некоторое
количество
его содержат и цианобактерии, особенно
обитающие на
значительных
глубинах. У них в качестве общей
закономерности
прослеживается
уменьшение содержания пигментов с
усилением
освещенности:
в первую очередь билипротеинов, затем
хлорофил-
лов
и каротиноидов; такая картина, например,
у Ыойи1аг1а
зр.
про-
слеживается
с увеличением освещенности с 750 до 2350
лк, у Апа-
сузИз
шйи1апз
— до 2000 л к (Гусев, 1968).
Между
спектральным составом света и составом
пигментов име-
ется
четкая связь. Например, в сублиторали
залива Вудс-Хол
(США)
у всех изученных зеленых и красных
водорослей с продви-
жением
в глубину не только увеличивалось
общее содержание пиг-
ментов,
.но и возрастало отношение
фикобилино-протеинов и хлоро-
филла
Ь
к хлорофиллу а; это оптимизирует
скорость фотосинтеза
в
условиях низкой освещенности (Катив
е! а11., 1976). Четко про-
слеживается
относительное уменьшение хлорофилла
а
в пигмент-
ном
аппарате морского фитопланктона по
мере продвижения вглубь
и
соответствующего изменения спектрального
состава лучистого
потока.
Установлено, что в процессе биосинтеза
часть молекул хло-
рофилла
а
превращается в хлорофилл Ъ
и улавливаемая последним
световая
энергия передается хлорофиллу а,
усиливая работу «ан-
тенны»—
восприятия световой энергии. По-видимому,
у растений _
имеются
фоторецепторы, которые наряду с
пигментом фитохромом
:в
условиях различной освещенности
выполняют существенную ре-
гуляторную
роль в оптимизации фотосинтетического
аппарата.
Пластичность
сформированного в определенных световых
условиях
фотосинтетического
аппарата проявляется в быстрой (2—4
дня)
адаптации
структуры хлоропласта к новым условиям
освещения.
Зависимость
уровня фотосинтеза от освещенности
неодинако-
ва
у свето- и тенелюбивых растений.
Интенсивность ФАР, при ко-
торой
наблюдается световое насыщение, у
тенелюбивых водорос-
лей,
адаптированных к низкой освещенности
(0,13 Дж/см-2
■мин-1)
в
несколько раз ниже, чем у светолюбивых,
приспособленных к по-
вышенной
радиации (0,6—0,8 Дж/см-2•мин-1).
У первых темп фото-
синтеза
увеличивается линейно при возрастании
освещенности до
■20—30%
от полного солнечного света. В этом
диапазоне скорость
фотохимических
реакций ниже, чем темновых. При радиации
свы-
ше
50—60% от полного солнечного света
фотосинтез не усиливает-
ся—
наступает световое насыщение, связанное
с относительно не-
большой
скоростью темновых реакций. У тенелюбивых
растений
световое
насыщение наступает значительно
раньше, обычно при
.5—10%
от всей солнечной радиации. Как видно
на рис. 58, для до-
341
Средняя
освещенность,
лк
Рис.
58. Зависимость фотосинтеза от
освещенности: А
— разные расте-
ния
в одном местообитании (Потапов, 1956); Б
— фитопланктон из раз-
ных
местообитаний (Каутоп!, 1963):
1
— Шг1си1аг1а ^ч.1^ап.ч, 2
— Сега1орНу11ит
йетег&ит, 3 — С1айорНога зр.. 4
— Му-
гюрНуИит
ьег(1сИ1а1ит, 5
— освещенность, 6
— тропические поверхностные формы,
7
— тепловодные поверхностные формы, 8
— арктические поверхностные формы,
9
—
подповерхностный планктон
стижения
максимума фотосинтеза тропическим
водорослям требу-
ется
больше света, чем арктическим,
поверхностному фитопланкто-
ну
больше, чем подповерхностному. Пузырчатка
нуждается в мень-
шей
освещенности, чем роголистник, рдесты
— в большей. Сезон-
ные
изменения видового состава фитопланктона
часто связаны с
изменением
освещенности.
Суточный
прирост водорослей определяется
интенсивностью и
продолжительностью
освещения, причем существует
определенный
предел
насыщающей суточной радиации, зависящей
от продолжи-
тельности
фотопериода. Например, у морских
диатомовых скорость
роста
увеличивается линейно с повышением
суточной радиации до
95—230
Дж/см2
ФАР (Финенко, 1977).
В
Куйбышевском водохранилище прямая
зависимость фотосин-
теза
от освещенности у зеленых водоростей
проявлялась в преде-
лах
125—450 Дж/см2,
у цианобактерий — от 40 до 200
Дж/см2;
диатомовые
водоросли занимают среднее положение.
Максимум
фотосинтеза
у зеленых, диатомовых и цианобактерий
наблюдается
соответственно
при 630—420—340 Дж/см2
в сутки. Для РгогосеШ-
гит
Ш1сап8
установлена следующая зависимость
интенсивности фо-
тосинтеза
от освещенности (Акинина, 1967):
Освещенность,
тыс. лк 10 7 5 0,6
Фотосинтез,
ммЮг/мг-ч 4,1 5,4 3,6 1,5
Насыщающая
интенсивность света зависит от
физиологическо-
го
состояния водорослей. Например,
оптимальная освещенность для
энергично
размножающихся клеток заметно выше,
чем для деля-
щихся
менее интенсивно. На примере СН1оге11а
показано, что эф-
фективное
световое насыщение наступает при
разной интенсивно-
342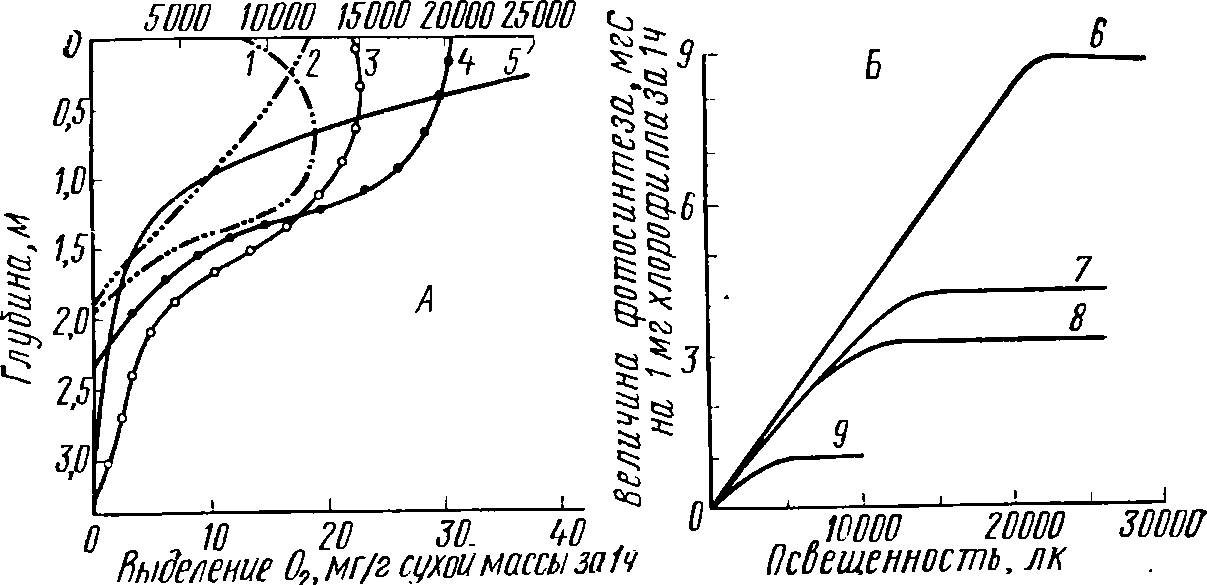
сти
радиации в зависимости от рН и
концентрации СОг; экспери-
ментальная
стабилизация этих факторов снимает
эффект изменения
освещенности
(СоЬеп е! а11., 1982).
Величина
ФАР, обеспечивающая максимум роста
водорослей,
ниже
той, .какая обеспечивает максимум
фотосинтеза; это объясня-
ется
тем, что образование азотсодержащих
продуктов достигает
-предела
уже при сравнительно низком освещении,
в то время как
биосинтез
углеводов возрастает с дальнейшим
усилением радиации.
Мспользуя
различные механизмы, растения способны
регулировать
интенсивность
фотосинтеза в соответствии со своими
потребностя-
ми
и конкретными условиями среды. Регуляция
осуществляется на
уровне
хлоропластов, клеток, органов и растения
в целом. Напри-
мер,
в зависимости от силы света хлоропласта
приближаются к по-
верхности
клетки или удаляются от нее, поворачиваются
к лучам
под
прямым или острым углом.
Нуждаясь
в разном количестве света, теневыносливые
и свето-
любивые
фототрофы держатся, ка,к правило, на
глубинах с разной
освещенностью.
Например, в пресных водах самый верхний
слой
занимают
цианобактерии, образующие на поверхности
в тихую
теплую
погоду сплошную пленку. Всплывание
происходит вслед-
ствие
обильного выделения пузырьков газа.
В Тихом океане Руго-
хузИз
рзеийопосШиса
обнаруживается, как правило, на
глубине
50—100
м, Р1апк{оте11а
зо1
и Сга8з1епа11а
1гор1са
— глубже 25 м.
В
Черном море .преимущественно на глубине
50—125 м встреча-
ются
диатомовые Тка1аззюпета
пИгзЫоШея, КИгзсЫа йеИсаИззгта,
N.
1оп§1881та, N. с1оз(епит
и др. На глубине 25—50 м обычно дер-
жатся
крупные перидиниевые РегШтит
сНюегдепз, Р. сгаззьрез,
Р.
реёисиШит, СегаИит (проз.
Только в верхних слоях моря встре-
чаются
РЫгозо1ета
са1саг-аг)1з
и Негтезтит
айпаИсит.
В
водоемах с прозрачной водой, особенно
мелких, при чрезмер-
ной
освещенности водные макрофиты не
поднимаются до поверхно-
сти,
образуя подводные луга, и таким образом
до некоторой степе-
ни
защищаются от вредного действия
избыточной радиации. На ли-
торали
очень прозрачного Средиземного моря
массовое развитие
водорослей
наблюдается только зимой и весной, на
глубине — ле-
том.
По сходным причинам вследствие сильной
освещенности верх-
них
слоев воды максимальная концентрация
водорослей в тропиче-
ских
морях обычно наблюдается на глубине
10—20 м.
В
значительной мере это может быть
связано с действием
УФ-радиации.
У ряда водорослей выявлено линейное
снижение ско-
рости
фотосинтеза с увеличением интенсивности
коротковолновой
(320
нм) радиации (\Уоггез1 е! а11., 1981).
Степень
светолюбивости растений до некоторой
степени отража-
ет
компенсационная
точка
— сила света, при которой величина
фо-
тосинтеза
равна величине дыхания (образование
кислорода равно
его
потреблению). Очевидно, в этих условиях
растение может су-
ществовать,
хотя прироста его массы не будет.
У
водных макрофитов компенсационная
точка, как правило, со-
ответствует
освещенности 32—320 лк. У разных водорослей
она до-
343
стигается
при радиации 0,44—0,21 Дж/см2-мин
или 0,2—0,7% от
всей
видимой солнечной энергии. Положение
компенсационной точ-
ки
находится в прямой зависимости от
температуры. Например, с
повышением
ее от 5 до 20°С компенсационная точка у
8р1го§уга
поднимается
с 27 до 174 лк, у С1ас1орНога
— от 63 до 253 лк.
Компенсационная
точка отражает среднюю непрерывную
осве-
щенность,
.необходимую для существования растений.
Если в связи
с
чередованием светлой и темной частей
суток они на какое-то вре-
мя
выключаются из фотосинтеъической
деятельности, то в другое
время
освещенность должна быть выше точки
компенсации.
Например,
вследствие вертикальных перемещений
водных масс
водоросли
из верхних слоев могут заноситься в
более глубокие и
существовать
там известное время в условиях
недостаточной осве-
щенности.
Когда токами воды растения выносятся
в поверхностные
горизонты,
то энергично фотосинтезируют и быстро
.пополяют запа-
сы
питательных веществ. Благодаря
вертикальным перемещениям
фитопланктона
нижняя граница его существования, как
правило,
лежит
заметно ниже слоев, где освещенность
обусловливает равно-
весие
между фотосинтезом и дыханием. При
этом для ряда форм
известное
значение может иметь частичный переход
на гетеротроф-
ное
питание за счет использования
растворенных органических ве-
ществ.
Максимальная
глубина, на которой освещенность во
время наи-
большей
радиации соответствует компенсационной
точке, примерно
в
2,5 раза превышает прозрачность воды,
измеряемую по диску
Секки.
В морях она обычно равна нескольким
десяткам метров.
В
пресных водах нижнее положение
компенсационной точки обыч-
но
соответствует глубине в несколько
метров.
Химическая
база фотосинтеза. Для новообразования
органичес-
ких
веществ фотосинтетики нуждаются в
углеродном питании и по-
ступлении
ряда минеральных элементов (биогенов).
Элементы
минерального питания играют большую
.роль в жизне-
деятельности
гидрофитов. Уменьшение или увеличение
их количест-
ва
отражается на интенсивности фотосинтеза,
на составе образую-
щихся
продуктов. Степень воздействия отдельных
элементов зави-
сит
от состояния растений и условий их
существования. Например,
при
слабой освещенности растения не
реагируют на добавку азота,
усиливающую
фотосинтез, когда света много.
Минеральные
элементы влияют на фотосинтез, изменяя
состоя-
ние
мембран, и соответственно на
фотосинтетическое фосфорили-
рование
и транспорт электронов. При недостатке
азота грануляр-
но-ламеллярная
система хлоропластов сильно сокращается
в объ-
еме,
резко снижается содержание стромы.
При .недостатке фосфо-
ра
угнетается формирование мембран,
уменьшается число гран в
хлоропластах
и их число в клетках. Изменение структуры,
хлоро-
пластов
отражается на фотохимических реакциях.
Например, при
дефиците
азота ослабевает циклическое и
нециклическое фосфори-
лирование.
Особенно резко минеральное питание
влияет на темно-
вые
реакции фотосинтеза. Через системы,
контролирующие синтез
344
белков
хлоропластов, оно влияет на
фотосинтетический аппарат,
регулируя
активность и направленность его работы.
Вода
по сравнению с лочвой содержит
несравненно меньше био-
генов
и поэтому не может за счет их запасов
длительное время под-
держивать
существование растений. Однако биогены,
содержащие-
ся
в воде, не только исчерпываются
растениями, но и непрерывно
возобновляются
(регенерируют) в результате отмирания
гидро-
бионтов
и их разложения, так что химическая
база фотосинтеза не-
прерывно
восстанавливается. Так, после отмирания
фитопланкто-
на
20—25% общего фосфора немедленно
возвращается в воду в
неорганической
форме и 30—40% —в органической, причем
до 70%
фосфора
минерализуется в течение двух дней
(Водяницкий, 1965).
Особенно
интенсивно химическая база фотосинтеза
восстанавлива-
ется
в сезоны года с высокой перемешиваемостью
вод, когда био-
гены
в больших количествах выносятся из
глубин в поверхностный
слой.
Минимальные
концентрации биогенов, достаточные
для обеспе-
чения
нормальной жизнедеятельности водорослей,
для разных так-
сономических
групп неодинаковы. В еще большей степени
они зави-
сят
от размера клеток. Чем меньше относительная
поверхность во-
дорослей
(крупные водоросли), тем выше требуемая
концентрация
биогенов.
Существенное значение для роста
водорослей имеют
РОВ.
Например, суточное поглощение водорослями
соединений уг-
леводного
и белкового ряда, свойственных океанской
воде, дости-
гает
0,2—10% от сукой массы клеток. В некоторых
районах южной
Атлантики
водоросли могли поглощать растворенную
органику в
количествах,
в десятки раз превышающих величину
фотосинтеза.
Из
биогенов, список которых довольно
велик, наибольшее значение
для
автотрофов имеют азот, фосфор, кремний,
железо, марганец и
некоторые
микроэлементы. Существенное значение
имеют также
соединения
углерода, используемого для фотосинтеза
углеводов.
Углерод.
В качестве источника углерода растения
исполь-
зуют
различные соединения. Например, часть
морских водорослей
может
утилизировать углерод бикарбонатов.
Для многих других
водорослей,
в частности красных, показано, что
интенсивность их
фотосинтеза
зависит только от присутствия свободных
молекул СОг-
По-видимому,
большинство морских водорослей не
использует для
синтеза
углерода непосредственно бикарбонатные
ионы, хотя в не-
большом
масштабе может иметь место и этот
процесс. Для пресно-
водных
цианобактерий МссгосузНз
аеги§1поза
и АпаЪаепа
уапаЬШз
установлено
преимущественное потребление углерода
в форме би-
карбонатов
(Мережко, 1968). Высказывается мнение,
что такая
форма
углеродного питания свойственна и
другим синезеленым, о
чем,
в частности, говорит факт их
преимущественного обитания в
щелочной
среде. Если разложение бикарбонатов
происходит непо-
средственно
на поверхности растений, то они часто
покрываются
известковой
коркой, под тяжестью которой погружаются
на дно.
Кроме
того, обызвествление растений изолирует
их от света, ухуд-
шая
условия фотосинтеза. Поэтому присутствие
в воде свободной
345
в0* Р.мкг-атом//! Ы01-н,мкг-отом1л 51,мкг-аггшп/л
Рис.
59. Изменение содержания фосфатов (А),
нитратов (Б)
и силикатов (В)
с
глубиной (по Зенкевичу, 1951):
/
— Тихий океан, 2
— Атлантический, 3 — Индийский
углекислоты
в наилучшей степени обеспечивает ход
фотосинтеза.
Поглощая
во время фотосинтеза свободную
углекислоту, растения
повышают
рН среды, и нарушение ионного равновесия
стимулиру-
ет
переход бикарбонатов в монокарбонаты
с высвобождением мо-
лекул
СОг. Чем интенсивнее растения потребляют
свободную угле-
кислоту,
тем большее количество ее поступает
в воду, и пока в во-
де
достаточно бикарбонатов, фотосинтез
практически не ограничи-
вается
недостаточностью источников углеродного
питания.
Азот.
Минеральные соединения азота присутствуют
в воде в
трех
формах—аммонийной, нитритной и
нитратной. В морской
воде
большую часть года преобладают нитратные
формы, причем
их
количество обычно колеблется в пределах
от 0,2 до 0,4 мг/л.
В
пресных вода(х концентрация нитратного
азота может достигать
мг/л
и более. Нитриты, как правило, присутствуют
в воде в мень-
шем
количестве, чем нитраты. В океане
содержание нитритов ред-
ко
превышает 0,03 мг/л, обычно их менее
0,003 мг/л, причем нахо-
дятся
они преимущественно ниже зоны
фотосинтеза. В пресных во-
дах
концентрация нитритов выше и, как
правило, выражается
десятым,и
долями миллиграмма на литр, особенно
в эвтрофных во-
доемах.
Аммиачный азот в открытом океане
содержится в концент-
рации
не более 0,03 мг/л, в прибрежье она может
возрастать до
0,2
мг/л и более. Примерно в тех же количествах
содержится ам-
миачный
азот в пресных водах.
Во
время сильного развития фитопланктона
соли азота могут
полностью
исчезнуть в поверхностном слое воды.
На большой глу-
бине
они присутствуют постоянно в значительных
количествах
(рис.
59). Поэтому условия азотного питания
растений в значитель-
ной
мере определяются степенью перемешиваемости
водных масс.
В
местах подъема глубинных вод в зоне
дивергенций, где соли азо-
та
выносятся в поверхностные горизонты,
создаются особенно бла-
гоприятные
условия для развития фитопланктона.
Там, где воды
перемешиваются
слабо, запасы солей азота в поверхностных
слоях
346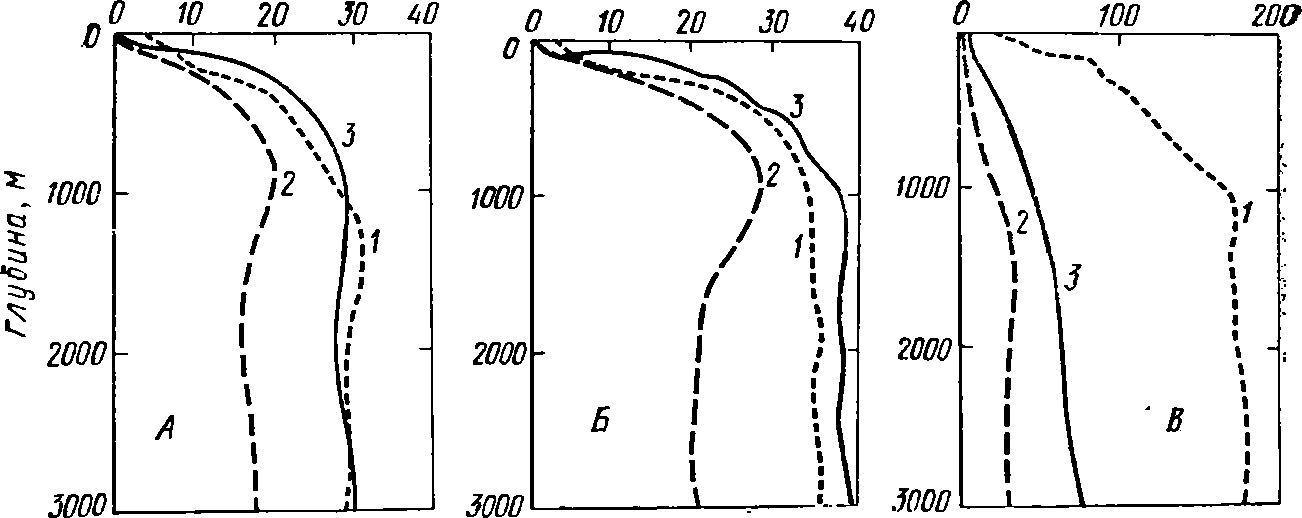
быстро
исчерпываются и наступает азотное
голодание фитопланк-
тона.
Растения
нуждаются в разных концентрациях солей
азота и,
■кроме
того, проявляют неодинаковую
избирательность к его фор-
мам.
С повышением концентрации солей азота
сверх оптимальных
развитие
водорослей угнетается; особенно
чувствительны они к вы-
соким
концентрациям аммиачного азота.
Фосфор.
Растения используют в основном фосфор
фосфа-
тов,
содержащихся в поверхностном слое
морской воды в количест-
ве
нескольких сотых или тысячных долей
миллиграмма на литр.
Так,
содержание фосфатов в Ла-Манше летом
составляет 0,001—
0,007
мг/л, зимой — 0,015—0,019 мг/л. На глубинах
концентрация
фосфатов,
как и солей азота, заметно выше и
достигает 0,2—
0,3
мг/л. В поверхностных слоях океанской
воды фосфаты в значи-
тельных
количествах обнаруживаются в местах
выхода глубинных
вод,
в зоне дивергенций. Например, у берегов
Перу и Антарктики
содержание
фосфатов в поверхностном горизонте
воды достигает
0,2
мг/л. В пресных водах количество фосфатов
несколько выше,
чем
в морях, и обычно выражается сотыми
долями миллиграмма
на
литр.
При
отсутствии вертикальной перемешиваемости
воды запасы
фосфатов
в поверхностных слоях быстро истощаются
и наступает
фосфорное
голодание водорослей, сопровождающееся
снижением
■их
количества. Особенно резко это может
проявляться в морях,
когда
отмирающие организмы, опускаясь вглубь,
не возвращают
поверхностному
слою воды потребленный здесь фосфор,
выводя его
из
сферы циркуляции. Этим объясняется
бедность фитопланктона
в
тропической зоне океана, где нет
перемешивания поверхностных
и
глубинных вод. Например, в то время как
концентрация фосфа-
тов
на поверхности субарктических ®од
достигает 0,037—
0,042
мг/л Р, в субтропических она составляет
всего 0,003—
0,009
мг/л Р. Оптимальные для водорослей
концентрации фосфо-
ра—
десятые и сотые доли миллиграмма на
литр. Так, для диато-
мовых
Аз(епопе11а
и ТаЬеИапа
оптимальна концентрация 0,002—
0,01
мг/л Р, а с ее повышением до 0,2 мг/л Р
жизнедеятельность
водорослей
угнетается (Гусева, 1961). Скорость роста
черномор-
ских
водорослей при концентрации фосфора
1—30 мгк/л не лими-
тировалась
(Финенко, 1977). Для ряда пресноводных
водорослей
константа
Михаэлиса (концентрация, обеспечивающая
скорость
роста,
вдвое меньшую максимальной) равна 5—10
мкг/л. Р. При
отсутствии
фосфора водоросли не фотосинтезируют
и вскоре отми-
рают.
Находясь в условиях высокого обеспечения
фосфором, диато-
мовые
и перидиниевые водоросли способны
накапливать его в сво-
их
клетках и некоторое время функционировать
(фотосинтезиро-
вать,
делиться) в среде, лишенной фосфора.
Кремний.
Этот элемент 'Находится в воде в форме
кремние-
вой
кислоты и ее производных, в частности
в виде коллоидов 5ЮгХ
ХН20.
В поверхностных слоях морей тропиков
и субтропиков
кремний
встречается в концентрации около 0,15
мг/л, в субропиче-
347
ских
водах она повышается до 1,1 мг/л. В
глубинных водах крем-
ния
значительно больше: до 7 мг/л в Тихом
океане и Антарктике,
до
3 мг/л в Каспии и 3,5 мг/л в Азовском море.
В пресных водах
кремния
больше, чем в морских. В озерах его
количество часто до-
стигает
5—6 мг/л и лишь 'В редких случаях падает
до 0,2 мг/л
(в
дистрофных водоемах).
Кремний
необходим для построения створок
диатомовых водо-
рослей,
имеющих наибольшее значение в морском
фитопланктоне к
очень
распространенных в пресных водах. Во
время массового раз-
вития
диатомовых содержание кремния в воде
может падать до>
очень
низких величин и ограничивать численность
водорослей, как.
это,
например, отмечено для экваториальной
зоны Мирового океа-
на,
северо-западной части Черного моря.
Байкала и ряда других:
водоемов.
Железо
и марганец.
Оба элемента присутствуют в во-
де
в форме закисей, окисей, коллоидов и в
органических соединени-
ях.
Концентрация в ионной форме повышается
с понижением рН
л
поэтому зависит от интенсивности
фотосинтеза (подщелачивание
среды).
В морской ('более щелочной) воде железа
обычно содер-
жится
0,5—5 мг/л, в пресной — до 50 мг/л и более.
Железолюбивые
водоросли
нуждаются в концентрациях железа
(оптимум) порядка
1—2
мг/л, другим растениям оно необходимо
в меньших количест-
вах.
Недостаток железа вызывает у растений
хлороз.
Марганца
в морской воде содержится обычно 1—10
мкг, в прес-
ной—
примерно в 10 раз больше. В низких
концентрациях порядка
1—2
мкг/л он стимулирует развитие водорослей,
при больших (свы-
ше
10 мкг/л) становится для многих, в
частности АрНатготепоп
и
Сое1озрНаепит,
ядовитым. Другие водоросли, например
Аз(егю-
пе11а
и ОзсйШопа,
выдерживают концентрации марганца в
десять
раз
больше.
Микроэлементы.
Из отдельных микроэлементов наиболь-
шее
значение в жизни водных растений имеют
калий, кальций, иод,
медь,
молибден и некоторые другие. Так,
доведение концентрации
Мо
до 10—40 мкг/л увеличивало фотосинтез
водорослей в воде и»
оз. Илза
(Латв. ССР) в несколько раз, комбинация
из М0+1В
— в
5
раз; прибавление В в воду из ацидотрофного
оз. Питолис в коли-
честве
50—500 мкг/л повышало интенсивность
фотосинтеза в сред-
нем
в 4 раза (Сикигз, 1967). Как правило,
микроэлементы имеются
в
достаточных количествах и обычно не
ограничивают численность
водорослей.
Величина
фотосинтеза и методы ее определения.
В зависимости
от
цели оценки различают величину истинного
и кажущегося
фото-
синтеза.
Первая величина (брутто-фотосинтез,
валовая продук-
ция)
— это все количество органического
вещества, создаваемого в
процессе
фотосинтеза, вторая (нетто-фотосинтез,
чистая продук-
ция)
— то же самое количество за вычетом
потребленного фотосин-
тетиками
на собственные энерготраты. Первая
величина характери-
зует
общую фиксацию СОг, вторая — количество
накапливаемых и
выделяемых
ассимилятов. Энерготраты оцениваются
по интеноив*
348
ности
дыхания, которое у растений, как недавно
открыто, протека-
ет
не только в виде митохондриального,
сопровождающегося окис-
лительным
фосфорилированием. Параллельно
митохондриальному
на
свету у растений наблюдается фотодыхание,
не сопряженное с
окислительным
фосфорилированием.
Интенсивность
фотодыхания повышается с увеличением
осве-
щенности,
не обнаруживая насыщения даже при
действии прямого>
солнечного
света. Этим оно противоположно
митохондриальному,
которое
ингибируется светом, начиная с величин
порядка 10 тыс. лк.
Фотодыхание
усиливается с повышением концентрации
кислорода
во
всем диапазоне ее значений, прекращаясь,
когда содержание О*
падает
ниже 2%. Митохондриальное дыхание
положительно кор-
релирует
с содержанием кислорода только в
диапазоне 0—2%. Кис-
лородное
стимулирование фотодыхания и за счет
этого расход про-
межуточных
продуктов фотосинтеза угнетают рост
растений.
Отрицательно
коррелирует величина фотодыхания с
концентра-
цией
СОг. Показано, что фотодыхание у
водорослей освобождает
клетки
от лишней энергии при избыточном
освещении, от лишнего
органического
вещества, накапливаемого в условиях
избытка све-
та
и СОг( Коуеп, ВеагйаП, 1981). Повышение
скорости фотосинте-
за
сверх определенного порога сопровождается
активированием
ферментов
фотодыхания, которые играют важную
роль в регуля-
ции
.метаболизма растений.
В
настоящее время величина кажущегося
фотосинтеза наиболее
часто
определяется по количеству выделяющегося
кислорода или
по
поглощению углерода. Реже это делается
путем учета потребле-
ния
биогенов или изменения биомассы
фотосинтетиков за тот или
иной
промежуток времени.
Для
учета образующегося кислорода две
склянки — прозрачную
и
светонепроницаемую — заполняют водой
с находящимися в ней
водорослями,
герметически закрывают и экспонируют
требуемое
время.
Затем в каждой из склянок определяют
концентрацию кис-
лорода
и по разнице судят о величине фотосинтеза.
Сравнивая кон-
центрацию
кислорода в светлой склянке после
опыта с той, которая
имелась
в исходной воде, получают итоговую
характеристику пре-
вышения
фотосинтеза над деструкцией органического
вещества
(дыхание
водорослей, бактерий и др.). Величина
деструкции оцени-
вается
по разности концентраций кислорода в
темной склянке до и
после
опыта.
Кислородный
метод технически очень прост, удобен
и в эвтроф-
ных
водоемах достаточно чувствителен,
позволяя улавливать изме-
нения
концентрации кислорода порядка 0,01
мг/л. В олиготрофных:
водоемах,
где концентрация хлорофилла а
не превышает 1 мкг/л и
фотосинтез
выражается очень малыми величинами,
чувствитель-
ность
этого метода недостаточна. К недостаткам
метода относится
и
неточность, связанная с допущением,
будто величина дыхания во-
дорослей
в темных и светлых склянках одинакова.
В действитель-
ности
это не так, поскольку в светлых склянках
к митохондриаль-
ному
окислению добавляется фотодыхание.
3*9
Для
учета величины фотосинтеза по убыли
СОг широко исполь-
зуется
радиоуглеродный метод, предложенный
в 1951 г. Е. Стеман-
ном-Н-ильсеном.
При этом в одной из двух склянок
определяют со-
держание
углерода в исходной воде, в другую
вводят очень неболь-
шое
точно учтенное количество 14С
и экспонируют ее некоторое вре-
мя.
По окончании опыта содержимое склянки
фиксируют формали-
ном
и процеживают через фильтр, задерживающий
водоросли.
С
помощью счетчика определяют количество
фиксированного в них
14С.
Определив, какая часть от введенного
14С
поглощена водорос-
лями,
и предположив, что ими воспринята такая
же часть имевше-
гося
в исходной воде 12С,
рассчитывают суммарное количество
ус-
военного
углерода.
Радиоуглеродный
метод очень чувствителен и обычно
позволя-
ет
улавливать изменения концентрации
углерода порядка
0,0001
мг/л. Но он имеет и ряд существенных
недостатков. Основ-
ной
из них —сложность интерпретации
полученных данных. Если
длительность
экспозиции склянок мала и усвоенный
14С
не успева-
ет
в сколько-нибудь заметной степени
снова перейти в воду в про-
цессе
дыхания водорослей, радиоуглеродный
метод характеризует
величину
брутто фотосинтеза. В противном случае
метод позво-
ляет
оценить лишь превышение фотосинтеза
над дыханием водоро-
слей.
Если фотосинтез окажется близким
дыханию, то при длитель-
ной
экспозиции склянок он почти не
регистрируется радиоуглерод-
ным
методом. В результате величины
фотосинтеза, найденные ра-
диоуглеродным
и кислородным вариантами скляночного
метода,
иногда
существенно (на порядок и более)
отличаются. Попытки
найти
переходный коэффициент при сравнении
данных, получаемых
разными
методами, не дают желаемого результата,
поскольку срав-
ниваются
функции разных переменных, не связанных
определенной
зависимостью.
Следует
добавить, что радиоуглеродный метод
не учитывает ад-
сорбцию
14С
на поверхности клеток, некоторую
дискриминацию в
его
поглощении и гетеротрофную ассимиляцию
углекислоты. На-
конец,
оценка фотосинтеза по убыли СОг в
энергетическом аспекте
менее
определенна, чем по образованию
кислорода. Энергетичес-
кая
«стоимость» кислорода (в среднем 13,2
кДж/мг) почти не за-
висит
от характера веществ, ассимилируемых
в растениях, а для
углерода
может уклоняться на 20—30%.
Рассматривая
величины фотосинтеза, получаемые
кислородным
-и
радиоуглеродным вариантами скляночного
метода, необходимо
иметь
в виду и их неточность, связанную с
искусственностью усло-
вий.
В склянках накапливаются продукты
фотосинтеза, исчезают
углекислота
и биогены, меняется рН, создается
застойность и др.
Все
это должно сопровождаться изменениями
естественных про-
цессов
в системе в соответствии с принципом
Ла Шателье (если на
систему,
находящуюся в равновесии, оказывается
какое-либо воз-
действие,
то в результате протекающих в ней
процессов равновесие
смещается
в направлении, уменьшающем оказываемое
воздей-
ствие).
Например, установлено, что с увеличением
концентрации-
350
02
в склянках у Мг/й$ [1ехШ5
фотореспирация возрастает, и фото-
синтез
снижается. В проточной воде фотосинтез
идет значительно
интенсивнее,
чем в замкнутых сосудах, в которых он
снижается с
увеличением
экспозиции. В большой серии опытов,
проведенных на
Иваньковском
водохранилище, показано, что с увеличением
дли-
тельности
экспозиции склянок с 2 до 4, 6, 12 и 24 ч
величина фото-
синтеза
в пересчете на сутки закономерно
снижается и составляет-
всего
10—20% от получаемой суммированием
результатов кратко-
временных
наблюдений (Тарасенко, 1984).
Существующие
методы определения величины фотосинтеза
не
позволяют
судить о том, куда 'направляется
фиксируемый угле-
род—на
рост (синтез белков) или накопление
запасных веществ
(полисахариды,
липиды). Показано, что состав конечных
продук-
тов
фотосинтеза зависит от физиологического
состояния растений,
условий
освещения, обеспеченности биогенами,
температуры и дру-
гих
факторов среды. Например, при длительном
азотном голода-
нии
и избытке света баланс фотосинтеза
смещается в 'сторону на-
копления
полисахаридов и липидов. С повышением
скорости роста
■в
биомассе клеток наблюдается
пропорциональное снижение отно-
шения
С:Ы; насыщающая интенсивность света
для синтеза белков
в
5—10 раз ниже, чем для полисахаридов и
липидов (Могпз, 1981).
Интенсивность
и эффективность фотосинтеза. Интенсивность
фо-
тосинтеза
представляет собой его величину в
единицу времени, от-
несенную
к биомассе растения или к массе
содержащегося о нем
хлорофилла.
Второй показатель называется
ассимиляционным
чис-
лом
(АЧ). Различают часовые и суточные АЧ.
В Мировом океане
в
условиях оптимального освещения
часовые АЧ колеблются от 0,1
до
35 мгС на 1 мг хлорофилла, хотя обычно
лежат в пределах 0,5—
15;
максимальные величины отмечаются в
низких широтах, мини-
мальные
характерны для высоких широт, а также
для олиготроф-
ных
тропических и субтропических вод
Мирового океана ('Ведерни-
ков,
1982). В Рыбинском водохранилище в условиях
оптимальной:
освещенности
часовые АЧ колеблются от 2 до 4 мг С на
1 г хлоро-
филла
а.
В удобренных прудах рыбхоза «Якорь»
(Московская
обл.)
они оказались примерно в 1,5 раза ниже,
чем в неудобрен-
ных.
Интенсивность
фотосинтеза в сильной мере зависит от
условий
освещения.
Обычно оптимальные величины радиации
лежат в пре-
делах
0,4—0,8 Дж/.см2-мин
видимой части спектра. Эти величины
обычно
наблюдаются на некотором удалении от
поверхности во-
доема,
особенно в низких широтах. Например,
по данным В. Эд-
мондсона,
в оз. Кристалл, Траут, Мендота (США) с
прозрачно-
стью
воды 7, 5 и 2 м максимум интенсивности
фотосинтеза наблю-
дается
на глубинах 6, 3 и 1,5 м. По данным Райтера,
для обеспече-
ния
максимальной интенсивности фотосинтеза
зеленым водорослям
необходимо
0,17—0,22 Дж/см2
(ФАР), динофлагеллятам — 0,75—
0,88
Дж/см2,
диатомовые занимают премежуточное
положение. При
полном
солнечном свете фотосинтез зеленых и
диатомовых водоро-
слей
составляет всего 5—10% от максимального,
фотосинтез дино-
351
флагеллят—
20—30%. В водоемах дельты Волги наблюдается
деп-
рессия
фотосинтеза, если радиация превышает
21—25 кДж/м2
■ сут.
Значительно
влияет на интенсивность фотосинтеза
температура.
При
1°С длительность темновой фазы,
лимитирующей скорость фо-
тосинтеза,
составляет 0,4 с, при 25°С — 0,04 с. В
диапазоне 0—20°С
температурный
коэффициент <3ю фотосинтеза у морского
планкто-
на
равен примерно 2,2 ('Ведерников, 1976). Чем
выше температура,
тем
большая освещенность нужна водорослям
для обеспечения
максимального
фотосинтеза. Например, для диатомовой
Аз1епопе1-
1а
^огтоза
оптимальная освещенность при 5° С равна
0,12 Дж/см2X
Хмин,
при 11 и 17° — соответственно 0,21 и 0,33 Дж.
При этом ин-
тенсивность
фотосинтеза возрастает с 5 до 8 и 13 мг
Ог на 1 млрд.
жлеток
за час (ТаШп&, 1957).
Интенсивность
фотосинтеза подавляется, если дефицит
тех или
иных
веществ тормозит или вовсе исключает
темновые реакции.
Не
отдавая энергию на биосинтез,
макроэргические соединения не
запасают
новые ее количества, и фотосинтетичеокое
фосфорилиро-
■вание
блокируется. С повышением температуры
концентрация био-
тенов,
достаточная для обеспечения максимальной
интенсивности
фотосинтеза,
снижается. Например, для морского
фитопланктона
величина
АЧ уменьшается при содержании нитритов
менее
2
мкмоль/л N в теплых водах (/>20°С) и 3
мкмоль/л — в более хо-
лодных
(Ведерников, 1976). Наиболее часто
фотосинтез лимитиру-
ют
Р, N. 51, С и некоторые витамины.
Под
эффективностью фотосинтеза понимают
степень использова-
ния
солнечной энергии на фотосинтез и
прирост клеток. Важным
показателем
эффективности фотосинтеза служит
число квантов све-
та,
необходимое для усвоения одной молекулы
СОг. Самый низкий
■квантовый
расход у водорослей равен 8—10. При
высокой освещен-
ности
энергия той или иной части квантов не
используется на вос-
становление
СОг и квантовый расход фотосинтеза
возрастает.
•С
уменьшением интенсивности света
степень утилизации его энер-
гии
возрастает. Например, в р. Ковже с
продвижением в глубину
на
5,50 и 100 см при энергии лучистого потока
соответственно 480—
100—25
Дж/см2
в день в нижнем горизонте утилизация
энергии
была
в 4,5 раза больше, чем у поверхности, и
в 1,5 раза выше, чем
на
глубине 50 см. Свет, состоящий из
фотосинтетически активных
лучей,
утилизируется полнее, чем содержащий
«балластную» энер-
гию.
Доля ФАР в спектре солнечного света,
падающего на поверх-
ность
водоемов, составляет около 50% и несколько
снижается по
мере
проникновения радиации вглубь.
Степень
использования световой энергии зависит
от обеспечен-
ности
растений минеральным питанием. Например,
водоросль
Зсепейезтиз
диайпсаийа
с повышением концентрации азота от
3
до
20 и 40 мг/л использовала лучистую энергию
соответственно в
2
и 3 раза эффективнее. Когда в 1 л культуры
подопытной водорос-
ли,
лишенной в течение нескольких дней
фосфора, добавлялось
мг
этого элемента, то уже через несколько
часов утилизация све-
та
возрастала на 20—60% (Баславская, 1961).
На 100% увеличи-
352
лось
использование света водорослями
БипаИеИа
заЫпа
и Б.
ьт-
сН8
после продувания культуры воздухом с
примесью 5% СОг.
Хемосинтез.
Хемосинтезирующие бактерии встречаются
как в
пресных,
так и в соленых водоемах, обитая в толще
воды, «а поверх-
ности
и в глубине грунта. Обычно они
концентрируются там, где
анаэробные
условия сменяются аэробными, так как
нуждаются в
кислороде
и восстановленных соединениях, которые,
в частности,
образуются
в результате анаэробного распада
органических ве-
ществ.
Из хемосинтетиков наибольшее значение
в водоемах имеют
бактерии,
окисляющие сероводород и серу.
Органические вещества,
попадая
в бескислородную зону, распадаются в
присутствии суль-
фатов,
служащих окислителями. Более 90% энергии
уходит при
этом
на восстановление сульфатов до
сульфидов. Получив запас
энергии,
сульфиды мигрируют из грунта в воду и
в зоне окисления
используются
хемосинтезирующими бактериями. Если
сероводород-
ная
зона освещена, то в окислении Н23
участвуют пурпурные бак-
терии.
Величина хемосинтеза в верхнем слое
сероводородной зоны
достигает
20—25 мкг/л в сутки, лишь в 2 раза уступая
величине
фотосинтеза
пурпурных серобактерий и в 6 раз —
величина фото-
синтеза
водорослей. В кислородной зоне, где
тионовая микро-
флора
развита слабо, НгЗ окисляется главным
образом химически,
а
эффективность использования энергии
окисления составляет все-
го
0,14% (Сорокин, 1968). У верхней границы
сероводородной зо-
ны,
где интенсивность хемосинтеза
максимальна, биологическим
путем
окисляется уже около трети 52-,
а эффективность использо-
вания
энергии на хемосинтез достигает 12,8%.
В
связи с использованием хемосинтетиками
недоокисленных
продуктов
анаэробного распада наибольшее
количество автотроф-
ных
неокрашенных бактерий концентрируется
в грунтах, меньше
их
в придонном слое воды, а в последнем
больше, чем у поверх-
ности.
Среди грунтов наиболее богаты
хемосинтетиками илы, со-
держащие
значительные количества разлагающегося
органического
вещества.
Меньше бактерий в песчанистых грунтах.
Например, в
поверхностном
слое иловых отложений Рыбинского
водохранилища
величина
хемосинтеза достигает 0,26—1,7 мг/л С в
сутки, в незаи-
ленной
затопленной почве — 0,26 мг/л С. В свежих
иловых отло-
жениях
Горьковского водохранилища хемосинтез
идет еще энергич-
нее,
давая продукцию 2—7 мг/л С в сутки, а в
отдельных слу-
чаях—
до 14 мг/л С.
Интенсивность
хемосинтеза в толще воды обычно в
десятки
и
сотни раз ниже, чем в грунте. Например,
в Куйбышевском водо-
хранилище
хемосинтез в придонном слое воды
достигал
0,024
мг/л С в сутки, в грунте — 5,08 мг/л С, т.
е. был примерно
в
250 раз выше. В поверхностном слое воды,
где продуктов анаэ-
робного
распада меньше, чем у дна, хемосинтез
идет еще слабее.
На
рис. 60 видно, как постепенно снижается
уровень хемосинтеза
в
направлении от придонных слоев воды
к поверхностным.
Интенсивность
хемосинтеза растет с повышением
температуры.
В
образцах грунта Рыбинского водохранилища
величина хемосин-
12—2062
353
