
- •1. Види науково обґрунтованих класифікацій та номенклатури, що враховують як будову карбонового ланцюга, так і наявність у молекулі певних функціональних груп.
- •2. Ізомерія в органічних сполуках. Просторова будова органічних
- •2)Положения
- •3)Взаємного положення в кільці
- •1. Геометрична :
- •2. Оптична (дзеркальна)
- •3. Поворотна ізомерія ( конформація)
- •4. Динамічна ізомерія
- •4. Загальна характеристика хімічних реакцій біоорганічних сполук.
- •5. Характеристика нуклеофілів та електрофілів.
- •6. Багатоатомні спирти. Будова, номенклатура та ізомерія фенолів, амінів.
- •1. Радикальні заміщення біля насиченого атома Карбону (sr).
- •2. Електрофільне приєднання до ненасичених сполук (ae).
- •3. Електрофільне заміщення в ароматичних сполуках (se).
- •4. Вплив замісників на реакційну здатність аренів.
- •5. Вуглеводні . Алкани, алкени, арени .
- •6. Багатоатомні спирти. Будова, номенклатура та ізомерія фенолів, амінів. ( спрс ).
- •1.Феноли.
- •1.Реакції нуклеофільного приєднання (an) до оксосполук.
- •2.Вплив нуклеофілу на утворення з альдегідами і кетонами нових зв'язків: c-о, с-с, с- н, с- n.
- •3.Альдольна конденсація та її значення для подовження карбонового ланцюга.
- •4.Окиснення альдегідів і кетонів.
- •5. Медико-біологічне значення альдегідів і кетонів. ( спрс).
- •1.Класифікація карбонових кислот, окремі представники монокарбонових кислот.
- •2. Реакції нуклеофільного заміщення (sn) біля sp2- гібридизованого
- •3. Вищі жирні кислоти (вжк) як складові нейтральних ліпідів. Будова
- •5. Функціональні похідні карбонових кислот. ( спрс)
- •1. Хімічні властивості та біологічне значення гідрокси- та амінокислот.
- •1. Класифікація гідроксикислот:
- •2. Біологічне значення кетокислот та їх похідних. Кетонові тіла, діагностичне значення, їх визначення при цукровому діабеті.
- •3. Фенолокислоти та їх похідні. Використання саліцилової кислоти та її похідних у медицині (метилсаліцилат, салол, аспірин, саліцилати натрію) у вигляді лікарських засобів.
- •1. Класифікація амінокислот за будовою карбонового ланцюга, здатністю до синтезу в організмі та полярністю радикала.
- •2. Хімічні властивості а-амінокислот. Реакції поліконденсації з утворенням пептидів. Якісні реакції на α-амінокислоти, пептиди, білки.
- •1. Аліфатичні сполуки зі змішаними функціями
- •1. Класифікація вуглеводів. Таутомерні форми моносахаридів.
- •2. Утворення глікозидів, їхня роль у побудові оліго- та полісахаридів, нуклеозидів. Нуклеотидів та нуклеїнових кислот. Аскорбінова кислота як похідне гексоз, біологічна роль вітаміну с.
- •3. Класифікація дисахаридів за здатністю до окисно-відновних реакцій. Два типи зв'язків між залишками моносахаридів та їх вплив на реакційну здатність дисахаридів.
- •4. Будова, біологічна роль та застосування крохмалю, його складові.
- •5. Структура вуглеводів. (спрс).
- •1. Класифікація гетероциклів за розмірами циклу, кількістю та
- •2. Пятичленні гетероцикли з одним та двома гетероатомами та їхні
- •3. Бензпірол (індол) як складова триптофану та продуктів його перетворення — біологічно активних сполук (триптамін, серотонін) та токсичних речовин (скатол, індол) і продукти їхньою знешкодження.
- •4 Шестичленні гетероцикли з одним та двома гетероатомами -основа
- •5. Лікарські засоби на основі гетероциклічних сполук.( спрс).
- •1. П’ятічленні гетероциклічні сполуки з одним гетероатомом.
- •2. П’ятічленні гетероциклічні сполуки з двома гетероатомами.
- •3. Шестичленні гетероцикли з двома гетероатомами.
- •1. Нуклеозиди та нуклеотиди — продукти неповного гідролізу нуклеїнових кислот. ( спрс)
- •2. Нуклеїнові кислоти — полінуклеотиди, біополімери, що зберігають, передають спадкову інформацію та беруть участь у біосинтезі білка.
- •3. Вільні нуклеотидів (коферменти)— амф, адф, атф, над . Н. Будова та значення 3’,5'-ц-амф, його роль у дії гормонів на клітини.
2. Утворення глікозидів, їхня роль у побудові оліго- та полісахаридів, нуклеозидів. Нуклеотидів та нуклеїнових кислот. Аскорбінова кислота як похідне гексоз, біологічна роль вітаміну с.
Реакції за участю циклічних форм. При взаємодії моносахаридів зі спиртами, фенолами за наявності кислотного каталізатора утворюють глікозиди. В назві їх суфікс -оза замінюється на -озид. Невуглеводну частину молекули глікозиду називають агліконом, а хімічний зв'язок між аномерним атомом Карбону моносахариду і агліконом дістав назву глікозидного зв'язку. В природі вони переважно зустрічаються як β—глікозиди.
Як аглікони виступають гідроксилвмісні сполуки (стероїди, моносахариди) утворюючи глікозидний зв'язок через атом Оксигену, так звані О-глікозиди.
У N -глікозидах агліконами є залишки аліфатичних, ароматичних, гетероциклічних амінів, і зв'язок здійснюється через атом Нітрогену (нуклеотиди, нуклеозиди, АТФ, НАД+ та інші).
В S - глікозидах агліконами є тіоли, і зв'язок аглікону з моносахаридом здійснюється через атом Сульфуру (синігрин, при гідролізі якого утворюється гірчичне масло).
При дії спирту у присутності хлороводню(газ) на моносахариди утворюються глікозиди, яки легко гідролізуються у кислому середовищі з утворенням суміші ос-, (3-аномерів відповідного моносахариду.

Аміноцукри - моносахариди, у молекулах яких одна або декілька гідроксильних груп заміщені аміногрупою. D - галактозамін є структурним фрагментом хондраїтинсульфатів; D-глактозамін є структурним компонентом глікопротеїдів і полісахаридів.
Вони вступають в реакції, характерні для аміногрупи і моносахаридів.

Представником є нейрамінова кислота, яка трапляється у вигляді N - і О - ацильованих похідних, об'єднаних під назвою сіалові кислоти. Сіалові кислоти є структурними компонентами речовин крові, тканин, гангліозидів мозку, глікопротеїдів.
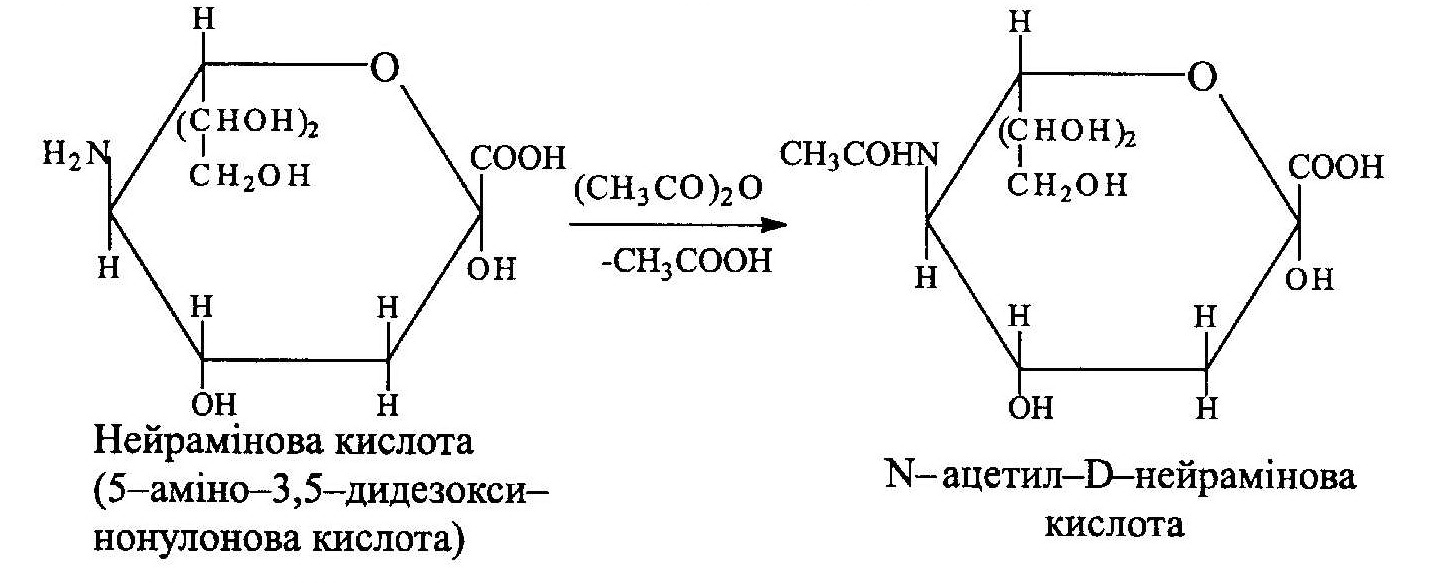
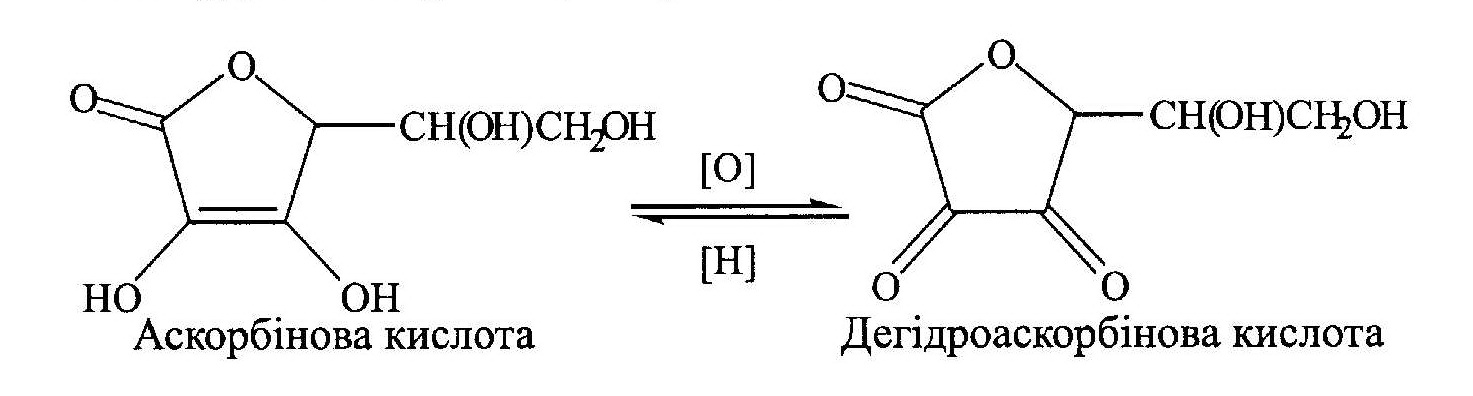
γ -Лактон 2,3-дегідро-L-гулонової кислоти відомий під назвою аскорбінової кислоти (вітамін С). Нестача вітаміну С в організмі викликає захворювання на цингу і зменшує опірність організму до інфекційних захворювань. За рахунок окисно-відновних процесів вітаміну С в організмі відбувається, наприклад, окиснення а-амінокислоти проліну. Потреба у вітаміні С для людини складає 50— 70 мг на добу. Засвоєний промисловий синтез вітаміну С виходячи з В-глюкози. Аскорбінова кислота є консервантом при консервуванні фруктів і виробництві сухого молока.
3. Класифікація дисахаридів за здатністю до окисно-відновних реакцій. Два типи зв'язків між залишками моносахаридів та їх вплив на реакційну здатність дисахаридів.
Дицукриди — вуглеводи, молекула яких утворена з двох молекул моноцукридів:
С6Н12О6 + С6Н12О6 → С12Н22О11 + Н2О.
Дицукриди (біози) — найпростіші олігоцукриди. Вони дуже поширені в природі, містяться в овочах, плодах і фруктах. Усі Дицукриди — кристалічні речовини, добре розчиняються у воді з утворенням справжніх розчинів, солодкі на смак, оптично активні (в розчинах).
Розрізняють дицукриди мальтозного (мальтоза, лактоза, целобіоза, гентіобіоза, мелібіоза, тураноза) і трегалозного (трегалоза і цукроза) типів зв'язку.
При мальтозному типі зв'язку молекула дицукриду утворюється з двох молекул моноцукридів через оксигеновий місток від глікозидного гідроксилу одного моноцукриду і звичайного (частіше розміщеного біля четвертого атома карбону) гідроксилу другого моноцукриду:
Н \ ⁄⁄ О Н \ ⁄ ОН
С - ------------- С ---------------
| | | |
Н - С - ОН | Н - С - ОН |
| | | |
НО - С - Н О НО - С - Н О
| | + | |
Н - С - ОН | Н - С - ОН |
| | | |
Н - С - ------------ Н - С --------------
| |
СН2ОН СН2ОН
D-глюкопираноза ( α(D +) глюказа)
( α(D +) глюказа)
Н \ ⁄-------------------- Н \ ⁄ ОН
С -------------- | С -------------
| | | | |
Н - С - ОН | | Н - С - ОН |
| | О | |
НО - С - Н | | НО - С - Н О + Н2О
| О \ | |
Н - С - ОН | \--------------- С - Н |
| | | |
Н - С - ------------ Н - С ------------
| |
СН2ОН СН2ОН
МАЛЬТОЗА
Усі дицукриди, побудовані за мальтозним типом зв'язку, зберігають глюкозидний (глікозидний) гідроксил, який може при таутомерії перетворюватися на альдегідну групу і вступати у відновні реакції (відновлювати рідину Фелінга, давати реакцію Троммера, відновлювати срібло у реакції «срібного дзеркала»), і називаються відновними дицукридами. Прикладом може бути мальтоза, яка залежно від умов середовища (кислого чи лужного) існує у вигляді двох таутомерних форм — ациклічної і циклічної.
У другому випадку при утворенні молекули дицукриду відщеплення молекули води відбувається за рахунок двох напівацетальних гідроксилів двох молекул моїюцукридів. Ці дицукриди відносять до трегалозного типу зв'язку, або до невідновних дицукридів. Дицукриди, побудовані за трегалоз-ним типом зв'язку, не здатні мати карбонільну групу, вони не приєднують ціанідну кислоту, не утворюють гідразопи, не мутаротують. Залишки молекул моноцукридів, що формують молекулу дицукриду, мають стабільну циклічну форму і не мають таутомерних форм:
Н \ ⁄ О Н Н \ ⁄ ОН
С -------------- С --------------
| | | |
Н - С - ОН | Н - С - ОН |
| | | |
НО - С - Н О НО - С - Н О
| | + | |
Н - С - ОН | Н - С - ОН |
| | | |
Н - С -------------- Н - С -------------
| |
СН2ОН СН2ОН
D-глюкопираноза ( α(D +) глюказа)
( α(D +) глюказа)
Н \ ⁄ Н
С ---------------О--------------------- С -----------
| \-------------- | |
Н - С - ОН | Н - С - ОН |
| | | |
НО - С - Н | НО - С - Н | + Н2О
| О | О
Н - С - ОН | Н - С - ОН |
| | | |
Н - С -------------- Н - С -----------
| |
СН2ОН СН2ОН
ТРЕГАЛОЗА
