
- •Часть I: общая иммунология;
- •Часть II: 40
- •Часть I: общая иммунология
- •Лекция №1
- •Предмет и задачи иммунологии.
- •Структура и функции иммунной системы.
- •1796 – 1900 – Инфекционная иммунология.
- •1900 – 1950 – Нормальная.
- •1950 - … - Современный этап.
- •Строение иммунной системы.
- •Фильтрация лимфы и удаление из неё чужеродных аг.
- •Иммуногенез при первичном и вторичном иммунном ответе.
- •Перераспределение икк между лимфой и кровью.
- •Лекция №2. Антигены и антитела.
- •Антигены по принципу генетической чужеродности.
- •Э питопы
- •Особенность строении Ig.
- •Ig состоит из:
- •Лекция №3
- •Эффекторная функция;
- •Иммунорегуляторная функция;
- •Регуляторные
- •Эффекторные
- •Онтогенез т-лимфоцитов костный мозг
- •Реакция торможения миграции лейкоцитов (ртмл)
- •Методика исследования.
- •Лекция №4
- •Субпопуляции в-лимфоцитов
- •Количественные.
- •Функциональные
- •Лекция №5 Аг представляющие и фагоцитирующие клетки.
- •II. Функциональные тесты.
- •Функциональное состояние системы фагоцитирующих клеток. Фагоцитарная активность нейтрофилов
- •Методика определения фагоцитарной активности нейтрофилов (визуальный способ).
- •Методика исследования.
- •Приготовление раствора:
- •Лекция №6 Гормоны и медиаторы иммунной системы.
- •Лекция №7 Иммунный ответ.
- •Лекция №8 Цитотоксические реакции иммунитета (цри).
- •А нтигенспецифические
- •Специфическое связывание цтл с мишенью
- •Киллерная клетка.
- •Клетка мишень.
- •Лекция №9
- •Лекция №11 Иммунология репродукции.
- •Лекция №12 Иммунологические аспекты трансплантации. (трансплантационная иммунология).
- •Лекция №13 Противоопухолевый иммунитет. Причины развития онкологических заболеваний и принципы их лечения.
- •Лекция №14 Иммунологические аспекты переливания крови.
- •Антиэритроцитарные ат Есть
- •П ри несовместимости
- •Лекция №15 Иммунный статус человека.
- •Уровень (ориентировочные):
- •Лекция №16 Первичные иммунодефициты.
- •Лекция №17 Вторичные иммунодефициты.
- •Системные (сид);
- •Местные (мид);
- •Лекция №18 Противоинфекционный иммунитет (пим).
Онтогенез т-лимфоцитов костный мозг
П СК
СК
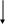 HLA-DR+
обеспечивают
специфичность проникновения клеток в
тимус и их дальнейшее выживание
HLA-DR+
обеспечивают
специфичность проникновения клеток в
тимус и их дальнейшее выживание
Л СК
HLA-DR+,
CD38+
маркер стадии
синтеза повышаются в крови у больных с
лейкозами
СК
HLA-DR+,
CD38+
маркер стадии
синтеза повышаются в крови у больных с
лейкозами
 TdT+
терминальная
дезоксинуклеотедилтрансфераза –
исчезает с поверхности клеток по мере
её созревания. Необходим для встраивания
дополнительных нуклеотидных
последовательностей в ДНК клетки, что
увеличивает структурное разнообразие
рецепторов.
TdT+
терминальная
дезоксинуклеотедилтрансфераза –
исчезает с поверхности клеток по мере
её созревания. Необходим для встраивания
дополнительных нуклеотидных
последовательностей в ДНК клетки, что
увеличивает структурное разнообразие
рецепторов.
------------------------------------------------------------------
ТИМУС
 субкортикальная
зона
субкортикальная
зона
 первоначально
взаимодействуют с дендритными клетками
и макрофагами, а потом в субэпителиальном
слое взаимодействуют с эпителиальными
клетками няньками. Начинается активная
пролиферация Т-лимфоцитов.
первоначально
взаимодействуют с дендритными клетками
и макрофагами, а потом в субэпителиальном
слое взаимодействуют с эпителиальными
клетками няньками. Начинается активная
пролиферация Т-лимфоцитов.
CD2+ адгезивный (с эритроцитами барана образует розетки).
CD5+, CD7+ ранние маркеры Т-лимфоцитов, сохраняются постоянно.
- -----------------------------------------------------------------
-----------------------------------------------------------------
кортикальная зона
CD1+ кортикальный рецептор.
 Появляются
дубль положительные клетки CD4+/CD8+
Появляются
дубль положительные клетки CD4+/CD8+
CD3+ постоянный рецептор лимфоцитов. Входит в состав АГ распознающего комплекса и обеспечивает передачу от АГ - сигнала от TCR+ в цитоплазму.
TCR рецептор имеет Ig имеет α и β цепи. V – вариабельные и С – константные домены. Внутри мембранный и цитоплазматический участки.
- -----------------------------------------------------------------
медуллярная зона
CD4+CD8- CD8+CD4-




CD2+, CD3+, TCR+, CD5+, CD6+,
CD7+, CD28+ (CD4+; 50% CD8+),
Fc Ig
CD45 RA+ – Tх0; CD45 RO+ - клетка памяти.
CD25+, CD38+, CD71+, CD95+, HLA-DR+ - маркеры активированных Т-лимфоцитов
CD 28 – у всех CD 4+ у 50% CD 8+ - предохраняет от апоптоза.
Маркеры активации экспрессируют при встрече с митогеном:
CD 25+ - рецептор к ИЛ –2
CD 71+ - рецептор к трансферину
CD 95+ - рецептор индукторного фактора апоптоза – свидетельствует о готовности клетки к апоптозу.
Когда Т-лимфоциты выходят на периферию, то они занимают Т-зоны.
Селекция Т-лимфоцитов
– происходит на границе между кортикальной и медулярным слоем.
образование дубль положительных клеток, перестраивание генов TCR.
отбор клонов клеток способных распознавать молекулу ГКГС I или II класса (остальные клетки гибнут путём апоптоза).
клетки, распознавшие ГКГС I, теряют CD 4 и сохраняют CD 8, иначе те, что распознают ГКГС II,теряют CD 8 и сохраняют CD 4 (положительная селекция).
отрицательная селекция: из популяции лимфоцитов (тимоцитов) через процесс апоптоза удаляются клетки способные реагировать с аутоантигеном.
оставшиеся от исходной популяции 2-5% покидают тимус и занимают периферические органы и ткани.
На периферии способен реагировать с АГ 1 из 10.000 Т-лимфоцитов (наивных).
Методы идентификации Т-лимфоцитов.
Функциональные и количественные тесты.
Для определения количества Т-лимфоцитов используются несколько методов:
метод розеткообразования с эритроцитами барана – устарел.
с применением моноклональных АТ.
иммунофлюоресценция в т.ч. проточная.
цитофлюоресценция.
ИФА.
Т-лимфоциты |
CD 3 (маркер) |
800 - 2200 в 1 мм3 |
60 – 80% |
Т-хелперы |
CD 4 (маркер) |
500 – 1200 в 1 мм3 |
30 –50% |
ЦТЛ / Т-супрессоры |
CD 8 (маркер) |
300 – 600 в 1 мм3 |
20 –25% |
В-лимфоциты |
CD 19 (маркер) |
150 – 600 в 1 мм3 |
10 –23% |
Моноциты / Макрофаги |
CD 14 (маркер) |
80 – 200 в 1 мм3 |
6 –13% |
NK клетки |
CD 16 (маркер) |
100 - 600 в 1 мм3 |
8 – 22% |
Функциональные тесты.
Важны т.к. не всегда снижение количества свидетельствует об их функциональной недостаточности и наоборот.
1.РЕАКЦИЯ БЛАСТТРАНСФОРМАЦИИ ЛИМФОЦИТОВ (РБТЛ).
В асептических условиях из вены берется 5 – 10 мл крови в пробирку, содержащую 100 – 200 ЕД. гепарина. Содержимое пробирки осторожно перемешивают и оставляют на 60 мин. в термостате при t 37°С для осаждения эритроцитов, которое может быть ускорено добавлением декстрана, желатина и др. После инкубации в термостате надосадочный спой плазмы, обогащенный лейкоцитами, отсасывают в отдельную стерильную пробирку. Определяют число лейкоцитов в 1 мл. Затем взвесь лейкоцитов разводят питательной средой 199 (содержащей 200 ЕД. пенициллина и 100 ЕД. стрептомицина в 1 мл) таким образом, чтобы в 1 мл содержалось 1.000.000 – 2.000.000 лейкоцитов, 20% аутологичной плазмы и 80% культуральной среды.
Приготовленную лейкоцитарную взвесь разливают в стерильные флаконы по 1 мл, добавляют 0,1 мл предварительно оттитрованного аллергена и пропускают газовую смесь, содержащую 5% углекислого газа. Флаконы закрывают пробками и помещают в термостат при t 37°С на 5 – 7 дней. За это время культура лейкоцитов периферической крови освобождается от сегментоядерных лейкоцитов, исключая эозинофилы, и содержит преимущественно одноядерные клетки, которые идентифицируются как малые, средние и большие ЛФ, бласты, ретикулярные клетки и макрофаги.
Интенсивность РБТЛ оценивается различными методами.
Морфологический метод заключается в подсчете в окрашенном мазке активированных клеток-бластов на 1000 клеток и определении их процентного содержания. Реакция расценивается как положительная, если число активированных клеток составляет не менее 4% от общего числа культивируемых клеток; максимальное число активированных клеток при действии специфического аллергена может достигать 35%.
Изотопный метод позволяет определить общую активность культур лимфоцитов путем подсчета, включенного в клетки, синтезирующие ДНК, меченного ЗН-тимидина, добавляемого в культуральную среду.
Достоверность РБТЛ проверяется контрольными исследованиями с культурой исследуемых ЛФ без добавления аллергена (для выявления спонтанной Б.л.) и с культурой ЛФ здоровых доноров, инкубируемой с соответствующим аллергеном.
2.
