
- •Экзаменационный билет № 1
- •1. Собственная масса m0. Соответствующую массу будем определять как константу, входящую в релятивистское соотношение
- •5.Время жизни частицы - средняя продолжительность существования нестабильных элементарных частиц. Согласно теории относительности
- •Проблема построения единой теории сильного, слабого и электромагнитного взаимодействий (модели Великого объединения)
- •Экзаменационный билет № 2
- •Существуют 4 типа взаимодействия:
- •Экзаменационный билет № 3
- •38. Ядерные взаимодействия и ядерные реакции. Общие закономерности и различные механизмы ядерных реакций. Особенности протекания ядерных реакций под действием различных частиц.
- •Экзаменационный билет № 4
- •37.Радиоактивность и закономерности радиоактивного распада; процессы сопровождающие радиоактивный распад и их физическая интерпретация.
- •Экзаменационный билет № 5
- •Экзаменационный билет № 6
- •6. Механика жидкости и газа. Основные уравнения равновесия и движения жидкостей. Гидростатика несжимаемой жидкости. Барометрическая формула.
- •35.Элементы зонной теории твердых тел. Обобществление электронов в кристалле, энергетический спектр электронов в кристалле, металлы, диэлектрики и полупроводники с точки зрения зонной модели.
- •Экзаменационный билет № 7
- •Экзаменационный билет № 8
- •2 Волновая функция и ее свойства. Уравнения Шредингера для стационарных состояний. Принцип причинности в квантовой механике
- •Экзаменационный билет № 9
- •Экзаменационный билет № 10
- •Экзаменационный билет № 11
- •Экзаменационный билет № 12
- •Экзаменационный билет № 13
- •Экзаменационный билет № 14
- •Общие условия равновесия и устойчивости
- •Равновесие гомогенной системы
- •Экзаменационный билет № 15
- •Экзаменационный билет № 16
Экзаменационный билет № 15
1. Электрическое поле в диэлектрической среде. Поляризация диэлектриков. Теорема Остроградского-Гаусса для электрического поля в среде. Условия для электростатического поля на границе раздела двух изотропных диэлектрических сред.
2. Основные законы и методы термодинамики. Три начала термодинамики. Энтропия и термодинамическая температура. Метод круговых процессов, метод термодинамических потенциалов. Термодинамические потенциалы сложных систем и систем с переменным числом частиц.
1. Электрическое поле в диэлектрической среде. Поляризация диэлектриков. Теорема Остроградского-Гаусса для электрического поля в среде. Условия для электростатического поля на границе раздела двух изотропных диэлектрических сред.
Диэлектрики- тела без свободных эл. зарядов.
Полярные диэлектрики – появление заряда противоположного знака на противоположных поверхностях диэлектрика под действием внешнего эл. поля.
Типы диэлектриков:
-полярные(H2O);
-неполярные(H2).
определяются структурой атома или молекулы
Существуют три вида поляризации:
- электрическая поляризация смещением (для непол. молекул)
P=β* ε0*E, β-поляризуемость молекулы, Р-дип. момент.
- ориентационная (дипольная) поляризация (для поляр. молекул)
- поляризация ионного смещения(для твердых диэлектриков)
P=χ* ε0*E,дип. момент единицы объёма. χ-диэлектр. восприимчивость.
P=β* ε0*E,дип. момент одного атома.
Диэлектрическая проницаемость среды – отношение силы взаимодействия в вакууме(F0) к силе взаимодействия в диэлектрической среде(F).ε=F/ F0.
ε показывает во сколько раз данная среда ослабляет силу взаимодействия между зарядами или эл. поле.
Теорема Остроградского - Гаусса для эл. поля в среде : поток вектора Эл. смещения через произв.замкнутую поверхность равен суммарному свободному заряду, заключенному внутри этой поверхности.
∫DndS=∫ρ*dV.
Выражение D= (ε0* E+P), называется ЭЛЕКТРИЧЕСКИМ СМЕЩЕНИЕМ.
Поле на границе двух диэлектриков.
Два диэлектрика поляризованы однородно. Диэлектрики могут быть поляризованы только если они помещены в эл.поле. На границе раздела возникает поляриз. заряд.
_ _ _ _ _ _ _ _ _ _ ↑ En1_ _ _ _ _ _ _ _ _ |
+ + + + + + + + + ↓ En2+ + + + + + + + ↑ En → Eτ |
2. Основные законы и методы термодинамики. Три начала термодинамики. Энтропия и термодинамическая температура. Метод круговых процессов, метод термодинамических потенциалов. Термодинамические потенциалы сложных систем и систем с переменным числом частиц.
Первый постулат. У изолированной системы существует состояние термодинамического равновесия, в которые она приходит с течением времени и выйти из которого сама не может. Второй. Все равновесные внутренние параметры системы (величины, определяющиеся совокупным движением и распределением в пространстве входящих в систему частиц: р, Е) являются функциями внешних параметров (величины, входящие в систему: V) и температуры.
Первое начало ТД. Выражает закон сохранения и превращения энергии. Внутренняя энергия системы является однозначной функцией её состояния и изменяется только под влиянием внешних воздействий. Другая формулировка: невозможен вечный двигатель первого рода (совершающий работу, не заимствуя энергию извне).
Второе начало. Невозможен вечный двигатель второго рода (устройство, полностью превращающее теплоту в работу).
Третье начало. По мере приближения температуры к нулю, энтропия всякой равновесной системы при изотермических процессах перестает зависеть от каких-либо термодинамических параметров состояния и в пределе при температуре, стремящейся к 0К, принимает одну и ту же для всех систем постоянную величину, которую можно принять равной нулю.
Методы
термодинамики. Метод
циклов:
 (первое
начало)
(первое
начало)

Метод
термодинамических потенциалов: ,
где Аi
и ai
– сопряжённые обобщённые термодинамические
сила и параметр (p
и V).
,
где Аi
и ai
– сопряжённые обобщённые термодинамические
сила и параметр (p
и V).
Термодинамические потенциалы: U(S,V), F(T,V) = U - TS, G(T, p) = U – TS + pV, H(S,p) = U + pV. Зная хотя бы одну характеристическую функцию, можно вычислить параметры всей системы. Первые производные характеристических функций дают параметры системы. Через вторые производные можно выразить калорические свойства системы, т. е. теплоёмкость.
Термодинамические
потенциалы систем с постоянным числом
частиц. Для
открытой системы с учётом химического
превращения частиц: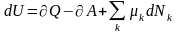 ,
где
,
где
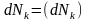 внутр.
+
внутр.
+
 обмен
с вн. средой,
обмен
с вн. средой,
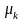 - химический потенциал k-ой
частицы. При равновесных химических
процессах
- химический потенциал k-ой
частицы. При равновесных химических
процессах
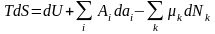 - основное уравнение термодинамики для
систем с постоянным числом частиц.
- основное уравнение термодинамики для
систем с постоянным числом частиц.
 - это химический потенциал, значение
энергии Гиббса на одну частицу. Он не
зависит от числа частиц, зависит только
от T и p. Если в системе смесь веществ, то
- это химический потенциал, значение
энергии Гиббса на одну частицу. Он не
зависит от числа частиц, зависит только
от T и p. Если в системе смесь веществ, то
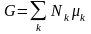 .
.
