
- •Экзаменационный билет № 1
- •1. Собственная масса m0. Соответствующую массу будем определять как константу, входящую в релятивистское соотношение
- •5.Время жизни частицы - средняя продолжительность существования нестабильных элементарных частиц. Согласно теории относительности
- •Проблема построения единой теории сильного, слабого и электромагнитного взаимодействий (модели Великого объединения)
- •Экзаменационный билет № 2
- •Существуют 4 типа взаимодействия:
- •Экзаменационный билет № 3
- •38. Ядерные взаимодействия и ядерные реакции. Общие закономерности и различные механизмы ядерных реакций. Особенности протекания ядерных реакций под действием различных частиц.
- •Экзаменационный билет № 4
- •37.Радиоактивность и закономерности радиоактивного распада; процессы сопровождающие радиоактивный распад и их физическая интерпретация.
- •Экзаменационный билет № 5
- •Экзаменационный билет № 6
- •6. Механика жидкости и газа. Основные уравнения равновесия и движения жидкостей. Гидростатика несжимаемой жидкости. Барометрическая формула.
- •35.Элементы зонной теории твердых тел. Обобществление электронов в кристалле, энергетический спектр электронов в кристалле, металлы, диэлектрики и полупроводники с точки зрения зонной модели.
- •Экзаменационный билет № 7
- •Экзаменационный билет № 8
- •2 Волновая функция и ее свойства. Уравнения Шредингера для стационарных состояний. Принцип причинности в квантовой механике
- •Экзаменационный билет № 9
- •Экзаменационный билет № 10
- •Экзаменационный билет № 11
- •Экзаменационный билет № 12
- •Экзаменационный билет № 13
- •Экзаменационный билет № 14
- •Общие условия равновесия и устойчивости
- •Равновесие гомогенной системы
- •Экзаменационный билет № 15
- •Экзаменационный билет № 16
Экзаменационный билет № 12
1. Реальные газы. Силы Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и Эндрюса. Метастабильные состояния: пересыщенный пар и перегретая жидкость. Критическое состояние, критические параметры. Равновесие жидкости и насыщенного пара. Уравнение Клапейрона-Клаузиуса. Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
2. Микроканоническое и каноническое распределения Гиббса. Статистический интеграл системы. Энтропия. Большое каноническое распределение (классический и квантовый случай). Термодинамическая эквивалентность канонических распределений.
1 . Реальные газы. Силы Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и Эндрюса. Метастабильные состояния: пересыщенный пар и перегретая жидкость. Критическое состояние, критические параметры. Равновесие жидкости и насыщенного пара. Уравнение Клапейрона-Клаузиуса. Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона-Менделеева (pV=RT) не пригодны. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
Собственный объем молекул. Силы отталкивания противодействующие проникновению в занятый молекулой объем других молекул, сводится х тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, a Vm-b , где b — объем, занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул
Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого — внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е. Р' = а/Vm2 ,где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя эти поправки, получим уравнение Вав-дер-Ваальса для моля газа (уравнение состояния реальных газов): (Р+ а/Vm2 ) (Vm-b) = RT. Для произвольного количества вещества газа уравнение Ван-дер-Ваальса примет вид (Р+ 2а/V2 ) (V-b) = RT, где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем.
Изотермы
Ван-дер-Ваальса и их анализ. Для
исследования поведения реального газа
рассмотрим изотермы Ван-дер-Ваальса. 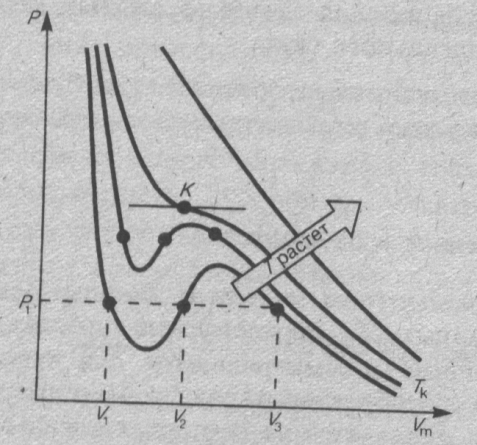
При высоких температурах (Т > Ткр) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Ткр на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Ткр — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем и давление называются также критическими. Состояние с критическими параметрами называется критическим состоянием. При низких температурах (Т < Ткр) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Р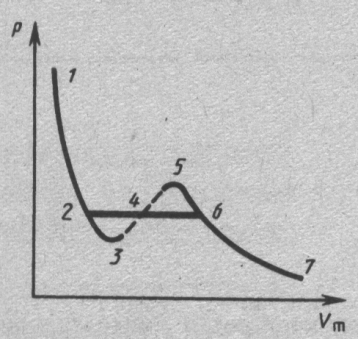 ассматривая
различные участки изотермы при Т<Ткр,
видим, что на участке 3—5 сжатие вещества
приводит к уменьшению давления; практика
же показывает, что такие состояния в
природе не осуществляются. Наличие
участка 3—5 означает, что при постепенном
изменении объема вещество не может
оставаться все время в виде однородной
среды; в некоторый момент должно наступить
скачкообразное изменение состояния
и распад вещества на две фазы. Таким
образом, истинная изотерма будет иметь
вид ломаной линии 7—6—2—I (изотерма
Эндрюса).
Часть 6—7 отвечает газообразному
состоянию, а часть 2—/ — жидкому. В
состояниях, соответствующих горизонтальному
участку изотермы б—2, наблюдается
равновесие жидкой и газообразной фаз
вещества. Вещество в газообразном
состоянии при температуре ниже критической
называется паром,
а пар, находящийся в равновесии со своей
жидкостью, называется насыщенным.
ассматривая
различные участки изотермы при Т<Ткр,
видим, что на участке 3—5 сжатие вещества
приводит к уменьшению давления; практика
же показывает, что такие состояния в
природе не осуществляются. Наличие
участка 3—5 означает, что при постепенном
изменении объема вещество не может
оставаться все время в виде однородной
среды; в некоторый момент должно наступить
скачкообразное изменение состояния
и распад вещества на две фазы. Таким
образом, истинная изотерма будет иметь
вид ломаной линии 7—6—2—I (изотерма
Эндрюса).
Часть 6—7 отвечает газообразному
состоянию, а часть 2—/ — жидкому. В
состояниях, соответствующих горизонтальному
участку изотермы б—2, наблюдается
равновесие жидкой и газообразной фаз
вещества. Вещество в газообразном
состоянии при температуре ниже критической
называется паром,
а пар, находящийся в равновесии со своей
жидкостью, называется насыщенным.
Д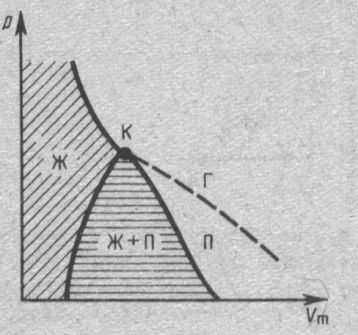
 ля
нахождения критических параметров
подставим их значения в уравнение
Ван-дер-Ваальса : ркр
V3
–(RTкр+pкрb)V2+aV-ab=0
Поскольку в критической точке все три
корня совпадают и равны , уравнение
приводится к виду ркр(V-Vкр)3=0
В этих уравнениях должны быть равны и
коэффициенты при неизвестных
соответствующих степеней. Поэтому можно
записать три уравнения, решая полученные
уравнения, найдем
ля
нахождения критических параметров
подставим их значения в уравнение
Ван-дер-Ваальса : ркр
V3
–(RTкр+pкрb)V2+aV-ab=0
Поскольку в критической точке все три
корня совпадают и равны , уравнение
приводится к виду ркр(V-Vкр)3=0
В этих уравнениях должны быть равны и
коэффициенты при неизвестных
соответствующих степеней. Поэтому можно
записать три уравнения, решая полученные
уравнения, найдем
Vкр=3b, pкр=а/(27b2) , Tкр=8a/(27Rb)
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму р, Vm под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
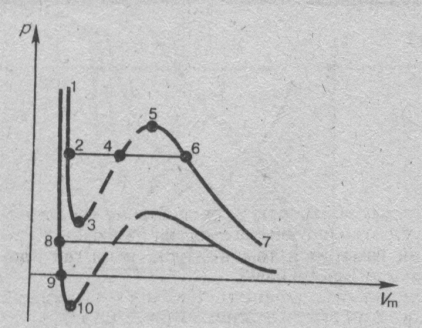
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. справа), видим, что последняя имеет прямолинейный участок 2—б, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками Ван-дер-Ваальсовой изотермы 5—6. и 2—3. Эти неустойчивые состояния называются метастабильными. Участок 2—3 изображает перегретую жидкость, 5—6 — пересыщенньн пар. Обе фазы ограниченно устойчивы.
При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9—10 — растянутой жидкости.
Д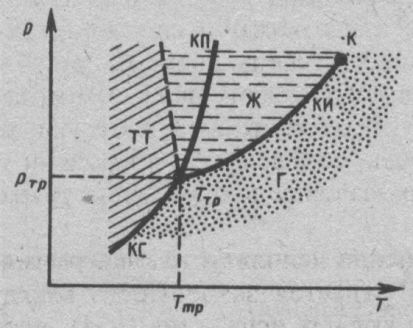 ля
наглядности фазовых превращений
используется диаграмма состояний, где
КИ, КП, КС-кривые испарения, плавления,
сублимации; ТТ –твердое тело.
ля
наглядности фазовых превращений
используется диаграмма состояний, где
КИ, КП, КС-кривые испарения, плавления,
сублимации; ТТ –твердое тело.
Термодинамика дает метод расчета равновесия двух фаз – уравнение Клапейрона-Клаузиуса: dр/dT=L/(T(V2-V1)), где L-теплота фазового перехода, (V2-V1)-изменение объема вещества при переходе. Оно позволяет определить наклоны кривых равновесия.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул (определяет внутреннюю энергию идеального газа, равную СvТ) и потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, как известно из механики, идет на увеличение потенциальной энергии системы, т. е. A=p'dV=П, или П =-(а/V2)dV Знак минус означает, что молекулярные силы, создающие внутреннее давление р', являются силами притяжения . Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа U= СvТ –a/V растет с повышением температуры и увеличением объема. Можно доказать, что при адиабатическом расширении без совершения внешней работы внутренняя энергия не меняется (1 начало термодинамики.), но температура уменьшается, так как совершается работа против сил притяжения.
Эффект Джоуля-Томсона – адиабатическое расширение реального газа с совершением внешими силами положительной работы. Из 1 начало термодинамики U+pV=const.- неизменная величина (энтальпия), подставив в неё всё приведенное выше получим: Т2-Т1=(2а(1/V2-1/V1)-b(p2-p1) -ab(1/V22-1/V12)) /(Cv+R), то есть знак разности температур зависит от величины поправок (при а=0 без сил притяжения, газ нагревается; при b=0 - охлаждается) и от значений начальных объема и температуры. Эффект Джоуля-Ленца положительный – при охлаждении, отрицательный – при нагревании. Температура, при которой происходит изменение знака эффекта – температура инверсии. Т=(2a/Rb)(1-b/V), - кривая инверсии. (ниже кривой положительный эффект).
2. . Микроканоническое и каноническое распределения Гиббса. Статистический интеграл системы. Энтропия. Большое каноническое распределение (классический и квантовый случай). Термодинамическая эквивалентность канонических распределений.
Рассмотрим многочастичную термодинамически равновесную систему. Основная идея статфизики состоит в замене среднего по времени (b(q, р)); функции b(q, p)
данной системы
средним значением b(q,
p)
этой функции по ансамблю определенным
образом распределенных систем
![]() где фазовая плотность распределения
p(q,
p)
для равновесных систем, очевидно, не
зависит от времени и удовлетворяет
условию нормировки
где фазовая плотность распределения
p(q,
p)
для равновесных систем, очевидно, не
зависит от времени и удовлетворяет
условию нормировки
![]() Задача состоит в том, чтобы найти p(q,
p),
удовлетворяющую равенству
Задача состоит в том, чтобы найти p(q,
p),
удовлетворяющую равенству
![]() Для этого обратимся прежде всего к
основному уравнению статистической
физики классических систем — уравнению
Лнувилля. Из него получаем
Для этого обратимся прежде всего к
основному уравнению статистической
физики классических систем — уравнению
Лнувилля. Из него получаем
![]() откуда следует, что равновесная функция
распределения p(q,
p)
является интегралом движения уравнений
Гамильтона или функцией интегралов
движения:
откуда следует, что равновесная функция
распределения p(q,
p)
является интегралом движения уравнений
Гамильтона или функцией интегралов
движения:
![]() В соответствии с введенным Гиббсом
(отвечающим термодинамике) статистическим
определением энтропии (см. ниже) функция
p(q,
p)
зависит лишь от однозначных аддитивных
интегралов движения. Известны три
таких интеграла движения: энергия Н,
импульс Р и момент импульса М. Поэтому
В соответствии с введенным Гиббсом
(отвечающим термодинамике) статистическим
определением энтропии (см. ниже) функция
p(q,
p)
зависит лишь от однозначных аддитивных
интегралов движения. Известны три
таких интеграла движения: энергия Н,
импульс Р и момент импульса М. Поэтому
![]() Для равновесной системы частиц в
неподвижном сосуде импульс Р и момент
импульса М равны нулю. Поэтому в этом
случае для систем с заданным числом
частиц фазовая плотность распределения
зависит лишь от функции Гамильтона Для
определения явного вида функции
распределения в статистической
физике принимается в качестве основного
положения постулат равной априорной
вероятности любого микросостояния
равновесной изолированной системы, т.
е. принимается, что для изолированной
системы, имеющей энергию Е с точностью
(определяемой заданием макроскопических
условий) и число частиц N в объеме V,
функция распределения p(q,
p)
постоянна в слое и равна нулю вне этого
слоя:
Для равновесной системы частиц в
неподвижном сосуде импульс Р и момент
импульса М равны нулю. Поэтому в этом
случае для систем с заданным числом
частиц фазовая плотность распределения
зависит лишь от функции Гамильтона Для
определения явного вида функции
распределения в статистической
физике принимается в качестве основного
положения постулат равной априорной
вероятности любого микросостояния
равновесной изолированной системы, т.
е. принимается, что для изолированной
системы, имеющей энергию Е с точностью
(определяемой заданием макроскопических
условий) и число частиц N в объеме V,
функция распределения p(q,
p)
постоянна в слое и равна нулю вне этого
слоя:
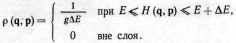 Равновероятностное
распределение микросостояний
изолированной системы называется
микроканоническим распределением, а
соответствующий ансамбль — микроканоническим
ансамблем. С помощью б-функции
микроканоническое распределение (12.9)
можно записать в виде
Равновероятностное
распределение микросостояний
изолированной системы называется
микроканоническим распределением, а
соответствующий ансамбль — микроканоническим
ансамблем. С помощью б-функции
микроканоническое распределение (12.9)
можно записать в виде
![]()
П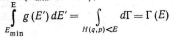 остоянная
g(E,
N,
V)
определяется из условия нормировки
остоянная
g(E,
N,
V)
определяется из условия нормировки
![]() и имеет смысл плотности распределения
фазового объема по энергии.
Действительно, интеграл от g(E')
по допустимым значениям энергии, меньшим
Е (Еmin<E'<Е),
равен фазовому объему (приведенному),
заключенному внутри гиперповерхности
Н(q,
р) =Е. Увеличение фазового объема Г(Е)
при возрастании энергии на величину Е
называется статистическим весом
макроскопического состояния системы
с энергией E
и равно
и имеет смысл плотности распределения
фазового объема по энергии.
Действительно, интеграл от g(E')
по допустимым значениям энергии, меньшим
Е (Еmin<E'<Е),
равен фазовому объему (приведенному),
заключенному внутри гиперповерхности
Н(q,
р) =Е. Увеличение фазового объема Г(Е)
при возрастании энергии на величину Е
называется статистическим весом
макроскопического состояния системы
с энергией E
и равно
![]() где g(E)
— энергетическая плотность фазового
объема, или, поскольку точки фазового
объема изображают состояния, плотность
состояний системы с данной энергией Е.
Можно показать, что микроканоническое
распределение обеспечивает равенство
среднего по макроканоническому ансамблю
среднему по времени функции координат
к импульсов систем. Такие системы
называются эргодическими. Обоснование
(исходя из механики) эргодичности
многочастичных систем и возможности
замены средних по времени средними по
микроканоническому ансамблю носит
название эргодической проблемы. Эта
проблема несмотря на ряд полученных
важных результатов еще ждет своего
решения. Для построения термодинамики
многочастичной системы достаточно,
как известно, определить один из ее
термодинамических потенциалов. Остальные
величины находятся уже методами самой
термодинамики. При независимых
макроскопических параметрах E,
V,
N,
которыми определяется термодинамическое
состояние рассматриваемой системы,
термодинамическим потенциалом является
энтропия. Гиббс определяет ее как
величину, пропорциональную логарифму
фазового объема
где g(E)
— энергетическая плотность фазового
объема, или, поскольку точки фазового
объема изображают состояния, плотность
состояний системы с данной энергией Е.
Можно показать, что микроканоническое
распределение обеспечивает равенство
среднего по макроканоническому ансамблю
среднему по времени функции координат
к импульсов систем. Такие системы
называются эргодическими. Обоснование
(исходя из механики) эргодичности
многочастичных систем и возможности
замены средних по времени средними по
микроканоническому ансамблю носит
название эргодической проблемы. Эта
проблема несмотря на ряд полученных
важных результатов еще ждет своего
решения. Для построения термодинамики
многочастичной системы достаточно,
как известно, определить один из ее
термодинамических потенциалов. Остальные
величины находятся уже методами самой
термодинамики. При независимых
макроскопических параметрах E,
V,
N,
которыми определяется термодинамическое
состояние рассматриваемой системы,
термодинамическим потенциалом является
энтропия. Гиббс определяет ее как
величину, пропорциональную логарифму
фазового объема
![]() где k
— универсальная постоянная, равная
постоянной Больцмана. Можно показать,
что определенная таким образом энтропия
обладает известными термодинамическими
свойствами.
где k
— универсальная постоянная, равная
постоянной Больцмана. Можно показать,
что определенная таким образом энтропия
обладает известными термодинамическими
свойствами.
Заметим, что
поскольку при определении энтропии в
статистическом пределе (N=>,
V=>,
V/N
= v
= const)
следует учитывать только основную
асимптотику по числу частиц —N,
то определение статистической
энтропии не является единственным.
Так, например, можно использовать вместо
эквивалентные выражения в виде
логарифмов или плотности состояний
![]() i
статистического веса
i
статистического веса
![]() Логарифмический вид выражений для
энтропии обусловлен требованием ее
аддитивности, в частности, для
невзаимодействующих подсистем.
Вычисление фазового объема или
статистического веса даже для
относительно простых статистических
систем .представляют трудную задачу.
Поэтому микроканоническое распределение
используется в основном не для вычисления
термодинамических функций конкретных
систем, а для общетеоретического
рассмотрения. Каноническое распределение
Найдем распределение по состояниям
(функцию распределения в фазовом
пространстве) неизолированной (но
замкнутой) системы, находящейся в
тепловом контакте с другой системой
значительно больших размеров (по
числу степеней свободы) — термостатом.
Т — температура термостата и системы,
находим каноническое распределение
Гиббса
Логарифмический вид выражений для
энтропии обусловлен требованием ее
аддитивности, в частности, для
невзаимодействующих подсистем.
Вычисление фазового объема или
статистического веса даже для
относительно простых статистических
систем .представляют трудную задачу.
Поэтому микроканоническое распределение
используется в основном не для вычисления
термодинамических функций конкретных
систем, а для общетеоретического
рассмотрения. Каноническое распределение
Найдем распределение по состояниям
(функцию распределения в фазовом
пространстве) неизолированной (но
замкнутой) системы, находящейся в
тепловом контакте с другой системой
значительно больших размеров (по
числу степеней свободы) — термостатом.
Т — температура термостата и системы,
находим каноническое распределение
Гиббса
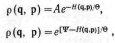
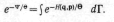
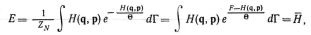 где
— kT
называется модулем канонического
распределения, а константа A
содержит все не зависящие от q
и р величины и определяется из условия
нормировки Входящий интеграл
где
— kT
называется модулем канонического
распределения, а константа A
содержит все не зависящие от q
и р величины и определяется из условия
нормировки Входящий интеграл
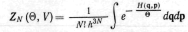 называется статистич. интегралом
системы, а определяемая
называется статистич. интегралом
системы, а определяемая
![]() есть ее энергия Гельмгольца F(T,V,N).
Действительно, вычислим внутренние
уравнению Гиббса—Гельмгольца
есть ее энергия Гельмгольца F(T,V,N).
Действительно, вычислим внутренние
уравнению Гиббса—Гельмгольца
![]() т. е. что внутренняя энергия статистической
системы равна среднему значению ее
функции Гамильтона по каноническому
распределению Гиббса как и должно
быть в соответствии с физическим
смыслом Е. Поскольку функция Гамильтона
системы равна сумме кинетической и
потенциальной энергий ее частиц, а
кинетическая энергия есть квадратичная
функция импульсов, то интегрирование
по ним в может быть произведено и мы
получим
т. е. что внутренняя энергия статистической
системы равна среднему значению ее
функции Гамильтона по каноническому
распределению Гиббса как и должно
быть в соответствии с физическим
смыслом Е. Поскольку функция Гамильтона
системы равна сумме кинетической и
потенциальной энергий ее частиц, а
кинетическая энергия есть квадратичная
функция импульсов, то интегрирование
по ним в может быть произведено и мы
получим
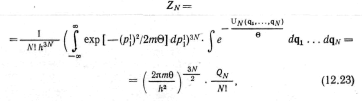
![]() называется конфигурационным интегралом.
Интегрирование по импульсам канонического
распределения Гиббса легко выполняется
и дает конфигурационное распределение
Гиббса
называется конфигурационным интегралом.
Интегрирование по импульсам канонического
распределения Гиббса легко выполняется
и дает конфигурационное распределение
Гиббса
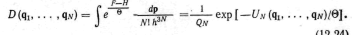 Энергия Гельмгольца
Энергия Гельмгольца
![]()
![]() — тепловая длина волны де Бройля. Таким
образом вычисление энергии Гельмгольца,
а следовательно, и всех термодинамических
функций многочастичной системы
сводится к вычислению ее конфигурационного
интеграла (12.24). С помощью известных
термодинамических соотношений (5.17)
— тепловая длина волны де Бройля. Таким
образом вычисление энергии Гельмгольца,
а следовательно, и всех термодинамических
функций многочастичной системы
сводится к вычислению ее конфигурационного
интеграла (12.24). С помощью известных
термодинамических соотношений (5.17)
![]()
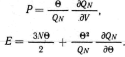 С помощью канонического распределения
находим, что энтропия
С помощью канонического распределения
находим, что энтропия
с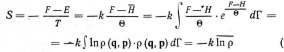 истемы
пропорциональна среднему значению
логарифма плотности вероятности, а
не является
истемы
пропорциональна среднему значению
логарифма плотности вероятности, а
не является
средним значением
какой-либо механической величины.
Большое каноническое распределение
Определим теперь распределение по
состояниям открытой системы в
термостате, называемое большим
каноническим распределением Гиббса.
С такими системами мы встречаемся в
целом ряде приложений. Кроме того,
использование большого канонического
распределения во многих случаях
оказывается более эффективным, чем
микроканонического и канонического
распределений. Рассмотрим малую
систему, которая находится в тепловом
и материальном контакте с термостатом,
обмениваясь с ним не только энергией,
но и частицами. Границы, отделяющие
систему от термостата в некотором смысле
условны: они фиксируют лишь ее объем V
и другие внешние параметры а, но не
энергию Е и число частиц N.
В соответствии с этим термодинамическое
состояние системы определяется
переменными Т, V,
N.
Большое каноническое распределение
получим аналогично выводу канонического,
исходя из микроканонического распределения
для изолированной объединенной (термостат
и изучаемая малая система) системы с
энергией ЕО и числом частиц NO.
Отличие в рассматриваемом случае
системы состоит в том, что теперь
следует в явном виде указывать число
частиц в ней. Таким образом, подобно
функция распределения системы с
переменным числом частиц в термостате
имеет вид:
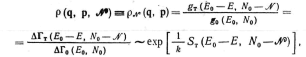 где индексы о к т относятся соответственно
к объединенной системе и к термостату.
Поскольку мы будем предполагать, что
для энергии E
и числа частиц N
подсистемы справедливы неравенства
где индексы о к т относятся соответственно
к объединенной системе и к термостату.
Поскольку мы будем предполагать, что
для энергии E
и числа частиц N
подсистемы справедливы неравенства
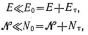 то в первом приближении
то в первом приближении
![]() где учтено, что
где учтено, что
![]() Подставляя (12.45) в (12.44), находим
распределение Гиббса большое каноническое
Подставляя (12.45) в (12.44), находим
распределение Гиббса большое каноническое
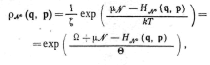
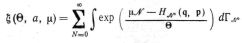 большой статистический интеграл (сумма),
большой статистический интеграл (сумма),
![]() большой термодинамический потенциал.
Действительно, термодинамические
параметры —число частиц и внутренняя
энергия —определяемые соответствующими
частными производными большого
термодинамического потенциала,
совпадают со средними значениями числа
частиц и функции Гамильтона по большому
каноническому распределению Г
большой термодинамический потенциал.
Действительно, термодинамические
параметры —число частиц и внутренняя
энергия —определяемые соответствующими
частными производными большого
термодинамического потенциала,
совпадают со средними значениями числа
частиц и функции Гамильтона по большому
каноническому распределению Г иббса
(12.46).
иббса
(12.46).
Термодинамическая эквивалентность канонических распределений Мы рассмотрели три гиббсовских распределения: микроканоническое — для изолированных систем, каноническое — для неизолированных закрытых систем в термостате и большое каноническое—для неизолированных открытых систем в термостате.За исключением немногих случаев, использование этих распределений для каждой из названных систем приводит в статистическом пределе (N=>, V=>, V/N = u = const) к термодинамически эквивалентным результатам. Это означает, что каноническим и большим каноническим распределениями можно пользоваться также для описания изолированных систем, что практически является очень важным. Во всех практически важных случаях относительная' флуктуация энергии очень мала и в статистическом пределе стремится к нулю. Малость величины относительной флуктуации означает, что значения энергии системы в термостате сколько-нибудь отличные от средней энергии, рактически невероятны.
Энергии, заметно
отличающиеся от Н, чрезвычайно
маловероятны, и система ведет себя
практически как изолированная. Это и
приводит к термодинамической
эквивалентности результатов, полученных
с помощью канонического и микроканонического
распределений. Аналогично с помощью
большого канонического распределения
находим: относительная флуктуация
числа частиц в системах большого
канонического ансамбля
![]()
стремится к нулю в статистическом пределе. Отсюда следует эквивалентность большого канонического и канонического распределений. Заметим, что, несмотря на термодинамическую эквивалентность статистических ансамблей, расчеты величины флуктуации, проведенные с их помощью, приводят к различным результатам. Как видно из формулы, относительная флуктуация энергии системы в термостате не будет малой тогда, когда бесконечно большая теплоемкость, и аналогично относительная флуктуация не будет малой при нулевая величина коэффициента устойчивости. Это имеет место, как известно из термодинамики, в критическом состоянии и в двухфазных системах. В этих случаях канонические ансамбли не эквивалентны. основы КВАНТОВОЙ СТАТИСТИКИ Квантовые микроканоническое и каноническое распределения. Определение микроканонического и канонического распределений квантовых систем в целом аналогично рассмотренному классическому случаю. Роль функции распределения играет теперь статистический оператор р или набор коэффициентов wk. определяющих вероятностное распределение по чистым состояниям.
Как следует из уравнения Неймана, равновесный статистический оператор коммутирует с гамильтонианом И для покоящейся системы является его функцией. Поэтому необходимо задать зависимость коэффициентов wk от энергии Ek.
Если число квантовых
состояний изолированной системы, имеющей
энергию Е с определенным отклонением
Е<Е,
равно Г(E),
то в соответствии с постулатом равной
априорной вероятности состояний
таких систем имеем квантовое
микроканоническое распределение
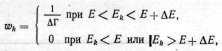
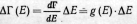 из условия нормировки (13.1):
из условия нормировки (13.1):
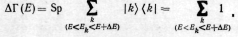 а полное число состояний равно
а полное число состояний равно
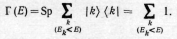 Энтропия квантовой статистической
системы определяется формулами,
Энтропия квантовой статистической
системы определяется формулами,
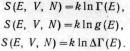 Отсюда получаем квантовое каноническое
распределение по состояниям
Отсюда получаем квантовое каноническое
распределение по состояниям
![]()
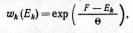 или после нормировки
или после нормировки
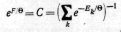
![]() называется статистической суммой, а
называется статистической суммой, а
![]() есть энергия Гельмгольца квантовой
системы, в чем легко убедиться.
Заметим, что каноническое распределение
определяет также распределение по
энергиям для системы с невырожденными
уровнями энергии. При наличии вырождения,
когда одному и тому же энергетическому
уровню Е соответствует gt
различных состояний, вероятность такого
вырожденного значения энергии равна
есть энергия Гельмгольца квантовой
системы, в чем легко убедиться.
Заметим, что каноническое распределение
определяет также распределение по
энергиям для системы с невырожденными
уровнями энергии. При наличии вырождения,
когда одному и тому же энергетическому
уровню Е соответствует gt
различных состояний, вероятность такого
вырожденного значения энергии равна
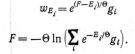 Зная энергию Гельмгольца, как функцию
своих естественных переменных, все
другие термодинамические параметры
можно найти методами термодинамики.
Энтропия системы равна
Зная энергию Гельмгольца, как функцию
своих естественных переменных, все
другие термодинамические параметры
можно найти методами термодинамики.
Энтропия системы равна
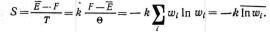 Таким образом, исследование квантовой
статистической системы с помощью
канонического распределения сводится
к следующей процедуре:
Таким образом, исследование квантовой
статистической системы с помощью
канонического распределения сводится
к следующей процедуре:
а) вначале решается динамическая задача по определению энергетического спектра Е; и соответствующего набора квантовых чисел i путем решения уравнения Шредингера;
б) потом рассчитывается статистическая сумма (13.11) системы и ее энергия Гельмгольца F(Q, V, N) (13.12);в) и далее вычисляются термодинамические характеристики системы. Квантовое большое каноническое распределение. Рассмотрим свойства открытых квантовых систем в термостате. Макроскопически такие системы описываются переменными Т, V, N. Границы, отделяющие систему от термостата, проницаемы для частиц. Соответствующее этим условиям распределение по состояниям — большое каноническое распределение — может быть получено подобно каноническому, исходя из микроканонического распределения для объединенной изолированной системы с энергией E0 и числом частиц N0. При этом в дополнение к неравенству для энергии системы необходимо добавить неравенство для числа ее частиц Отсюда, используя микроканоннческое распределение для объединенной системы, находим большое каноническое распределение по состояниям i квантовой открытой системы а термостате:
![]()
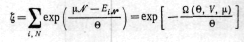
![]() большой
термодинамический потенциал. Действительно,
вычисленные с помощью (13.19) по формулам
термодинамики энергия и число частиц
системы равны соответствующим средним
по большому каноническому распределению:
большой
термодинамический потенциал. Действительно,
вычисленные с помощью (13.19) по формулам
термодинамики энергия и число частиц
системы равны соответствующим средним
по большому каноническому распределению:
![]()
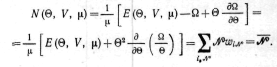 Энтропия системы, как и в случае
канонического распределения определяется
средним значением логарифма функции
распределения:
Энтропия системы, как и в случае
канонического распределения определяется
средним значением логарифма функции
распределения:
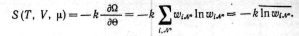 Таким образом, при использовании большого
канонического распределения для
исследования квантовых статистических
систем необходимо прежде всего определить
энергетический спектр системы из решения
уравнения Шредингера
Таким образом, при использовании большого
канонического распределения для
исследования квантовых статистических
систем необходимо прежде всего определить
энергетический спектр системы из решения
уравнения Шредингера
![]() Причем в отличие от канонического
распределения требуется найти
зависимость спектра для произвольного
числа частиц N,
в том числе и для малых N~
1. Затем следует расчет большой
статистической суммы и большого
термодинамического потенциала .
Далее методами термодинамики вычисляются
все необходимые термодинамические
характеристики системы.
Причем в отличие от канонического
распределения требуется найти
зависимость спектра для произвольного
числа частиц N,
в том числе и для малых N~
1. Затем следует расчет большой
статистической суммы и большого
термодинамического потенциала .
Далее методами термодинамики вычисляются
все необходимые термодинамические
характеристики системы.
