
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
22 Сульфур. Алотропні модифікації сульфуру. Застосування.
Су́льфур (S), хімічний елемент VI групи періодичної системи елементів, атомова вага 32,064; неметал; жовта кристалічна субстанція. Виступає в природі у самородному стані та у вигляді сульфідів важких металів (піриту та ін.).
Фізичні властивості
Сірка — кристалічна речовина жовтого кольору. Вона дуже крихка і легко розтирається в дрібнесенький порошок. Зустрічається в трьох алотропних формах: дві кристалічні (ромбічна і моноклінна, за способом сполучення атомів у кристалі) і аморфна. Електричного струму і тепла майже не проводить. Плавиться при 112,8°С, кипить при 444,6°С. Пари сірки при дуже швидкому охолодженні переходять у твердий стан у вигляді дуже тонкого порошку (сіркового цвіту), минаючи рідкий стан. У воді сірка не розчиняється і не змочується водою, але в бензолі C6H6 і особливо в сірковуглеці CS2 розчиняється добре.
Хімічні властивості
Fe + S = FeS
Zn + S = ZnS
Hg + S = HgS
H2 + S = H2S
S + O2 = SO2
2S + 3O2 = 2SO3
Одержання і застосування
Елементарну сірку одержують звичайно з природної самородної сірки. Для відокремлення сірки від сторонніх домішок її виплавляють в автоклавах. Автоклави — це залізні циліндри, в які завантажують руду і нагрівають перегрітим водяним паром до 150°С під тиском 6 атм.. Розплавлена сірка стікає вниз, а пуста порода залишається. Виплавлена з руди сірка ще містить певну кількість домішок.
Цілком чисту сірку одержують перегонкою у спеціальних печах, сполучених з великими камерамиСірка широко застосовується у різних галузях народного господарства, переважно у хімічній промисловості для виробництва сульфатної кислоти H2SO4, сірковуглецю CS2, деяких барвників і інших хімічних продуктів. Значні кількості сірки споживає гумова промисловість для вулканізації каучуку, тобто для перетворення каучуку в гуму. Сірку використовують також у сірниковому виробництві, в піротехніці, у виробництві чорного пороху тощо. У медицині сірка йде для виготовлення сіркової мазі при лікуванні шкіряних хвороб. У сільському господарстві сірковий цвіт застосовують для боротьби з шкідниками бавовнику і виноградної лози.
23 Оксинен. Алотропні модифікації оксисену. Застосування.
Оксиге́н (О) — хімічний елемент головної підгрупи 6 групи періодичної системи групи з атомним номером 8, простими речовинами якого є гази кисень та озон.
Фізичні властивості
Кисень — безбарвний газ без запаху і смаку. При температурі —183° С він скрапляється у рідину голубуватого кольору, яка при —218,7° С замерзає в синю кристалічну масу. Розчинність кисню у воді невелика і при звичайній температурі становить всього 3,1 см³ в 100 г води.
Хімічні властивості
![]()
![]()
Н2+О2=Н2О
Алотропні модифікації оксисену
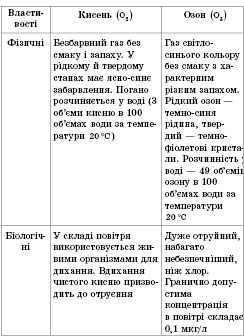
Застосування
Застосування кисню. Кисень використовується для інтенсифікації процесів горіння (наприклад, при виплавці сталі), підвищення температури горіння (при зварюванні), як окисник в інших реакціях, у медицині.
Озон має дезинфікуючу відбілюючу дію. Головне застосування озону — знезаражування водопровідної води.
Застосування сірки. Сірка застосовується для одержання сульфатної кислоти, вулканізації каучуку, боротьби із сільськогосподарськими шкідниками, одержання сірників, пороху. У медицині виготовляють сірчані мазі для лікування шкірних хвороб.
