
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
18 Багатоатомні спирти. Етиленгліколь і гліцерин
Багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи.
Будова
Якщо в молекулі спирту містяться три гідроксигрупи, він належить до триатомних спиртів. У назві такого багатоатомного спирту присутній суфікс -тріол.
Загальна формула триатомних
спиртів
![]() . Наприклад, формула пропантріолу-1,2,3
(гліцерину):
. Наприклад, формула пропантріолу-1,2,3
(гліцерину):
![]()
Ізомерія спиртів зумовлена будовою карбонового скелета й положенням функціональної групи.
При складанні назви ізомеру нумерація атомів Карбону починається з того кінця карбон-карбонового ланцюга, до якого ближча функціональна група. Номер атома Карбону, при якому знаходиться гідроксигрупа, указується в кінці назви спирту. Положення вуглеводневого радикала вказується на початку назви. Наприклад:
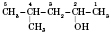
4-метилпентанол-2 (але не 2-метилпентанол-4)
Номенклатура
Фізичні властивості гліцерину.
Безбарвна, в’язка, гігроскопічна
рідина, солодка на смак. Змішується з
водою в будь-яких співвідношеннях.
Температура плавлення —
![]() , кипіння —
, кипіння —
![]()
Хімічні властивості багатоатомних спиртів (на прикладі гліцерину).
1) Горіння:
![]()
Утворюються вуглекислий газ і вода (за достатньої кількості кисню).
2) Взаємодія з активними металами (може відбуватися ступінчасто):
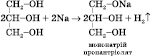
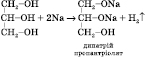
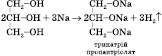
3) Взаємодія з галогеноводнями (може відбуватися ступінчасто):
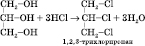
4)Нітрування (нітруюча суміш — суміш концентрованих нітратної і сульфатної кислот)
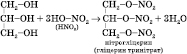
Нітрогліцерин — вибухова речовина, вибухає від легкого струсу і нагрівання. Із нітрогліцерину виробляють динаміт.
5) Взаємодія з купрум(ІІ) гідроксидом(якісна реакція на багатоатомні спирти):
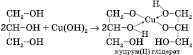
Купрум(ІІ) гліцерат, що утворюється, — розчин синього кольору.
Застосування гліцерину. Гліцерин застосовується для добування нітрогліцерину (вибухова речовина), антифризів, у шкіряному виробництві для пом’якшення шкір, у медицині.
Етиленгліколь і гліцерин – солодкуваті безбарвні сироподібні рідини. Вони добре розчиняються у воді і в етанолі.
Етиленгліколь – дуже отруйна речовина!
19 Феноли
Феноли – це органічні сполуки, у молекулах яких гідроксильні групи безпосередньо зв’язані з бензольним ядром.
Найпростішим представником фенолів є гідроксибензол, або фенол. Молекулярна формула фенолу C6H5OH.
Електронна будова
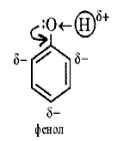
Феноли являють собою полярні сполуки (диполі). Бензольне кільце є негативним кінцем диполя, група - OH - позитивним. Дипольний момент направлений в сторону бензольного кільця. Фенол є слабкою кислотою. В цьому полягає головна відмінність фенолів від спиртів, які є неелектролітами.
Ізомерія
Можливі 2 типу ізомерії :
ізомерія положення заступників в бензольному кільці;
ізомерія бічного ланцюга (будови алкильного радикала і числа радикалів).
Номенклатура
За наявності декількох заступників початок нумерації визначає гідроксильна група і ці з’єднання розглядаються як похідні фенолу. Багато фенолів мають тривіальні назви (вказані в дужках), які зберігаються і в систематичній номенклатурі:
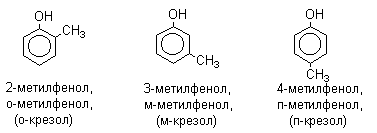
Застосування
• виробництво полімерних матеріалів
• виробництво барвників
• виробництво лікарських препаратів
• виготовлення парфумів і косметичних засобів
Охорона навколишнього середовища від промислових відходів, що містять фенол
Фенол – сильний антисептик, використовується як дезинфікуюча речовина в медицині. Особливо багато його витрачають для виробництва пластмас – фенопластів, а також барвників, лікарських речовин, фотографічних проявників.
Але треба зважати на те, що фенол вбиває не лише шкідливі мікроорганізми. Потрапляючи в довкілля, він згубно діє на флору і фауну. Тому виробництво і промислове використання фенолу тісно пов’язане з питаннями екології, з охороною природи від промислових відходів, що містять фенол. З цією метою застосовують різні методи: гази, що містять фенол, піддають каталітичному окисненню, видаляють фенол розчинниками тощо. Ведеться постійна робота з удосконалення цих методів. Так, великого значення набуває біохімічний метод, який забезпечує глибоке очищення стічних вод від фенолу. Перспективним є також обробка їх озоном. Запровадження таких методів очищення дає можливість перейти до замкнутих безвідхідних технологій з багаторазовим використанням промислових вод.
20 Фізичні та хімічні властиивості фенолів. Добування
Фізичні властивості
Фенол – безбарвна кристалічна речовина з характерним запахом. Під час зберігання він поступово окиснюється киснем повітря і набуває рожевого забарвлення. Фенол плавиться за температури 43 °С. Добре розчиняється в гарячій воді.
Фенол отруйний, при потраплянні на шкіру викликає опіки. Він всмоктується через шкіру і може викликати отруєння.
Хімічні властивості
кислотні властивості фенолів
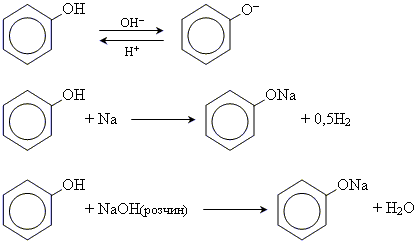
2. реакції заміщення
• реакція нітрування
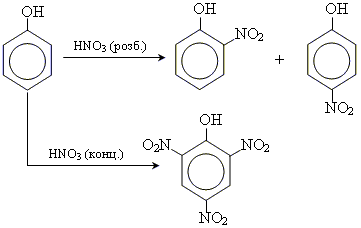
• реакції галогенування (Cl, Br)
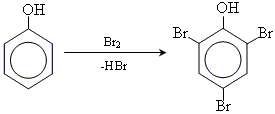
• реакція сульфування
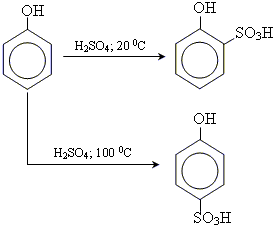
3.утворення простих ефірів
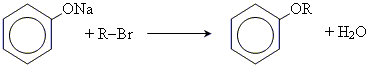
4. утворення складних ефірів
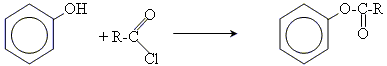
5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
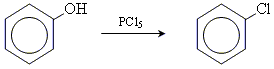
6. відщеплення гідроксогрупи
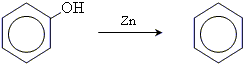
Взаємний вплив атомів в молекулі фенолів
Феноли являють собою полярні сполуки (диполі). Бензольне кільце є негативним кінцем диполя, група - OH - позитивним. Дипольний момент направлений в сторону бензольного кільця.
Як відомо, гідроксильна група -OH є заступником I роду, тобто вона сприяє підвищенню електронної щільності в бензольному кільці (особливо в орто-і пара-положеннях). Це обумовлено тим, що одна з неподілених пар електронів атома кисню OH-групи вступає в пару з π-системою бензольного кільця. Зсув неподіленої пари електронів атома кисню в бік бензольного кільця призводить до збільшення полярності зв'язку OH. Таким чином, має місце взаємний вплив атомів і атомних груп у молекулі фенолу. Це взаємний вплив відображається у властивостях фенолу. [1]
По-перше, підвищується здатність до заміщення атомів водню в орто-і пара-положеннях бензольного ядра, і в результаті реакцій заміщення зазвичай утворюються тризаміщений похідні фенолу.
По-друге, збільшення полярності зв'язку OH під дією бензольного ядра і поява досить великого позитивного заряду на атомі водню призводить до того, що молекули фенолу дисоціюють у водних розчинах по кислотному типу.
Фенол є слабкою кислотою. В цьому полягає головна відмінність фенолів від спиртів, які є неелектролітами.
Добування
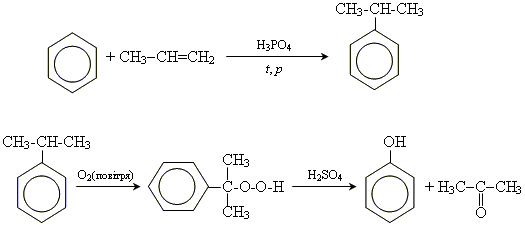
Промислові методи отримання
1. з кам'яновугільної смоли
2.отримання з бензолу і пропену
21 Альдегіди
Альдегідами називаються
органічні сполуки, у молекулах яких
міститься альдегідна функціональна
група: –
![]()
Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса -аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна формула альдегідів:
![]()
Будова
Група атомів називається карбонільною групою, або карбонілом.
Порівняно зі спиртами у складі молекул альдегідів на два атоми Гідрогену менше. Це відбивається у назві «альдегіди», що походить від слів «алкоголь» і «дегідрування», тобто дегідрований алкоголь.
Номенклатура
Систематичні назви альдегідів будують за назвою відповідного вуглеводню і додаванням суфікса-аль. Нумерацію ланцюга починають з карбонільного атома вуглецю. Тривіальні назви виробляють від тривіальних назв тих кислот, в які альдегіди перетворюються при окисленні.
H 2 C = O метан аль мурашиний альдегід (формальдегід)
CH 3 CH = O етан аль оцтовий альдегід (ацетальдегід)
(CH 3) 2 CHCH = O 2-метил-пропан аль ізомасляний альдегід
CH 3 CH = CHCH = O Бутен-2-аль кротоновий альдегід
Ізомерія альдегідів зумовлена зміною в будові карбонового скелета, сполученого з альдегідною групою. Карбон, що входить до альдегідної групи, вважається першим. Наприклад:
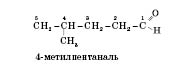
Добування
1) Окиснення спиртів із
гідроксигрупою біля першого атома
Карбону: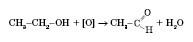
2) Окиснення алкенів
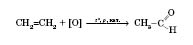
3) Метаналь добувається каталітичним окисненням метану (каталізатори — нітроген оксиди):
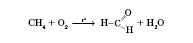
Реакція Кучерова:
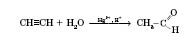
Представники гомологічного ряду альдегідів

22 Фізичні і хімічні властивості альдегідів
Фізичні властивості
Формальдегід — безбарвний
газ із різким задушливим запахом. Добре
розчиняється у воді. Температура кипіння
![]() .
Водний 40%-й розчин формальдегіду
називається формаліном.
.
Водний 40%-й розчин формальдегіду
називається формаліном.
Ацетальдегід — безбарвна
легколетка рідина з різким запахом,
добре розчинна у воді. Температура
кипіння
![]() .
.
Хімічні реакції
1) Повне окиснення — горіння:
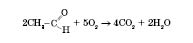
2) Часткове окиснення — купрум(II) гідроксидом до кислоти (у даному випадку — оцтової):
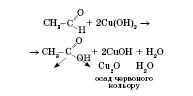
Це якісна реакція для визначення альдегідів.
Окиснення амоніачним розчином аргентум оксиду — «реакція срібного дзеркала»:
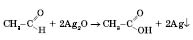
Ця реакція також є якісною для визначення альдегідів.
Реакції приєднання проходять за рахунок розриву подвійного зв’язку в альдегідній групі.
Приєднання водню (відновлення альдегідів до спиртів):
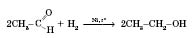
23 Кетони
Кетони –
органічні речовини, які містять
карбонільну (кето-) групу
![]() ,
зв’язану з двома вуглеводневими
радикалами.
,
зв’язану з двома вуглеводневими
радикалами.
![]()
Будова
Карбонільна група >С = О присутня в молекулах альдегідів, що зумовлює схожість хімічних властивостей альдегідів і кетонів. Проте схожість не є повною, оскільки в молекулах альдегідів один із зв’язків карбонільною групою витрачається на з’єднання з воднем, а в молекулах кетону обидва зв’язки йдуть на з’єднання з вуглеводневими радикалами. Це позначається, зокрема, на тому, що кетони окиснюються значно важче, ніж альдегіди, і не є такими енергійними відновниками, як альдегіди.
У практичному плані найбільш важливим з кетонів є диметилкетон, або ацетон.
