
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
Фізичні властивості насичених вуглеводнів закономірно змінюються залежно від їх складу. Як видно з таблиці, перші чотири гомологи (від C1 до C4) при звичайній температурі є газами, наступні одинадцять (від C6 до C15) — рідини, а починаючи з гексадекану C16H34 — тверді речовини. Із збільшенням молекулярної маси їх точки плавлення і точки кипіння поступово підвищуються, а також збільшується і їх густина. У воді насичені вуглеводні практично нерозчинні, але добре розчиняються в багатьох органічних розчинниках.
Хімічні властивості
С2Н6+7О2=4СО2+6Н2О
С2Н6+Сl2=C2H5Cl+HCl
CH4+H2O=3H2+CO
Застосування:
Як паливо, у хімічній промисловості, для виготовлення свічок.
7 Циклоалкани
Циклоалка́ни— вуглеводні з одним чи кількома вуглецевими циклами. Загальна формула CnH2n або (CH2)n.
За розмірами циклу поділяють на малі (циклопропан, циклобутан), середні (циклопентан, циклогексан, циклогептан) та великі (n>7).
8 Алкени
Алкени ненасичені ациклічні вуглеводи , називані також олефінами, що мають загальну формулу CnH2n. Легкі алкени, наприклад, етилен і пропілен — гази, які отримують з фракцій при крекінгу нафти. Алкени мають один або більше подвійних зв'язків між атомами вуглецю, тому називаються ненасиченими. Інша назва — олефіни.
9 Фізичні та хімічні властивості етиленових вуглеводнів. Добування та застосування алкенів.
Хімічні властивості
Реакція гідрування
![]()
Реакція Вагнера (окиснення перманганатом Калію у лужному середовищі)
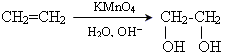
Реакції приєднання Br2 і Cl2
![]()
Реакції полімеризації
![]()
Фізичні властивості
Перші три члени ряду олефінів є газами, далі йдуть рідини, що не змішуються з водою; вищі олефіни — це тверді речовини. Зі збільшенням молекулярної маси підвищуються температури плавлення і кипіння. Алкени нормальної будови киплять при більш високій температурі, ніж їх абітурієнти, що мають ізобудову. Температури кипіння цис-ізомерів вище, ніж транс-ізомерів, а температури плавлення - навпаки.
Алкени погано розчиняються у воді (проте краще, ніж відповідні алкани), але добре - в органічних розчинниках.
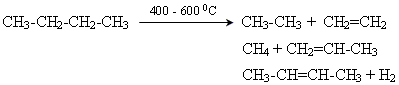
Отримання
Промислові методи
Крекінг алканів нафти
Лабораторні методи
Дегідратація спиртів
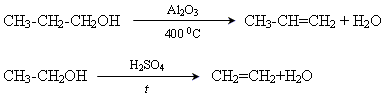
Відщеплення галогенів (Cl, Br)
![]()
Гідрування алкінів
![]()
Застосування алкенів
При цьому утворився етиленгліколь - в'язка, схожа з гліцерином рідиназастосовується у виробництві антифризів, синтетичного волокна лавсану,вибухових речовин. Етиленгліколь дуже отруйний.
Оксид етилену застосовується для синтезу різних органічних речовин,виробництва оцтового альдегіду, виробництва лаків, пластмас,косметичних препаратів, і.т.д.
. Етилен приєднує воду, і виходить етиловий спирт:
. При реакції з галогеноводородамі виходить етілхлорід, що застосовується для місцевої астенезіі:
В результаті утворюється поліетилен з якого отримують безліч різнихпластмас, високооктанове пальне, синтетичний каучук, і.т.д.
10 Ацетиленові вуглеводні
АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (алкіни) — вуглеводні аліфатичного ряду, які містять один потрійний зв’язок –С≡С–. Загальна формула алкінів СnH2n-2. Найпростішим представником ряду є ацетилен (етин) С2Н2.
Ізомерія
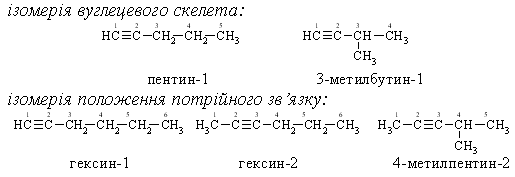
Номенклатура
Назва за номенклатурою IUPAC: вуглеводень + суфікс –ін (ин) + ци-фра, що показує положення потрійного зв’язку в алкіні. Нумерацію вугле-водневого радикала починаємо з того кінця, до яког ближче розташований потрійний зв’язок:
11 Фізичні та хімічні властивості алкінів. Добування та застосування.
Отримання
Промислові методи отримання ацетилену
гідроліз ацетилениду (карбіду) кальцію
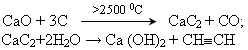
піроліз метану
![]()
Лабораторні методи
отримання через галогенпохідні
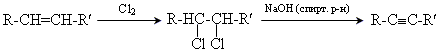
Хімічні властивості
приєднання галогенів (Cl2, Br2)
HCºCH + Cl2 → ClCH=CHCl;
приєднання галогеноводнів (HCl, HBr) за правилом Марковникова
![]()
Гідрогенізація
![]()
12 Алкадієни
Алкадієни — ненасичені аліфатичні вуглеводні, з загальною формулою CnH2n-2. Алкадієни містять два подвійних зв'язки між атомами вуглецю.
Натуральний каучук – високоеластичний матеріал природного походження, який одержують із латексу – соку каучуконосних рослин (гевея, гваюла, кок-сагиз, тау-сагиз та ін.) - при дії на нього коагулянтом – оцтовою кислотою.
13 Арени
Аромати́чні вуглево́дні — органічні сполуки, які належать до класу карбоциклічних сполук. У складі молекули ароматичних вуглеводнів є одна або кілька груп з 6 атомів вуглецю(Карбону), сполучених у кільце (бензенове ядро) простими і подвійними зв'язками (формула Кекуле). За сучасними уявленнями, атоми Карбону в бензеновому ядрі сполучені електронами двох типів: одні електрони містяться в площині молекули, інші розміщені перпендикулярно до неї.
Отримання
Промислові методи отримання бензолу і його гомологів
1. перегонка кам'яновугільної смоли
2. каталітичний риформінг нафти
3. реакція Реппе
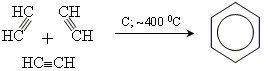
Лабораторні методи
дегідрогенізація циклогексану
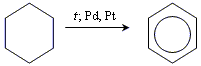
дегідроциклізація гептану
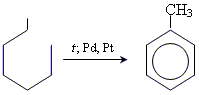
14 Алкіни
Фізичні властивості алкінів.
У гомологічному ряду алкінів перші три представники С2-С4 – гази, С5-С15 – рідини, а С16 – тверді речовини. Температури плавлення та ки-піння в ряду алкінів підпорядковані таким же закономірностям, що і у ряду алканів та алкенів, табл. 2.10. Аліфатичні супряжені полієни (алкадієни, алкатриєни) розкладаються з вибухом. Ацетилен при підвищеному тиску – вибухонебезпечний, тому його зберігають у балонах із кізельгуром у аце-тоні при тиску 14,0 атм.
Хімічні властивості
приєднання галогенів (Cl2, Br2)
HCºCH + Cl2 → ClCH=CHCl;
ClCH=CHCl + Cl2 → Cl2CH-CHCl2
приєднання галогеноводнів (HCl, HBr) за правилом Марковникова
Гідрогенізація
реакція Кучерова (реакція приєднання води)

Застосування бензену. Хімічна сировина для виробництва ліків, пластмас, барвників, отрутохімікатів і багатьох інших органічних речовин. Часто застосовується як розчинник. Додавання бензену поліпшує якість моторного пального.
15 Природні джерела вуглеводнів та їх переробка. Нафта. Продукти нафтопереробки та їх застосування
Природні джерела вуглеводів.
1. Вуглеводні зустрічаються в природі у вигляді переважно природного газу, нафти, кам’яного вугілля. Є 2 способи використання цих горючих копалин:
а) у вигляді палива – як джерело енергії,
б) у вигляді сировини для подальшої переробки – органічний синтез.
З вуглеводнів, виділених з нафти, природний газ і вугілля, можна добути багато різних речовин, а з них виробити ще більше корисних матеріалів.
Природний газ, нафта, вугілля належать до не відновлюваних природних ресурсів. Тому розвідують нові родовища, експлуатують уже відкриті так, щоб максимально вилучити з них копалини і раціонально використовувати їх.
Зрозуміло, що доцільніше хімічно переробляти природні джерела вуглеводів, ніж палити в котельнях, двигунах, промислових печах і т.д.
