
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
Добування:
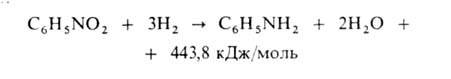
30 Амінокислоти
Амінокислота — це азотовмісна карбонова кислота, тобто — це хімічна речовина, молекула якої одночасно містить аміногрупу –NH2 та карбоксильну групу –СООН, і вуглецевий скелет. За тим, до якого атому вуглецю приєднана аміно- (або іміно-) група, амінокислоти поділяються на α, β, γ і т. д При цьому α-амінокислотами називаються такі, в яких карбоксильна та аміногрупа приєднані до одного і того ж атому вуглецю; β-амінокислотами — такі, де аміногрупа приєднана до атому вуглецю, сусіднього з тим, до якого приєднана карбоксильна; γ-амінокислотами — такі, де аміногрупа приєднана через один атом вуглецю від карбоксильної, і так далі.
Класифікація
В залежності від положення аміногрупи розрізняють a-, b-, g-амінокислоти, тощо. Найбільш важливе значення мають a-амінокислоти, які входять до складу білків. В загальному вигляді формулу a-амінокислоти можна представити наступним чином:
• класифікація за хімічною природоюбзамісника у a-положенні
аліфатичні, наприклад: гліцин*, аланін*
ароматичні, наприклад: фенілаланін*
гетероциклічні, наприклад: триптофан*
«R» представляє радикал, або «боковий ланцюг», що є специфічним для кожної окремої амінокислоти. За властивостями радикалу амінокислоти поділяються на 4 групи: кислотні, основні, гідрофільні (полярні), гідрофобні (неполярні).
Оптична ізомерія
Окрім гліцина, де R=Н, стандартні амінокислоти утворюють два оптично-активних ізомери, що позначаються літерами L та D. Ці ізомери не розрізняються за хімічними властивостями, але по-різномі обертають площину поляризації світла, що проходить через їхній розчин. До складу протеїнів входять практично лише L-ізомери. D-ізомери амінокислот знайдені в складі деяких протеїнів, що утворюються в організмі морських черевоногих молюсків конусів, та в складі клітинних стінок бактерій.
Утворення пептидного зв*язку
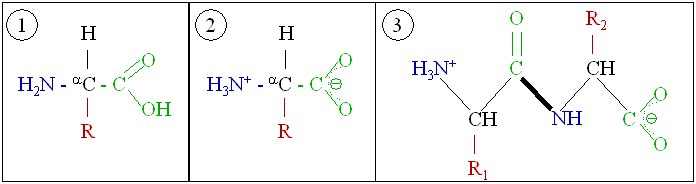
Хімічні властивості
1. Кислотно-основні властивості
Амінокислоти проявляють амфотерні властивості оскільки вміщують як основну групу -NH2, так і кислотну групу -СООН. Амфотерність амінокислот проявляється, наприклад, при утворенні внутрішніх солей, так званих біполярних іонів
H2N-CH2-COOH → H3N+-CH2-COO-
Амінокислоти реагують як з лугами, так і з кислотами
![]()
![]()
2. Реакції поліконденсації
a-Амінокислоти при взаємодії між собою утворюють аміди, які називають пептидами.
Зв'язок
![]()
називається пептидним
Так, наприклад, при взаємодії гліцину і аланіну утворюється дипептид гліцилаланін
![]()
Реакції утворення пептидів з амінокислот відносяться до реакцій поліконденсації.
Використання
• виробництво лікарських препаратів
• виробництво харчових і кормових добавок
Отримання
1. гідроліз природних білків
2. синтез з використанням галогензаміщених карбонових кислот
![]()
3. мікробіологічний синтез
31 Білки
Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовується для посилання на білок, як речовину, коли не важливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на деяку кількість білків, коли точний склад важливий.
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різномаїття білків із різними властивостями. Крім того, амінокислоти у складі білка часто піддаються посттрансляційним модифікаціям, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс).
Склад
Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда модифікації відбуваються вже після синтезу білка на рибосомі).
Структура
Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка.
Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають[9]: α-спіралі (спіраль, що має 4 залишки на виток, стабілізована водневими зв'язками між пептидними групами з кроком у 4 ланки) і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими пептидними групами, як це має місце для α-спіралі). Інші елементи вторинної структури включають π-спіралі (спіралі з кроком водневих зв'язків у 3 ланки), -спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP.
Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків, солевих містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишками цистеїну.
До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бути аналогічними, частіше за все вони зберігаються в процесі еволюції видів. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюжка, і що часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами, надаючи їм нові функції, таким чином існує набагато менше різновидів цих елементів, ніж різних білків. Процес передачі доменів можна здійснити і штучними методами генної інженерії, створюючи химерні білки.
Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом.
