
- •1 Предмет і завдання хімі. Основні етапи розвитку хімії. Зв*язок хімії з іншими природничими ауками.
- •2 Роль хімії в народному господарстві, медицині. Хімія та екологія.
- •3 Основні поняття і закони в хімії. Хімічні та фізичні явища. Атомна і молекулярна маса.
- •Основні поняття і закони в хімії
- •7 Періодичний закон та періодична система елементів д.І. Мендєлєєва, структура періодичного хімічних елементів. Значення періодичного закону.
- •Значення періодичного закону:
- •8 Будова атома: ядро, енергетичні рівні. Електронні конфігурації атомів елементів в основному та збудженому стані.
- •Типи хімічних зв’язків:
- •11 Типи хімічних реакцій. Типи кристалічних граток.
- •Кристалічні гратки:
- •12 Оксиди.
- •Застосування
- •20 Сильні і слабкі електроліти. Дисоціація кислот, основ. Солей на іони.
- •21 Галогени. Хлор. Якісна реакція на хлорид – іон.
- •22 Сульфур. Алотропні модифікації сульфуру. Застосування.
- •23 Оксинен. Алотропні модифікації оксисену. Застосування.
- •24 Оксид Сульфуру (IV).
- •Хімічні властивості
- •25 Сульфур(VI) оксид
- •26 Сульфатна кислота.
- •27 Нітроген. Будова молекул
- •Якісна реакція
- •31 Фосфор. Алотропні модифікації.
- •Поширення в природі
- •32 Сполуки фосфору. Якісна реакція. Біологічне значення. Фосфатні добрива.
- •33 Карбон. Алотропні модифікації. Поняття про адсорбцію, застосування.
- •Фізичні властивості Алотропні модифікації
- •34 Оксиди карбону. Карбонатна кислота та її солі. Якісна реакція. Твердість води та способи її усунення. Кругообіг Карбону в природі.
- •36 Силіцій (4) оксид. Силікатна кислота. Силікати. Поняття про будівельні матеріали.
- •Хімічні властивості силіцій(IV) оксиду
- •37 Загальна характеристика металів.
- •Залежність швидкості реакцій від різних чинників
- •Хімічна рівновага
- •2 Теорія хімічної будови органічних сполук о. М. Бутлерова
- •3 Класифікація органічних сполук. Поняття про функціональні групи. Ізомерія
- •Класифікація
- •Найважливіші класи органічних сполук
- •4 Електронна будова атома Карбону. Основний і збуджений стан атома Карбону.
- •5 Алкани.
- •6 Фізичні і хімічні властивості насичених вуглеводнів. Добування, застосування
- •16 Одноатомні спирти
- •17 Фізичні та хімічні властивості одноатомних спиртів. Застосування. Отруйність спиртів та їх згубна дія на організм людини.
- •18 Багатоатомні спирти. Етиленгліколь і гліцерин
- •24 Одноосновні карбонові кислоти
- •Значення жирів
- •28 Мила
- •Класифікація
- •Добування:
- •30 Амінокислоти
- •Класифікація
- •Класифікація
- •Хімічні властивості
- •Рибосомний синтез
- •Нерибосомний синтез
- •33 Вуглеводи. Глюкоза. Сахароза
- •Класифікація
- •34 Полісахариди
- •35 Крохмаль і целюлоза
- •36 Синтетичні високомолекулярні речовини. Полімерні матеріали. Синтетичні волокна і синтетичні каучуки, утворення гуми. Застосування полімерних матеріалів
- •37 Генетичний зв*язок між органічними і неорганічними речовинами.
- •40 Хімія і екологія.
27 Нітроген. Будова молекул
Нітроге́н— хімічний елемент V групи періодичної системи з атомним порядковим номером 7 та атомною масою 14.008. Два атоми нітрогену, об'єднюючись складають молекулу хімічної речовини азоту.
Фізичні властивості
Азот — безбарвний газ без запаху і смаку. Кипить при температурі −195,8 °C, замерзає при −209,86 °C. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Його розчинність при 20 °C становить 1,54 см3 на 100 г води (кисню — 3,1 см3). Тому розчинене у воді повітря багатше на кисень, ніж атмосферне.
Хімічні властивості
Взаємодія з металами
![]()
Взаємодія з неметалами
![]()
За дуже високих температур азот реагує з киснем:
![]()
Добування
У лабораторних умовах чистий азот зазвичай одержують шляхом розкладу при нагріванні розчину нітриту амонію за реакцією:
NH4NO2 = N2↑ + 2H2O
У промисловості азот у великих кількостях добувають з повітря за допомогою азотних станцій.
Ще один з лабораторних способів — пропускання аміаку над оксидом міді (II) при температурі ~700°C:
2NH3 + 3CuO → N2↑ + 3H2O + 3Cu
Будова молекули
Застосування
Рідкий азот застосовується як холодоагент і для кріотерапії.
Промислові застосування газоподібного азоту обумовлені його інертними властивостями. Газоподібний азот пожежо- і вибухобезпечний, перешкоджає окисленню, гниттю. У нафтохімії азот застосовується для продування резервуарів і трубопроводів, перевірки роботи трубопроводів під тиском, збільшення вироблення родовищ. У гірничодобувній справі азот може використовуватися для створення в шахтах вибухобезпечного середовища, для розпирання пластів породи. У виробництві електроніки азот застосовується для продування областей, не допускають наявності окисляє кисню. Якщо в процесі, традиційно проходить з використанням повітря, окислення або гниття є негативними факторами — азот може успішно замістити повітря.Велика частина одержуваного в техніці азоту застосовується на виробництво аміаку.Останнього часу значного розповсюдження набуло використання азоту для створення інертного середовища при проведенні деяких хімічних реакцій, при перекачуванні горючих рідин тощо.
Кругообіг нітрогену
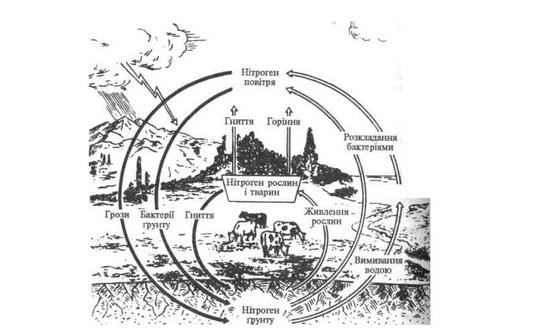
28 Амоніак. Солі амонію. Якісна реакція.
Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за –33,4ОС, він переходить у рідкий стан.
Добування
У техніці головним способом добування аміаку є прямий синтез його з азоту і водню за реакцією:
![]()
Хімічні властивості
Горіння аміаку
4NH3 + 302 ⇔ 2N2 + 6H20
Взаємодія з водою.
H2O ⇔ H+ + OH-
Взаємодія з кислотами.
NH3 + НСl = NH4Cl
Солі амонію - це кристалічні речовини з іонним типом зв'язку. До складу солей амонію входять один або кілька катіонів і аніон кислотного залишку. Солі амонію утворюються при взаємодії відповідних кислот з амоніаком або розчином гідроксиду амонію. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. В термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються.
Якісна реакція на амоній
NH4Cl + NaOH = NaCl + NH3 + H2O (виділення аміаку)
29 Оксиди нітрогену (II), (IV).
30 Нітратна кислота. Нітрати. Нітратні добрива. Якісна реакція.
Фізичні властивості
Нітратна кислота являє собою безбарвну димучу рідину з їдким запахом, легко розкладається, забарвлюючись у жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при — 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
Нітратна кислота нестійка і вже під впливом сонячного світла поступово розкладається:
4HNO3 = 4NO2 + O2 + 2H2O
При нагріванні розклад її значно прискорюється. Утворюваний діоксид азоту розчиняється в HNO3 і надає їй жовтуватого кольору. У водних розчинах нітратна кислота значно стійкіша. З водою HNO3 змішується в будь-яких співвідношеннях.
Нітратна кислота належить до сильних кислот, у водних розчинах вона практично повністю дисоціює:
![]()
У продаж нітратна кислота звичайно поступає у вигляді 68%-ного розчину з густиною 1,4 г/см³.
Хімічні властивості
Кислотні властивості
(дія на індикатори)
З кислотними оксидами
Na 2O + HNO3 = NaNO3 + H 2O CuO + HNO3 = Cu(NO 3) 2 + H 2O
З основами
Na 2CO3 + HNO3 = NaNO3 + H 2CO3
при дії концентрованої нітратної кислоти на мідь утворюється нітрат міді, діоксид азоту і вода:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
Застосування
Нітратна кислота є одним з найважливіших продуктів хімічної промисловості. Вона виробляється у дуже великих кількостях, використовується для виробництва азотних добрив, у кольоровій металургії для розділення металів, а також хімічній промисловості для виробництва пластмас, вибухових речовин, целулоїду і фотокіноплівки, штучного волокна, органічних барвників, лікувальних речовин тощо.
Нітрати— безбарвні кристалічні речовини, солі і ефіри азотної кислоти HNO3. Вони утворюються при взаємодії нітратної кислоти з відповідними металами, або їх оксидами та гідроксидами. У воді нітрати добре розчиняються. Природні солі мають кристалічну острівну будову. Виникають виключно при екзогенних процесах, часто внаслідок гниття органічних решток. Можливе також утворення азотистих сполук з азоту повітря під час громових розрядів. Застосовують як добрива, протрави при фарбуванні, компоненти вибухових речовин. Н. амонію, лужних та лужноземельних металів називають селітрами. Ефіри – безбарвні або світло-жовті, приємні на запах рідини. Містять у молекулі одну або декілька ONO2-груп, пов’язаних з органічним радикалом. Деякі ефіри (нітрогліцерин) застосовують як вибухові речовини (див. нітрогліцеринові ВР).
При сильному нагріванні нітрати розкладаються, не плавлячись. Виняток становлять лише нітрат натрію і нітрат калію, які спочатку плавляться, а потім уже розкладаються. При цьому продукти розкладу нітратів залежать від активності металу, що входить до складу солі.
Азо́тні до́брива — азотовмісні речовини, які вносять у ґрунт з метою підвищення врожайності с.-г. культур. Важливим джерелом азотних речовин для рослин є гній, сеча тварин, торф, пташиний послід, зелене добриво, компости, відходи сільського господарства і м'ясо-рибної промисловості та ін. (див. Органічні добрива). Особливо великого значення набули мінеральні азотні добрива. Вони містять азот в нітратній, аміачній, нітратно-аміачній і рідше в амідній формі.
Аміачні добрива краще вбираються ґрунтом, через це вони більш придатні для завчасного внесення. Норми внесення А. д. залежать від ґрунтово-кліматич. умов, біологіч. особливостей культур і способу внесення добрив.
Як мінеральні азотні добрива застосовують такі речовини:
Нітрат калію KNO3 (калійна селітра) являє собою безбарвну кристалічну речовину. На вологому повітрі не мокріє і не злежується. Нітрат калію — дуже цінне мінеральне добриво, в якому міститься два поживних для рослин елементи — азот і калій. Однак за агрохімічними вимогами вміст азоту в азотнокалійових добривах повинен бути більшим, ніж в KNO3. Тому нітрат калію застосовують переважно в суміші з амонійними солями.
Нітрат амонію NH4NO3 (амонійна селітра) дуже багате на азот добриво. Але нітрат амонію має істотний недолік — на вологому повітрі він мокріє, а при висиханні утворює тверді куски. Цілком сухий нітрат амонію може вибухати. Тому його застосовують як добриво в суміші з сульфатом амонію. Така суміш на повітрі не мокріє; не злежується і являє собою дуже цінне добриво, особливо під цукрові буряки, картоплю та інші культури.
Нітрат кальцію Ca(NO3)2 (кальцієва, або норвезька, селітра) — теж цінне азотне добриво. Його виробляють у великих кількостях нейтралізацією нітратної кислоти вапном. Цінність нітрату кальцію як добрива полягає також у тому, що іони кальцію Ca2+ позитивно впливають на структуру ґрунту.
Нітрат натрію NaNO3 (чилійська селітра) являє собою єдину сіль нітратної кислоти, яка утворює потужні природні родовища (в Чилі). В багатьох країнах чилійська селітра широко використовується як мінеральне добриво.
Сульфат амонію (NH4)2SO4 — одне з найстаріших азотних добрив. Його добувають у великих кількостях нейтралізацією сульфатної кислоти аміаком. Сульфат амонію не гігроскопічний і не злежується. Він значно підвищує врожайність таких культур, як жито, пшениця, картопля і особливо чай і рис.
Хлорид амонію NH4Cl одержують нейтралізацією хлоридної кислоти аміаком. Він теж не гігроскопічний і не злежується. Але на відміну від сульфату амонію його не вносять під такі культури, як цукрові буряки, тютюн тощо, оскільки іони хлору на ці культури впливають негативно.
Рідкий аміак і аміачна вода є найбагатшими добривами за вмістом азоту. Рідкий аміак, як і аміачну воду, стали застосовувати як азотні добрива лише останнім часом, коли були розроблені методи внесення в ґрунт добрив у рідкому стані.
